枯草芽孢桿菌菌株ZT4-2電擊轉(zhuǎn)化體系的建立
蔡 露,秦艷秋,高坦坦,王旭東,任爭光,趙曉燕
(北京農(nóng)學院生物與資源環(huán)境學院/農(nóng)業(yè)農(nóng)村部華北都市農(nóng)業(yè)重點實驗室,北京102206)
植物病害是影響中國農(nóng)業(yè)生產(chǎn)的重要因素,為保護生態(tài)環(huán)境,保障糧食和食品安全,生物防治是目前被優(yōu)先考慮的植物病害防治方法之一。
枯草芽孢桿菌(Bacillussubtilis)被認為是一種理想的生防細菌,廣泛分布于自然界中,抗逆性較強,耐熱、耐旱、抗紫外線,對人畜無毒無害,且具有廣譜抗菌活性[1-2],能夠抑制植物根部、枝干、花葉及果實的病原菌,可用于防治水稻紋枯病、小麥紋枯病、棉花枯萎病、棉花立枯病、番茄葉霉病、豆類根腐病等多種病害[3-4]。同時,枯草芽孢桿菌(Bacillussubtilis)也是繼大腸桿菌之后又一個在分子生物學、遺傳學研究中廣泛使用的菌株,枯草芽孢桿菌菌株的遺傳改造可以有助于更好的研究其生防機理,或者建造工程菌株,進一步提高其防治效果、擴大其應(yīng)用范圍,從而更好的發(fā)揮其生防作用。通過轉(zhuǎn)入綠色熒光蛋白(green fluorescent protein,GFP)等標記基因?qū)莶菅挎邨U菌進行熒光標記以確定其定殖位點也是熱點研究的內(nèi)容[5]。
將目的基因引入細胞是遺傳改造的方法之一,其途徑主要有電擊轉(zhuǎn)化、原生質(zhì)體轉(zhuǎn)化和化學轉(zhuǎn)化[6]。對于枯草芽孢桿菌而言,電擊轉(zhuǎn)化是三種轉(zhuǎn)化途徑中操作較為簡單、變量易控制且轉(zhuǎn)化效率較高的一種[7-8],而化學轉(zhuǎn)化與原生質(zhì)體轉(zhuǎn)化耗時長、影響因素較多且轉(zhuǎn)化效率較低[9]。電擊轉(zhuǎn)化即電穿孔,被廣泛應(yīng)用于細菌、酵母、動植物細胞的基因轉(zhuǎn)導技術(shù)中,通過高強度的電場作用,在細胞膜上形成暫時性的可復(fù)性穿孔,將外源目的DNA導入細胞,插入細胞基因組內(nèi),使DNA在細胞內(nèi)表達[10]。不同細菌、甚至不同菌株的電擊轉(zhuǎn)化條件有較大差別[11],一些菌株甚至無法進行轉(zhuǎn)化[12]。就枯草芽孢桿菌而言,枯草芽孢桿菌菌株NCD-2在37 ℃、150 r/min培養(yǎng) 3.5 h、電阻200 Ω和電場強度14.0 kV的條件下能達到較高的電擊轉(zhuǎn)化效率[9];而枯草芽孢桿菌菌株WB600在OD600 nm=0.7、質(zhì)粒體積80 ng、電阻200 Ω和轉(zhuǎn)化電壓21 kV時轉(zhuǎn)化效率較高[7]。
枯草芽孢桿菌菌株ZT4-2是北京農(nóng)學院植物保護專業(yè)實驗室保存的一株具有自主知識產(chǎn)權(quán)的生防菌株[13],該試驗從菌株不同培養(yǎng)階段、不同感受態(tài)細胞濃度、不同感受態(tài)細胞量、不同質(zhì)粒體積、不同轉(zhuǎn)化電壓等電擊轉(zhuǎn)化條件對電擊轉(zhuǎn)化效率的影響進行探索,為建立該菌株的高效遺傳轉(zhuǎn)化體系及后續(xù)分子遺傳學研究及工程菌株改造奠定基礎(chǔ)。
1 材料與方法
1.1 材 料
1.1.1 供試菌株及質(zhì)粒 枯草芽孢桿菌菌株ZT4-2由北京農(nóng)學院植物保護專業(yè)實驗室保存;帶有GFP標記的穿梭質(zhì)粒pGFP78(四環(huán)素抗性)由中國農(nóng)業(yè)大學植物病理系王琦教授惠贈。
1.1.2 供試試劑及培養(yǎng)基 抗生素(10 μg/mL):四環(huán)素(10 μg/mL)。LB液體培養(yǎng)基:每升培養(yǎng)基加入酵母提取物5 g、胰蛋白胨10 g、氯化鈉10 g。LB固體培養(yǎng)基:每升培養(yǎng)基加入酵母提取物5 g、胰蛋白胨10 g、氯化鈉10 g、瓊脂15 g。抗性培養(yǎng)基:使用時,在LB液體或固體培養(yǎng)基的基礎(chǔ)上加入對應(yīng)濃度抗生素。
1.2 試驗方法
1.2.1 質(zhì)粒pGFP78的提取及質(zhì)粒濃度測定 質(zhì)粒pGFP78的提取使用北京博邁德基因技術(shù)有限公司的高純度質(zhì)粒小量快速提取試劑盒,具體操作參考試劑盒所附說明書。質(zhì)粒濃度測定使用Thermo Fisher Scientific的超微量核酸蛋白測定儀。
1.2.2 枯草芽孢桿菌菌株ZT4-2感受態(tài)細胞的制備 依據(jù)參考文獻[14-17]進行前期試驗,最后確定制備感受態(tài)細胞的流程如下:將保存的枯草芽孢桿菌菌株ZT4-2在LB固體培養(yǎng)基上活化,挑取單菌落于5 mL LB液體培養(yǎng)基中過夜培養(yǎng)(≤16 h);在裝有100 mL的LB液體培養(yǎng)基的錐形瓶中加入1 mL過夜培養(yǎng)的菌液,在搖床中37 ℃、220 r/min震蕩培養(yǎng)至指定OD600 nm值;冰浴菌液30 min使其停止生長,4 ℃、8 000 r/min離心10 min,棄上清收集菌體;用預(yù)冷的超純水洗滌菌體5次,加入40% PEG6000懸浮沉淀,分裝備用。
1.2.3 枯草芽孢桿菌菌株ZT4-2的電擊轉(zhuǎn)化及轉(zhuǎn)化子的驗證 在分裝的感受態(tài)細胞中加入質(zhì)粒,混勻后轉(zhuǎn)移至預(yù)冷好的電擊杯中,擦干電擊杯表面的水,立即電擊;電擊完畢立刻加入800 μL的LB液體培養(yǎng)基,混勻后將其轉(zhuǎn)移至空試管中,37 ℃、150 r/min震蕩培養(yǎng)3 h;將孵化好的菌液轉(zhuǎn)移至1.5 mL離心管中,12 000 r/min離心3 min,棄上清,加入100 μL超純水重懸菌體,將重懸后的菌液涂布于相應(yīng)抗性平板上,37 ℃過夜培養(yǎng);記錄菌落數(shù),計算電擊轉(zhuǎn)化效率:電擊轉(zhuǎn)化效率(CFU/μg)=菌落數(shù)/質(zhì)粒質(zhì)量。隨機挑取單菌落,制成玻片,置于熒光顯微鏡下觀察,由于質(zhì)粒pGFP78均帶有熒光蛋白標記,因此若菌體在熒光顯微鏡下能觀察到熒光,則說明電擊轉(zhuǎn)化成功。
1.2.4 不同轉(zhuǎn)化電壓對電擊轉(zhuǎn)化效率的影響 電擊轉(zhuǎn)化時分別用1.8、2.2和2.5 kV的轉(zhuǎn)化電壓進行電擊,測定轉(zhuǎn)化電壓大小對電擊轉(zhuǎn)化效率的影響。質(zhì)粒選擇pGFP78,感受態(tài)細胞量200 μL,質(zhì)粒體積10 μL,電擊杯寬度0.2 cm,電擊轉(zhuǎn)化方法及轉(zhuǎn)化效率計算同“1.2.3”。
1.2.5 對數(shù)生長期不同階段對電擊轉(zhuǎn)化效率的影響 按照“1.2.2”的方法,將枯草芽孢桿菌菌株ZT4-2培養(yǎng)至OD600 nm值分別為0.3、0.4、0.5、0.6、0.8和1.0,參照“1.2.2”制備感受態(tài)細胞,測定菌株對數(shù)生長期不同階段對枯草芽孢桿菌菌株ZT4-2電擊轉(zhuǎn)化效率的影響。質(zhì)粒選擇pGFP78,質(zhì)粒體積10 μL,感受態(tài)細胞量200 μL,電場強度2.5 kV,電擊杯寬度0.2 cm,電擊轉(zhuǎn)化方法及轉(zhuǎn)化效率計算同“1.2.3”。
1.2.6 不同感受態(tài)細胞濃度對電擊轉(zhuǎn)化效率的影響 制作枯草芽孢桿菌菌株ZT4-2感受態(tài)細胞步驟中最后懸浮沉淀時按起始菌液每100 mL分別加入600 μL或1 200 μL的40% PEG6000,測定不同感受態(tài)細胞濃度對電擊轉(zhuǎn)化效率的影響。質(zhì)粒選擇pGFP78,質(zhì)粒體積10 μL,感受態(tài)細胞量200 μL,電場強度2.5 kV,電擊杯寬度0.2 cm,電擊轉(zhuǎn)化方法及轉(zhuǎn)化效率計算同“1.2.3”。
1.2.7 不同感受態(tài)細胞量對電擊轉(zhuǎn)化效率的影響 電擊轉(zhuǎn)化時分別加入200 μL及100 μL的感受態(tài)細胞,以測定不同感受態(tài)細胞量對電擊轉(zhuǎn)化效率的影響。質(zhì)粒選擇pGFP78,質(zhì)粒體積10 μL,電場強度2.5 kV,電擊杯寬度0.2 cm,電擊轉(zhuǎn)化方法及轉(zhuǎn)化效率計算同“1.2.3”。
1.2.8 不同質(zhì)粒體積對電擊轉(zhuǎn)化效率的影響 電擊轉(zhuǎn)化時分別加入10 μL及5 μL的質(zhì)粒,測定不同質(zhì)粒體積對電擊轉(zhuǎn)化效率的影響。質(zhì)粒選擇pGFP78,感受態(tài)細胞量200 μL,電場強度2.5 kV,電擊杯寬度0.2 cm,電擊轉(zhuǎn)化方法及轉(zhuǎn)化效率計算同“1.2.3”。
1.3 顯著性差異分析
利用SPSS軟件進行差異性分析。自變量為2個時進行獨立樣本T檢驗,自變量≥3時進行單因素ANOVA檢驗。
2 結(jié)果與分析
2.1 不同轉(zhuǎn)化電壓對電擊轉(zhuǎn)化效率的影響
采用電擊轉(zhuǎn)化方法測試不同轉(zhuǎn)化電壓對枯草芽孢桿菌菌株ZT4-2電擊轉(zhuǎn)化效率的影響,結(jié)果如圖1。當轉(zhuǎn)化電壓2.5 kV時,平均電擊轉(zhuǎn)化效率最高,為411.80 CFU/μg;轉(zhuǎn)化電壓2.2 kV時,平均電擊轉(zhuǎn)化效率最低,僅有91.20 CFU/μg;轉(zhuǎn)化電壓1.8 kV時,平均電擊轉(zhuǎn)化效率位于二者之間,為101.20 CFU/μg。利用SPSS進行差異性分析,可知2.5 kV時的轉(zhuǎn)化效率與1.8 kV及2.2 kV時的電擊轉(zhuǎn)化效率有顯著性差異(P<0.05)。在后續(xù)試驗中都采用轉(zhuǎn)化電壓2.5 kV進行轉(zhuǎn)化。
2.2 枯草芽孢桿菌菌株ZT4-2對數(shù)生長期不同階段對電擊轉(zhuǎn)化效率的影響
采用電擊轉(zhuǎn)化方法測試枯草芽孢桿菌菌株ZT4-2培養(yǎng)時對數(shù)生長期不同階段對菌株電擊轉(zhuǎn)化效率的影響(圖2)。隨著培養(yǎng)液OD600 nm值的升高,電擊轉(zhuǎn)化效率逐漸升高。當OD600 nm=1.0時電擊轉(zhuǎn)化效率最高可達到6 823.67 CFU/μg;其次是OD600 nm=0.8時,平均電擊轉(zhuǎn)化效率達到4 884.67 CFU/μg;OD600 nm=0.6時,轉(zhuǎn)化效率大幅下降,平均電擊轉(zhuǎn)化效率僅411.77 CFU/μg;當OD600 nm<0.6時,轉(zhuǎn)化效率明顯過低。利用SPSS進行差異性分析,可知OD600 nm=1.0與其他OD600 nm值時的電擊轉(zhuǎn)化效率均存在著顯著性差異(P<0.05),因此在后續(xù)試驗中采用培養(yǎng)到OD600 nm=1.0的細菌進行轉(zhuǎn)化。
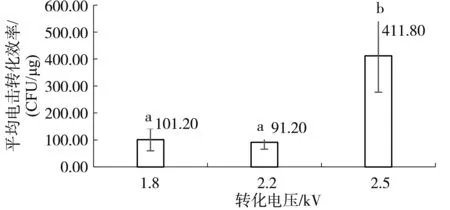
圖1 轉(zhuǎn)化電壓對電擊轉(zhuǎn)化效率的影響Fig.1 The effect of electric shock voltage on transformation efficiency
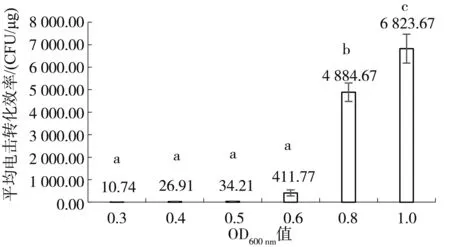
圖2 對數(shù)生長期不同階段對電擊轉(zhuǎn)化效率的影響Fig.2 The effect of logarithmic growth periods on transformation efficiency
2.3 不同感受態(tài)細胞濃度對電擊轉(zhuǎn)化效率的影響
在制作感受態(tài)細胞的最后階段加入的40%PEG6000的量會影響感受態(tài)細胞的濃度,測試兩種不同感受態(tài)細胞濃度(每100 mL起始菌液加入600 μL的40% PEG6000或1 200 μL 的40% PEG6000)對枯草芽孢桿菌菌株ZT4-2電擊轉(zhuǎn)化效率的影響見圖3。40% PEG6000加入量600 μL時,平均電擊轉(zhuǎn)化效率達到656.00 CFU/μg;40% PEG6000加入量1 200 μL時,平均電擊轉(zhuǎn)化效率為186.10 CFU/μg。40% PEG6000加入量600 μL時的電擊轉(zhuǎn)化效率顯著高于40% PEG6000加入量1 200 μL時的轉(zhuǎn)化效率(P<0.05),因此在制作感受態(tài)細胞的最后階段加入600 μL 40% PEG6000得到的感受態(tài)濃度更利于電擊轉(zhuǎn)化效率的提高。
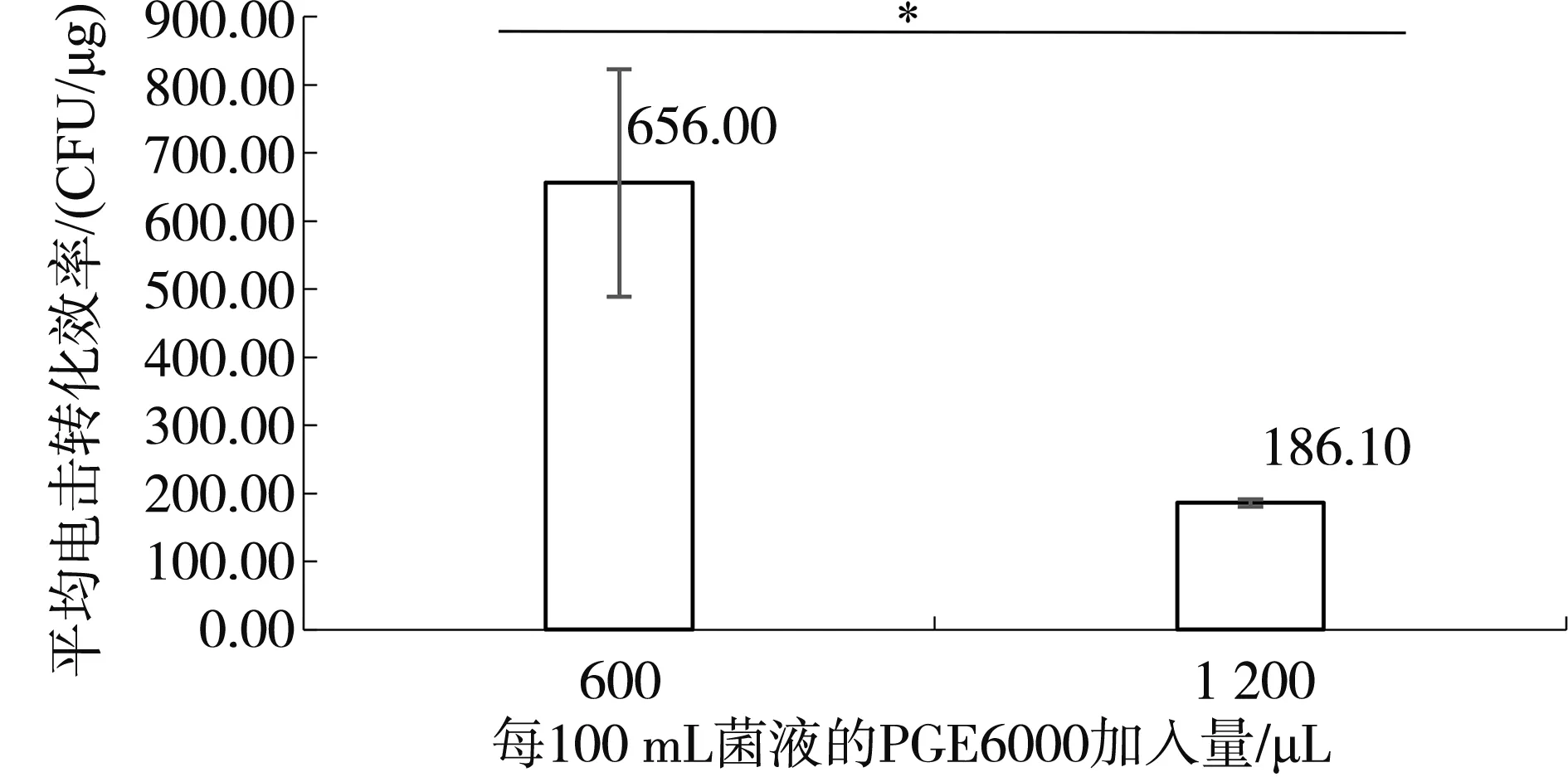
圖3 感受態(tài)細胞濃度對電擊轉(zhuǎn)化效率的影響Fig.3 The effect of competent cell concentration on transformation efficiency
2.4 不同感受態(tài)細胞量對電擊轉(zhuǎn)化效率的影響
采用電擊轉(zhuǎn)化方法測試不同感受態(tài)細胞量對枯草芽孢桿菌菌株ZT4-2電擊轉(zhuǎn)化效率的影響,結(jié)果如圖4。在一個轉(zhuǎn)化體系中,感受態(tài)細胞量200 μL時,平均電擊轉(zhuǎn)化效率186.10 CFU/μg;感受態(tài)細胞100 μL時,平均電擊轉(zhuǎn)化效率42.60 CFU/μg。利用SPSS進行差異性分析,可知感受態(tài)細胞量200 μL與感受態(tài)細胞量100 μL時的轉(zhuǎn)化效率存在顯著性差異(P<0.05)。感受態(tài)細胞量200 μL時的平均電擊轉(zhuǎn)化效率是感受態(tài)細胞量100 μL時的3倍多,因此電擊轉(zhuǎn)化時感受態(tài)細胞量200 μL會獲得更好的電擊轉(zhuǎn)化效率。
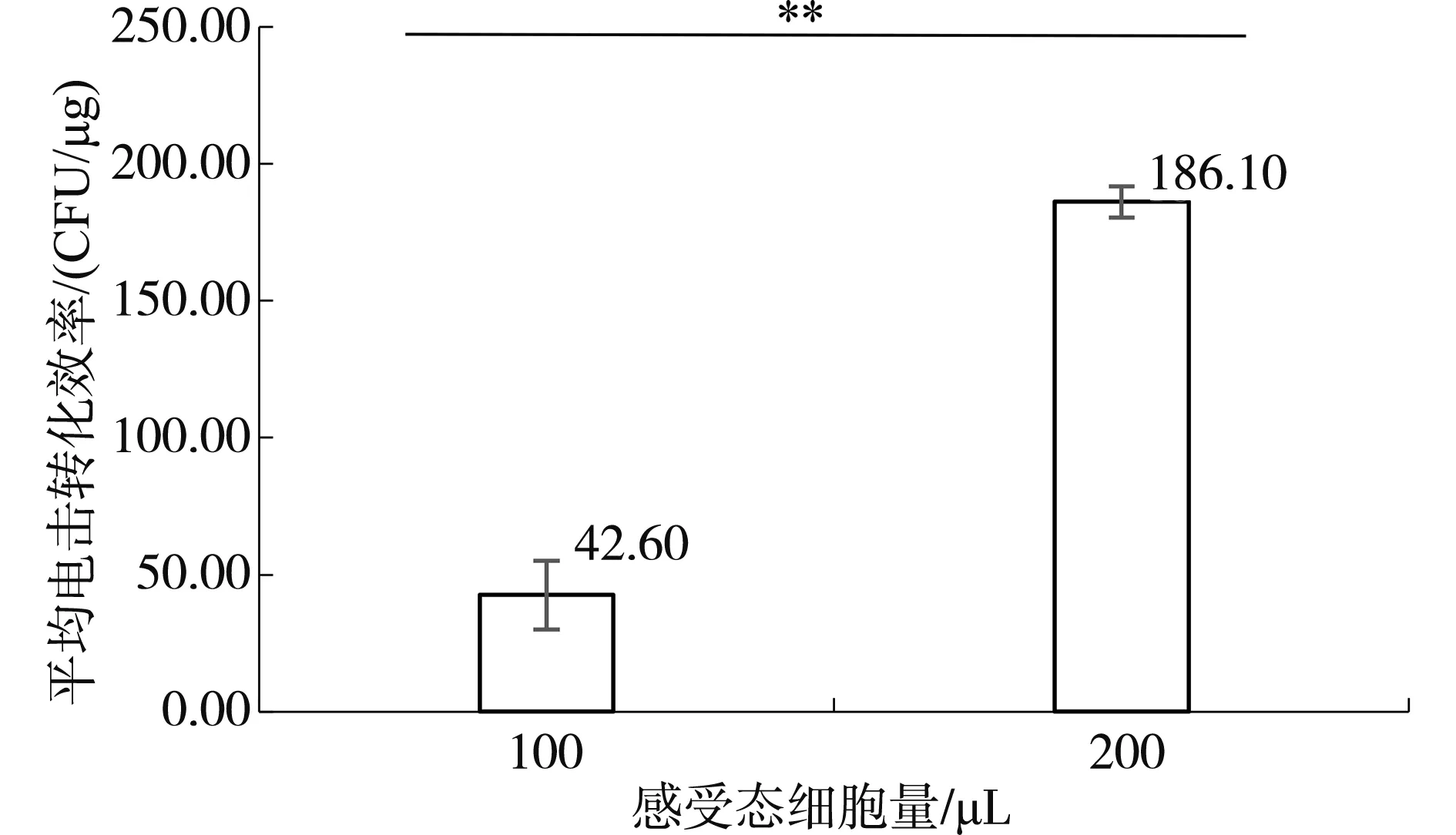
圖4 感受態(tài)細胞量對電擊轉(zhuǎn)化效率的影響Fig.4 The effect of competent cell amount on transformation efficiency
2.5 不同質(zhì)粒體積對電擊轉(zhuǎn)化效率的影響
采用電擊轉(zhuǎn)化方法測試電擊轉(zhuǎn)化體系中加入不同質(zhì)粒體積對枯草芽孢桿菌菌株ZT4-2電擊轉(zhuǎn)化效率的影響,結(jié)果如圖5。當感受態(tài)細胞濃度較高(40% PEG6000加入600 μL)時:質(zhì)粒體積10 μL時,平均電擊轉(zhuǎn)化效率785.90 CFU/μg;質(zhì)粒體積5 μL時,平均電擊轉(zhuǎn)化效率656.00 CFU/μg,二者之間不存在顯著性差異。當感受態(tài)細胞濃度較低(40% PEG6000加入1 200 μL)時:質(zhì)粒體積10 μL時,平均電擊轉(zhuǎn)化效率242.30 CFU/μg;質(zhì)粒體積5 μL時,平均電擊轉(zhuǎn)化效率142.60 CFU/μg,二者之間存在顯著性差異(P<0.05)。此現(xiàn)象可能表明,在感受態(tài)細胞濃度較低的情況下電擊轉(zhuǎn)化效率與加入的質(zhì)粒體積成正比,但在感受態(tài)細胞濃度較大的情況下加入不同的質(zhì)粒體積對電擊轉(zhuǎn)化效率的影響較小。

圖5 質(zhì)粒體積對電擊轉(zhuǎn)化效率的影響Fig.5 The effect of plasmid volume on transformation efficiency
2.6 枯草芽孢桿菌菌株ZT4-2轉(zhuǎn)化子的驗證
挑取“2.2”的抗生素抗性轉(zhuǎn)化子進行熒光標記的檢查,陽性轉(zhuǎn)化子的菌體在熒光顯微鏡下能產(chǎn)生熒光,說明電擊轉(zhuǎn)化成功(圖6)。

注;A是明場;B是暗場。Note: A is bright field; B is dark field.圖6 枯草芽孢桿菌菌株ZT4-2轉(zhuǎn)化子的驗證Fig.6 Verification of transformants of Bacillus subtilis ZT4-2 strain
3 討 論
通過該試驗建立了枯草芽孢桿菌菌株ZT4-2的電擊轉(zhuǎn)化體系。相關(guān)重要環(huán)節(jié)的條件:制備感受態(tài)細胞時,菌液培養(yǎng)至OD600 nm值為1.0;最后重懸菌體時加入40% PEG6000的體積600 μL/100 mL 起始菌液;電擊轉(zhuǎn)化體系中,感受態(tài)細胞量200 μL,質(zhì)粒體積10 μL,轉(zhuǎn)化電壓2.5 kV。在該體系中,電擊轉(zhuǎn)化效率最高可達6 823.67 CFU/μg。
電擊轉(zhuǎn)化是一種簡單高效的基因轉(zhuǎn)導方法,但對于不同的菌株電擊轉(zhuǎn)化的條件及效率差別較大,枯草芽孢桿菌是一種革蘭氏陽性菌,由于革蘭氏陽性菌細胞壁較厚且致密,其電擊轉(zhuǎn)化效率比革蘭氏陰性菌低[18],因此探索不同電擊轉(zhuǎn)化條件對電擊轉(zhuǎn)化效率的影響,建立枯草芽孢桿菌的高效電擊轉(zhuǎn)化體系,就能更好利用目的基因?qū)莶菅挎邨U菌進行遺傳改造,從而進行更進一步的研究。利用PEG6000的電轉(zhuǎn)化方法鮮有報道,在經(jīng)過不斷試驗和方法改善后,選擇該方法進行枯草芽孢桿菌菌株ZT4-2的電擊轉(zhuǎn)化體系的建立,轉(zhuǎn)化效率較為穩(wěn)定,為今后對枯草芽孢桿菌菌株ZT4-2進行基因工程研究提供支持。
一般來說,菌株對電擊轉(zhuǎn)化時的電場強度非常敏感,提高轉(zhuǎn)化電壓可以增加目的基因進入細胞的幾率,同時也會增加細胞的死亡概率,為了獲得更高的電擊轉(zhuǎn)化效率,必須同時兼顧細胞的死亡率和轉(zhuǎn)化率來選擇合適的轉(zhuǎn)化電壓。不同菌株對電場強度的敏感性不同,如貝萊斯芽孢桿菌菌株3A3-15在電擊轉(zhuǎn)化電壓1.75 kV時效率最高[18],枯草芽孢桿菌菌株WB600在電擊轉(zhuǎn)化電壓21 kv時的轉(zhuǎn)化效率最高[7],枯草芽孢桿菌菌株NCD-2的最優(yōu)電擊轉(zhuǎn)化電壓14.0 kV[9]。該試驗證明,轉(zhuǎn)化電壓2.5 kV時枯草芽孢桿菌菌株ZT4-2的電擊轉(zhuǎn)化效率最高。
通常認為對數(shù)生長初期進行電擊轉(zhuǎn)化的轉(zhuǎn)化效率高于對數(shù)生長中后期的效率[19],并且不同菌株想要達到較高電擊轉(zhuǎn)化效率所需的階段不一定相同,如枯草芽孢桿菌菌株WB600在菌液培養(yǎng)至OD600 nm=0.7時轉(zhuǎn)化效率最高[7],而枯草芽孢桿菌菌株NCD-2在菌液培養(yǎng)至OD600 nm=1.2時轉(zhuǎn)化效率最高[9]。該試驗探究枯草芽孢桿菌菌株ZT4-2處于對數(shù)生長初期最適合進行電擊轉(zhuǎn)化的OD600 nm值, OD600 nm值在0.3~1.0時隨著OD600 nm值的升高,電擊轉(zhuǎn)化效率逐漸升高,當OD600 nm=1.0時,電擊轉(zhuǎn)化效率最高。
PEG是用于細胞融合的最常用的化學融合劑,最后一次重懸細胞沉淀選擇加入40% PEG6000是為了促進細胞膜的變化[20],從而獲得更好的電擊轉(zhuǎn)化效率。PEG6000的促進作用取決于其濃度、加入量及作用時間,但增加其加入量也相當于對感受態(tài)細胞濃度進行稀釋。每100 mL起始菌液加入600 μL 40% PEG6000時的電擊轉(zhuǎn)化效率顯著高于加入1 200 μL 40%PEG6000時的電擊轉(zhuǎn)化效率,并且不受轉(zhuǎn)化時質(zhì)粒體積的影響,而在低濃度下,質(zhì)粒體積加入較多時電擊轉(zhuǎn)化效率會高于質(zhì)粒體積較少時的轉(zhuǎn)化效率。

