小魚際法對骨骼肌鈍性損傷家兔生長分化因子8與F-肌動蛋白的影響
陳海南 盧園 楊舟 孫夢龍 王蘭蘭 薛惠天 彭亮

1 材料與方法
1.1 實驗動物
18只3月齡的新西蘭大耳白兔,雌雄各半,體質量范圍為252.41~320.67克,由湖南中醫藥大學基礎研究所實驗動物中心提供[動物許可證號:SYXK(湘)2015-0008]。動物飼養環境溫度恒定在20~25℃,濕度保持50%~70%。
1.2 試劑與儀器
蛋白磷酸酶抑制劑(北京普利萊),蛋白酶抑制劑(北京金泰宏達),標準電泳裝置(北京六一),ZTC-II按摩手法測試儀(上海騰蔭教學儀器有限公司),石蠟切片機(浙江金華),TGF-β1、IL-6試劑盒(武漢華美,批號:C0358190399、G19035853),電熱恒溫培養箱(北京永光明),全自動酶標洗板機與分析儀(深圳匯松科技)。
1.3 動物分組與造模

根據文獻[10]中的改進方法,實驗前適應性喂養7天后,使用自制重錘擊打家兔右后肢以建立股四頭肌損傷模型。模型具體制備過程:將兔腹部朝上固定于實驗臺,選取右后肢的股四頭肌肌腹中部為圓心,畫一直徑1 cm的圓圈標記擊打處,并覆蓋一層紗布防止擊打過程中造成表皮損傷。專人使用特制重錘(質量850 g,用于擊打的錘面為光滑木質圓柱,直徑1.5 cm)從40 cm高處沿光滑不銹鋼管以自由落體方式下落擊打標記的受擊處,連續擊打6次。測算求得每次擊打的動能為3.33 J,沖量為2.38 Ns,擊打面積約為1.77 cm2。擊打過程中有專人以手固定兔腿部,防止因家兔掙扎移動導致擊打部位偏移或造成其他外傷。造模成功標準為肉眼觀察受擊處有明顯的淤血腫脹,且無明顯皮膚損傷與骨折,以手輕觸時家兔有明顯的逃避反射。滿足上述條件認定造模成功,將造模成功兔放回籠中正常飼養。
1.4 小魚際法治療

1.5 指標檢測
1.5.1 取材 造模后第8天,采用耳緣靜脈注射空氣處死動物,保證取材過程中的無菌環境后暴露分離股四頭肌,切取損傷最為嚴重的骨骼肌組織用于后續檢測。
1.5.2 骨骼肌組織形態學觀察 切取適量受損最嚴重部位的骨骼肌組織,進行常規固定、脫水、石蠟包埋、切片,隨后進行蘇木精—伊紅(hematoxylin-eosin,HE)染色,染色后以中性樹膠封片,置于顯微鏡下進行組織形態學觀察。
1.5.3 Western Blot法檢測骨骼肌組織GDF-8與F-肌動蛋白的表達 剪取0.03 g受損最嚴重部位的骨骼肌組織,用冰預冷PBS洗組織,剪碎后放入生物樣品均質儀,并向其中加入400 μL RIPA裂解液,反復研磨直至肉眼無法觀測到組織塊,冰上裂解10分鐘后,置于已經預冷的離心機上,在4℃下以12 000 r/min離心15分鐘,提取上清液轉移至1.5 mL離心管中,后經過制膠、蛋白上樣、電泳、轉膜、封閉、抗體孵育、顯色曝光,檢測骨骼肌中GDF-8和F-肌動蛋白表達量,以GAPDH作為內參蛋白,重復3次。
1.5.4 ELISA法檢測骨骼肌組織TGF-β1與IL-6的表達 剪取適量受損最嚴重部位的骨骼肌組織,用1×PBS洗去血污并置于組織研磨器中制成組織勻漿,-20℃保存一晚后經2次凍融處理破壞細胞膜,后將組織勻漿置于2~8℃以5 000 g轉速離心5分鐘,提取上清液。試劑盒于低溫取出后置于室溫至少30分鐘,并通過離心、稀釋、溶解、吹打混勻等步驟配置。在反應終止后5分鐘內用酶標儀在450 nm波長依序測量各孔的光密度(OD值)。
1.6 統計學處理

2 結果
2.1 小魚際法對骨骼肌損傷家兔骨骼肌組織病理學的影響
骨骼肌組織HE染色結果可見,空白組肌細胞分布緊密,無明顯間隙;模型組大量肌細胞破損變形,細胞間隙相比空白組顯著增大,細胞間大量肌纖維、瘢痕形成;治療組細胞間隙相比于模型組更小,細胞間纖維組織較少,細胞形態更接近健康肌細胞。見圖1。
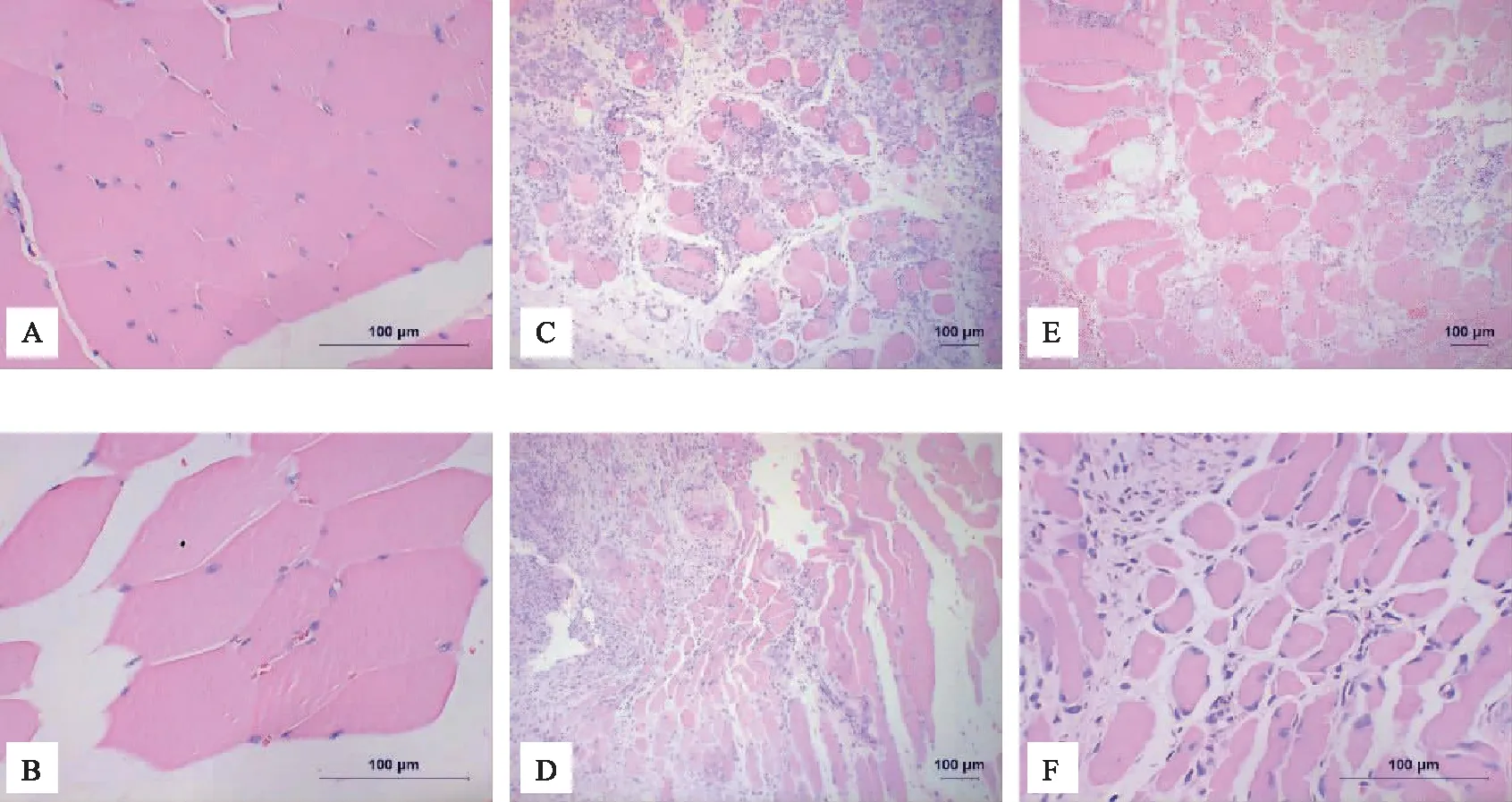
注:A、B 空白組;C、D 模型組;E、F 治療組。
2.2 小魚際法對骨骼肌損傷家兔骨骼肌組織GDF-8、F-肌動蛋白表達的影響
與空白組相比,模型組與治療組GDF-8表達量都出現顯著上升,同時治療組GDF-8表達水平顯著低于模型組。與空白組相比,模型組與治療組F-肌動蛋白表達量都出現顯著上升,同時治療組F-肌動蛋白表達水平顯著低于模型組。上述差異均有統計學意義(P<0.05)。見圖2、表1。

注:1、4 空白組;2、5 模型組;3、6治療組。

表1 小魚際法對骨骼肌損傷家兔骨骼肌組織GDF-8、F-肌動蛋白表達的影響
2.3 小魚際法對骨骼肌損傷家兔骨骼肌組織TGF-β1、IL-6表達的影響
模型組TGF-β1表達量相比于空白組有明顯上升,治療組TGF-β1表達量相比于模型組又有進一步提升。模型組、治療組IL-6的表達量相比于空白組均出現明顯上升,但治療組相比于模型組則出現了明顯的下降。上述差異均有統計學意義(P<0.05)。見表2。

表2 小魚際法對骨骼肌損傷家兔骨骼肌組織TGF-β1、IL-6表達的影響
3 討論

生理學實驗觀察證明,當骨骼肌嚴重損傷時,需要先通過中性粒細胞與巨噬細胞引發的炎癥反應清除壞死組織,而后周邊正常肌肉組織開始分裂增生以修復損壞肌肉[12]。正常肌肉組織的增生依賴于肌膜的完整性與附著于其上肌核的存活,而當損傷過于嚴重時,過多壞死組織會使得機體不得不依賴長時間的炎癥反應來清理患處。這會損傷周邊組織,造成肌肉組織的增生能力下降。此時結締組織修復會占據主導,損傷部位會被填充大量纖維化結締組織,從而形成瘢痕,造成肌肉彈性與收縮能力下降。因此加快正常肌肉組織的再生速度,減緩肌肉纖維化與損傷后的炎癥反應是保障損傷后肌肉運動功能恢復的關鍵[13-14]。
GDF-8是一種能夠抑制肌肉生長的蛋白質,最早由遺傳學家McPherron和Se-Jin Lee于1997年發現[15]。研究證實這一物質能有效抑制肌肉的生長與肌肉量,而缺乏GDF-8的動物個體,在保證營養的前提下即使不經過鍛煉,肌肉生長速度與肌肉量也顯著高于同類正常個體。F-肌動蛋白則在早期已被證明是一種參與肌肉組織修復與肌肉運動功能的重要蛋白質。在肌肉損傷恢復過程中,眾多研究表明TGF-β1是抑制炎癥反應的一種重要生理因子[16-18],而IL-6則是一種重要的促炎因子,在外傷、手術等情況時其表達水平往往會急劇升高,引發嚴重的炎癥反應[19]。目前從GDF-8與F-肌動蛋白這兩項指標探討推拿治療骨骼肌損傷與抑制炎癥反應的內在機理研究較少,故而揭示推拿治療骨骼肌損傷、抑制炎癥反應與GDF-8和F-肌動蛋白這兩項指標之間的關系,可以為推拿治療骨骼肌損傷提供多角度的生理學依據,也可以為后續的臨床改良與深入實驗研究提供新思路與方向。


