綠原酸共價和非共價作用對黑豆蛋白納米乳穩定性和抗氧化性的影響
金 花,江連洲,馮海瑩,王菊兵,張曉松,許 晶,*
(1.東北農業大學文理學院,黑龍江 哈爾濱 150030;2.東北農業大學食品學院,黑龍江 哈爾濱 150030)
乳液運載體系具有較好的穩定性和運載能力,是脂溶性生物活性物質的重要載體,能夠有效改善親脂性物質的水溶性、穩定性和生物利用率,在食品、醫藥和化妝品領域都有很大的應用前景和潛力[1-3]。乳液的性能通常與乳化劑的使用密切相關。乳化劑不僅能夠在油水界面處形成分隔層,穩定乳液,更重要的是高抗氧化性的乳化劑還會有效防止被載活性物質的氧化降解[4-5]。鑒于綠色、安全的特點,天然蛋白乳化劑近些年逐漸受到更多的關注。同時,探索可行方法來提高天然蛋白乳化能力和抗氧化性,進而改善乳液運載系統的穩定性和抗氧化性,一直是研究的熱點方向[3-5]。
黑豆蛋白是一種兼具營養價值和乳化性能的食品級乳化劑。黑豆蛋白的氨基酸組成非常合理,必需氨基酸含量高,利于人體消化吸收。除此之外,蛋白質親水、親油的兩親結構,使黑豆蛋白能夠吸附在水油界面上,形成一層有韌性的乳化薄膜,表現出良好的乳化性能[6]。但是,近年來國內外對黑豆蛋白的研究多集中在酶法改性和物理改性等方面[6-7],對黑豆蛋白納米乳的研究相對較少。
雖然天然蛋白乳化劑能夠有效穩定乳液,但是其抗氧化性通常較差,在提高乳液氧化穩定性,抑制被載活性物質的氧化降解等方面還有不足。綠原酸是一種天然的羥基肉桂酸類化合物,具有較強的抗氧化、抗炎、抗癌、抗高血壓和抗血脂等生理功效[8]。并且,綠原酸可以通過共價和非共價的方式,與蛋白質相互作用形成具有抗氧化性的復合物,從而在提高乳化劑的乳化能力的基礎上,進一步提高乳化劑的抗氧化性[8-9]。Karefyllakis等[10]以非共價作用交聯向日葵蛋白和綠原酸,結果表明:向日葵蛋白-綠原酸復合物的界面張力較天然蛋白顯著降低,蛋白乳化性明顯提高。Jiang Jiang等[11]以綠原酸非共價修飾乳清蛋白和酪蛋白,發現在多酚的作用下,蛋白結構展開,表面疏水性和溶解性顯著升高,起泡性也明顯增強。Chen Yichun[12]和Liu Fuguo[9]等研究均發現蛋白質與綠原酸共價結合后,多酚可作為H+供體終止自由基鏈反應,從而改善蛋白-綠原酸共價復合物的抗氧化性。由此可見,以蛋白質-多酚復合物為乳化劑構建乳液運載體系,應該是提高乳液穩定性和抗氧化性的可行途徑。
目前,有關多酚交聯對蛋白質結構和性質影響的研究較為充分。如Sui Xiaonan等[13]研究了大豆蛋白與花青素之間的共價和非共價作用,發現花青素能夠改變大豆蛋白結構,提高蛋白質的乳化性和起泡性,并且共價作用更加穩定,所制備的大豆蛋白-花青素共價復合物性質更好。但是,現階段對比共價和非共價2種不同作用機制,進而探討其乳液的基本特性和穩定性的研究鮮見報道。因此,本研究以共價和非共價2種作用機制,采用綠原酸交聯黑豆蛋白制備黑豆蛋白-綠原酸共價和非共價復合物,研究不同作用機制下,多酚對蛋白結構和性質的影響,尤其是乳化性和抗氧化性;分別以黑豆蛋白-綠原酸共價和非共價復合物為乳化劑,制備納米乳液,測定乳液的基本性質,并探討綠原酸對乳液穩定性的影響,旨在為開發高抗氧化性的食品級乳液運載體系提供一定理論基礎和參考。
1 材料與方法
1.1 材料與試劑
黑豆 黑龍江省和糧農業有限公司;綠原酸(98%) 北京索萊寶科技有限公司;其他試劑為分析純。
1.2 儀器與設備
XJA-100A型微型高速粉碎機 南京環科分析儀器有限公司;Z36HK高速離心機 德國Hermle 公司;T6新世紀紫外-可見分光光度計 北京普析通用儀器有限責任公司;Chirascan圓二色譜儀 英國Applied Photophysis公司;LS55熒光分光光度計 英國PerkinElmer Llantrisant公司;Malvern Nano-S90納米激光粒度儀、Zetasizer Nano Zeta電位分析儀 英國Malvern公司;FT200-SH數顯高速均質分散機 上海標本模型廠;JY92-2D超聲波細胞粉碎機 寧波新芝生物科技股份有限公司。
1.3 方法
1.3.1 黑豆分離蛋白的提取
參考Jiang Lianzhou等[6]的方法。黑豆去皮后粉碎,過50 目篩得豆粉,正己烷混合脫脂。將脫脂黑豆粉與去離子水按質量比1∶10混合分散,加1 mol/L的NaOH溶液,調節體系pH 8.5,攪拌1.5 h后,4 000 r/min離心15 min,取上清液加1 mol/L的HCl溶液,調節體系pH 4.5,靜置2 h,再次4 000 r/min離心20 min,取沉淀加去離子水溶解后,加1 mol/L的NaOH溶液,調節體系pH 7.0,得黑豆蛋白溶液,凍干后備用。以凱式定氮法測定黑豆蛋白質量分數為(84.15±3.46)%。
1.3.2 黑豆蛋白-綠原酸共價和非共價化合物的制備
參考Ferraro[14]和Yang Chen[15]等的實驗方法,先將黑豆蛋白和綠原酸分別充分溶解,然后將黑豆蛋白溶液和多酚溶液混合,控制黑豆蛋白質量濃度為4 mg/mL,綠原酸含量分別為0、5、25、50、150、250 μmol/g(蛋白)。在pH 7.0(非共價作用)或pH 9.0(共價作用)條件下,持續攪拌2 h(非共價作用)或12 h(共價作用),期間滴加NaOH或HCl溶液保持體系pH值穩定。以3 500 kDa的透析袋,用磷酸鹽緩沖液(0.01 mol/L,pH 7.0)對產物透析48 h,去除剩余綠原酸。透析后溶液經凍干后,得黑豆蛋白-綠原酸非共價復合物和黑豆蛋白-綠原酸共價復合物。
1.3.3 多酚結合率的測定
參考Gong Ying等[16]的實驗方法,取0.5 mL一定濃度的樣品溶液,加入2.5 mL福林-酚試劑(0.2 mol/L), 避光反應5 min后,加入2 mL Na2CO3溶液(7.5 g/100 mL),繼續避光反應2 h后,于波長760 nm處測定吸光度,繪制綠原酸標準曲線,并按式(1)計算多酚結合率:

1.3.4 熒光光譜測定
以280 nm為激發波長,取質量濃度為0.2 mg/mL的樣品溶液,進行熒光光譜掃描(300~525 nm)[17]。
1.3.5 圓二色光譜測定
蛋白樣品溶于pH 7.0的磷酸鹽緩沖溶液中,蛋白質量濃度為0.15 mg/mL。在波長190~260 nm范圍內測定圓二色光譜,掃描速率75 nm/min,分辨率0.1 nm。用“CDNN”軟件對數據進行處理,計算蛋白中各二級結構的含量[18]。
1.3.6 乳化活性和乳化穩定性測定
參考Pearce等[19]的方法,取1 mg/mL蛋白溶液以體積比3∶1與大豆油混合,10 000 r/min均質2 min。分別在均質后的第0分鐘和第10分鐘時,吸取40 μL底部液體,與5 mL十二烷基硫酸鈉溶液(1 mg/mL)振蕩混勻,于波長500 nm處測量吸光度,按式(2)、(3)計算乳化活性和乳化穩定性:
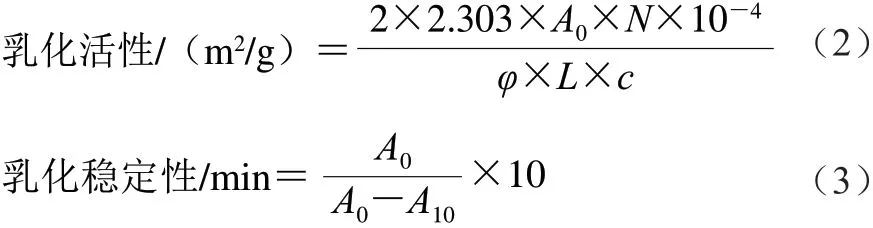
式中:A0、A10分別為均質后第0、10分鐘時乳液的吸光度;N為稀釋因子(125);φ為油相的體積占比(0.25);L為比色杯的厚度(1 cm);c為蛋白質量 濃度/(mg/mL)。
1.3.7 抗氧化性測定
1.3.7.1 ABTS陽離子自由基清除能力
根據Pellegrini等[20]的方法。配制2,2′-聯氮基-雙-(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(2,2′-amino-di(3-ethylbenzothiazoline sulphonic acid-6)ammonium salt,ABTS)溶液(pH 7.0,ABTS 7 mmol/L,K2S2O82.45 mmol/L)。 稀釋此溶液至所需質量濃度,取3 mL加入1 mg/mL的樣品溶液30 μL,避光反應5 min后,測定波長734 nm處吸光度A,對照空白ABTS陽離子自由基溶液吸光度A0,按 式(4)計算ABTS陽離子自由基清除率:
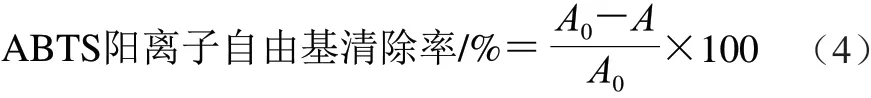
1.3.7.2 DPPH自由基清除能力
根據Gong Ying等[21]的方法。混合樣品溶液(1 mL,1 mg/mL)與1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH)-乙醇溶液(4 mL 0.1 mmol/L), 避光反應30 min,測定波長517 nm處吸光度A,對比樣品乙醇溶液吸光度Ai和DPPH-乙醇溶液吸光度Aj,按 式(5)計算DPPH自由基清除率:
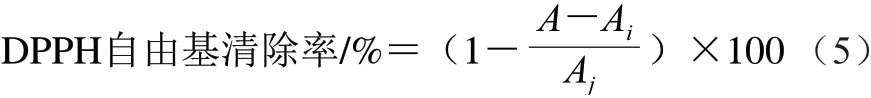
1.3.7.3 鐵離子還原能力
根據Yildirim等[22]的方法。充分混合樣品溶液(1 mL,1 mg/mL),K3[Fe(CN)6]溶液(2.5 mL,10 mg/mL) 和pH 6.6的磷酸鹽緩沖溶液(2.5 mL,0.2 mol/L),并于50 ℃水浴中反應20 min。然后,將體系冷卻至室溫,再加0.1 g/mL TCA溶液2.5 mL,混勻后5 000 r/min離心10 min。取2.5 mL上清液加同體積蒸餾水稀釋,與FeCl3溶液(0.5 mL,10 mg/mL)充分混合,反應10 min后,測定波長700 nm處吸光度。
1.3.8 乳液的制備
按照體積比97∶3的比例混合水相(蛋白20 mg/mL)和油相(大豆油)。首先,利用高速均質分散機10 000 r/min 分散4 min,制備粗乳液。然后,將直徑0.636 cm的鈦探針置于粗乳液中,繼續用超聲波細胞粉碎機,超聲功率400 W超聲15 min,制得終乳液[23]。
1.3.9 乳液粒徑及Zeta電位測定
利用納米激光粒度儀和電位分析儀分別測定乳液的粒徑和Zeta電位。測定前需用pH 7.0的磷酸鹽緩沖液稀釋樣品至適當濃度,以避免多重光散射效應。
1.3.10 界面蛋白含量測定
根據Chen Maoshen等[24]的方法。10 000 r/min離心乳液60 min,使乳液分層。吸取下層水相清液,經0.45 μm水系過濾膜過濾后,用Lowry法測定蛋白濃度cf。然后,重復相同步驟測定起始蛋白乳化劑濃度c0,以及離心后上清液蛋白濃度cs,按式(6)計算界面蛋白(adsorbed protein at the interface,AP)含量:

1.3.11 乳液穩定性測定
1.3.11.1 貯存穩定性于4 ℃條件下冷藏貯存乳液30 d,每10 d測定乳液粒徑一次,以乳液粒徑為指標分析其貯存穩定性。
1.3.11.2 氧化穩定性
于4 ℃條件下冷藏貯存乳液30 d,每10 d測定乳液脂質過氧化值(peroxide value,POV)和硫代巴比妥酸與脂質氧化次級產物反應的硫代巴比妥酸反應物(thiobarbituric acid reactive substances,TBARS)值,以POV和TBARS值為指標分析其氧化穩定性。
根據Chaiyasit等[25]的方法,對樣品POV進行測定。將0.2 ml乳液與1.5 mL異丙醇與異辛烷的混合溶液充分混合后,離心。再向0.2 mL上清液中加入2.8 mL甲醇和正丁醇混合溶液、15 μL 3.94 mol/L的NH4SCN溶液和15 μL Fe2+溶液,避光反應20 min后,測定波長510 nm處吸光度。通過過氧化氫異丙苯標準曲線計算樣品POV。
根據Mei Longyuan等[26]方法,對樣品TBARS值進行測定。混合2 mL乳液樣品溶液與2 mL 三氯乙酸-硫代巴比妥酸-HCl和2,6-二叔丁基對甲酚的混合溶液,沸水浴反應15 min后,冷卻至室溫。4 000 r/min離心10 min后,測定波長532 nm處上清液吸光度。利用丙二醛標準曲線計算樣品TBARS值。
1.4 數據處理
所有實驗平行重復3 次,以SPSS 20.0軟件對數據進行ANOVA差異顯著性分析,P<0.05,差異顯著。使用Origin V8.1、PeakFit V4.12等軟件進行數據處理和圖表繪制。
2 結果與分析
2.1 多酚結合率
利用福林-酚法[16]測定了黑豆蛋白與綠原酸的結合率,結果如圖1所示。隨著綠原酸含量的增加,黑豆蛋白與其結合率逐漸升高,當綠原酸含量為150 μmol/g時,多酚結合率最大,分別為(57.95±1.10)%(非共價復合物)和(87.54±2.04)%(共價復合物)。之后,繼續提高綠原酸含量,復合物的多酚結合率不再升高,反而降低,這一現象主要與多酚結合率的計算方法有關。根據計算公式可知,多酚結合率等于復合物中結合的綠原酸與加入綠原酸總量的百分比。因此,當與蛋白質結合的綠原酸趨于飽和的時候,綠原酸與蛋白質的結合會放緩,此時繼續添加綠原酸,就會使多酚結合率的數值降低。另外,由圖1結果還可以發現,共價交聯能夠獲得更高的多酚結合率。這主要是因為在堿性條件下(pH 9.0),綠原酸中的羥基易氧化成為醌,進而與氨基酸殘基反應形成穩定的C—N和C—S共價鍵,最終形成穩定的共價復合物[10]。而在中性條件下(pH 7.0),綠原酸中的酚羥基和苯環會與蛋白質之間以疏水作用、氫鍵或范德華力等作用力結合,形成非共價復合物。但是非共價交聯屬于可逆作用力,其穩定性較共價作用弱,所以通常蛋白-多酚非共價復合物的多酚結合率低于其共價復合物[17]。
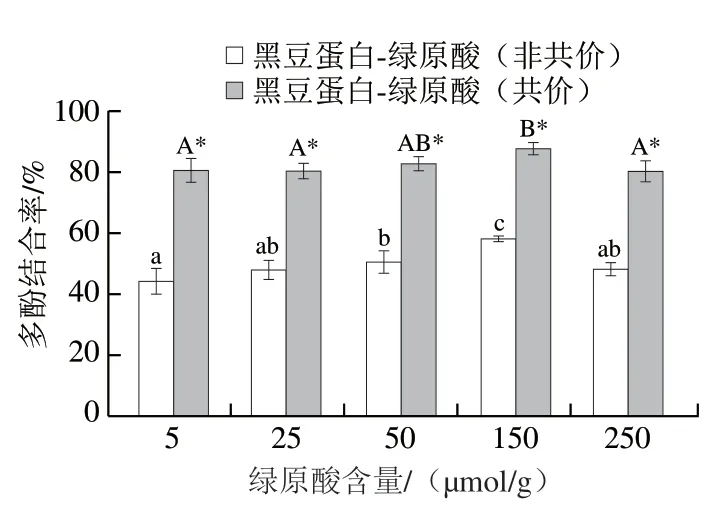
圖1 黑豆蛋白-綠原酸非共價和共價復合物的多酚結合率Fig. 1 Polyphenol-binding capacity of BSPI-CA non-covalent and covalent conjugates
2.2 熒光光譜分析
由圖2可知,添加綠原酸后,蛋白質的熒光峰強度降低,且綠原酸濃度越高,峰強降低越顯著。這一現象的發生主要是因為氨基酸殘基與多酚作用后,多酚量子產率低,導致蛋白質發生熒光猝滅[27]。同時,加入綠原酸后,蛋白質的熒光峰位還發生了紅移。這主要歸因于綠原酸交聯導致蛋白質結構伸展,發生解折疊,所以包埋在蛋白質內部的疏水氨基酸殘基暴露至極性環境中,蛋白質三級結構改變。本結果與Jiang Jiang等[11]研究結果一致。另外,對比圖2a、b可知,共價作用所導致的峰強降低和紅移現象較非共價作用更加明顯。分析原因可能是共價結合中醌與氨基酸殘基間的作用更強、更穩定,因此結合了更多的疏水氨基酸,實現了更高的多酚結合率,因而導致熒光光譜中更明顯的變化。
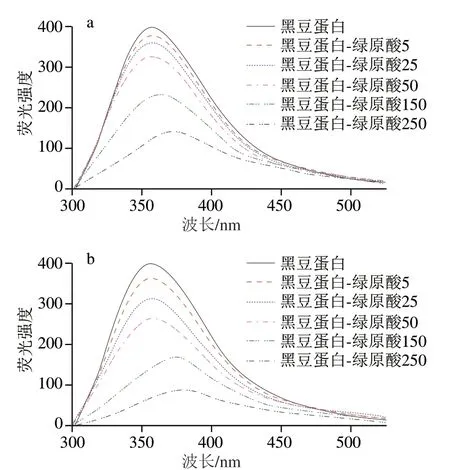
圖2 黑豆蛋白-綠原酸非共價和共價復合物的熒光光譜Fig. 2 Fluorescence spectra of BSPI-CA non-covalent and covalent conjugates
2.3 圓二色譜圖分析
由圖3可知,在波長190~260 nm范圍內,蛋白質圓二色性發生改變,表明綠原酸復合會導致蛋白質構象轉變。對于黑豆蛋白-綠原酸非共價復合物,隨綠原酸含量增加,α-螺旋相對含量逐漸降低,無規卷曲相對含量逐漸升高(表1)。在蛋白質二級結構中,α-螺旋結構是肽鏈通過氫鍵穩定的緊密螺旋結構,由于全部肽鍵均可成氫鍵,α-螺旋結構非常穩定[28]。而α-螺旋相對含量的降低則表明蛋白質中有序結構遭到破壞,同時無規卷曲相對含量的增加,進一步說明蛋白質分子趨于松散和無序。Jia Jingjing等[29]研究表明綠原酸能夠降低β-乳球蛋白中的α-螺旋含量。Shen Fei等[30]也發現茶多酚的非共價作用會引起卵白蛋白中α-螺旋的減少和β-折疊的增加,從而形成結構更加松散的蛋白質。此外,共價交聯后黑豆蛋白結構變化的趨勢與非共價基本一致,只是α-螺旋相對含量降低程度更加明顯。這可能是因為蛋白質與綠原酸之間的共價作用較為穩定,多酚結合率更高,因此對蛋白質結構的影響更為顯著。這一結果與Sui Xiaonan等[13]研究結果相似,該研究發現在大豆蛋白-花青素復合物的制備中,共價復合物的有序結構降低明顯高于非共價復合物。
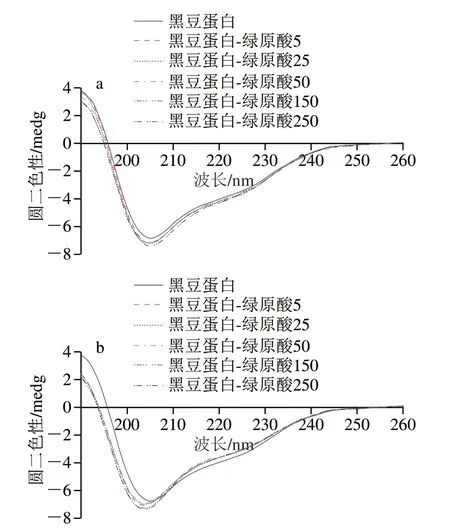
圖3 黑豆蛋白-綠原酸非共價和共價復合物的圓二色譜圖Fig. 3 CD spectra of BSPI-CA non-covalent and covalent conjugates
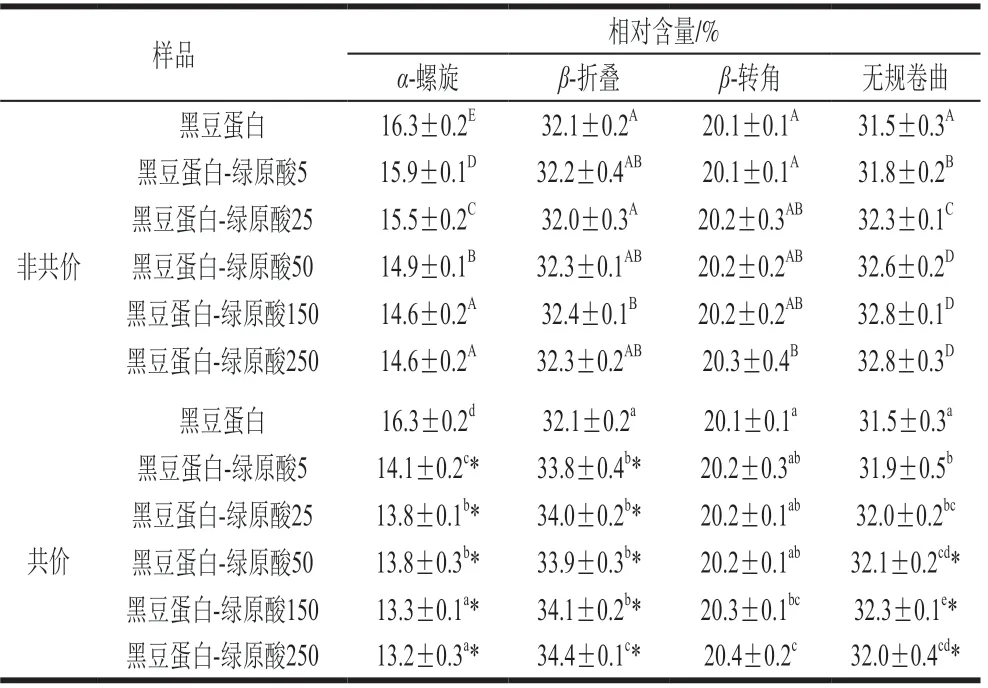
表1 黑豆蛋白-綠原酸非共價和共價復合物的二級結構相對含量Table 1 Secondary structures of BSPI-CA non-covalent and covalent conjugates
2.4 乳化性分析
由表2可知,與綠原酸交聯后,所得復合物的乳化性有顯著提高,乳化活性和乳化穩定性分別升高至80.37 m2/g和27.07 min(非共價作用),以及89.82 m2/g和33.83 min(共價作用)。這主要是因為綠原酸能夠顯著改變蛋白質結構,使蛋白質結構趨于松散和無序,進而達到更好的親水-疏水平衡,形成穩定的界面乳化劑層,使黑豆蛋白-綠原酸復合物較天然黑豆蛋白表現出更優秀的乳化性能[31-32]。Jia Zhenbao等[33]也在表沒食子兒茶素沒食子酸酯修飾乳清蛋白的研究中發現,多酚的交聯能夠改變蛋白質的二級、三級結構,并增強蛋白的乳化性能。此外,黑豆蛋白-綠原酸共價復合物乳化性要高于非共價復合物,這與共價作用更強的穩定性有關。從圓二色和熒光結果看(表1和圖2),共價作用對蛋白質的結構影響更大,且復合物具有更高的多酚結合率(圖1),因此共價復合物乳化能力的提升也更加明顯。
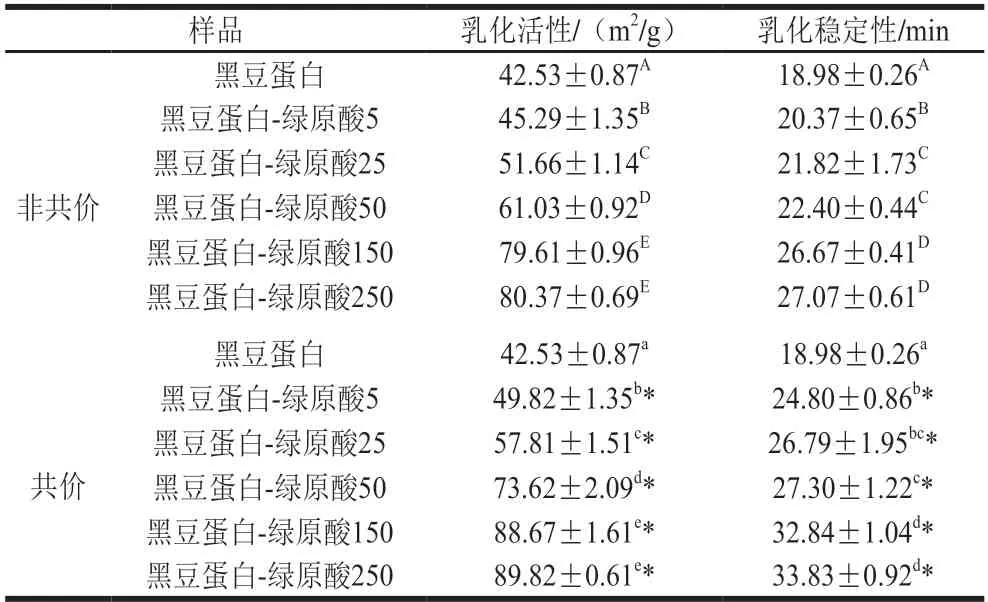
表2 黑豆蛋白-綠原酸非共價和共價復合物的乳化性Table 2 Emulsifying properties of BSPI-CA non-covalent and covalent conjugates
2.5 黑豆蛋白-綠原酸復合物的抗氧化性測定
由圖4可知,在添加綠原酸后,所得蛋白復合物的抗氧化性隨綠原酸含量增大而逐步提升(P<0.05)。有研究表明酚類物質能夠作為H+和電子供體,終止自由基鏈反應,因此酚類物質能夠有效增加蛋白質的抗氧化能力[6,9]。此外,相較于非共價復合物,相同綠原酸含量下,共價復合物具有更高的多酚結合率,引入更多的酚羥基,因此有利于共價復合物發揮出更強的抗氧化作用。
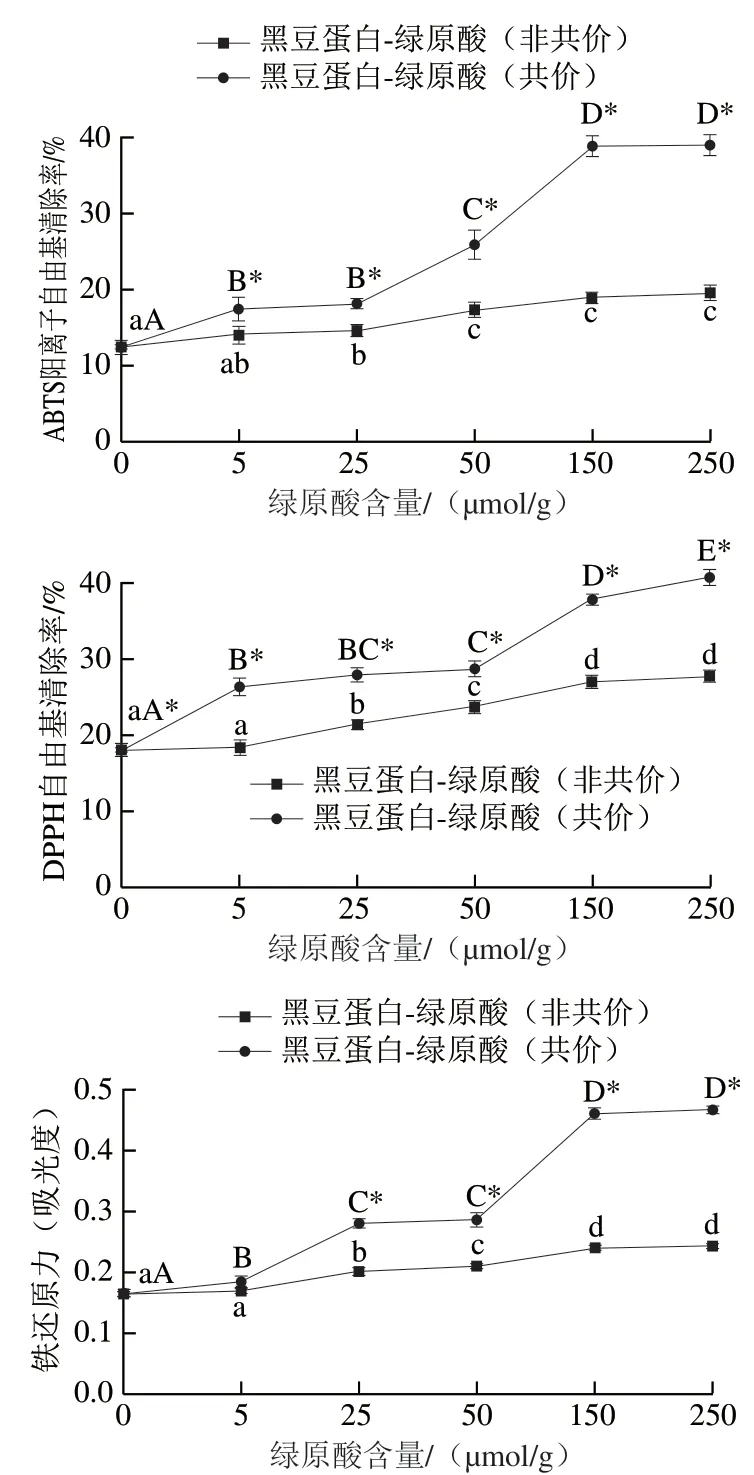
圖4 黑豆蛋白-綠原酸非共價和共價復合物的抗氧化性Fig. 4 Antioxidant activity of BSPI-CA non-covalent and covalent conjugates
2.6 綠原酸對黑豆蛋白乳液性質的影響
2.6.1 乳液基本性質的測定
根據復合物乳化性測定的結果,綠原酸含量為150 μmol/g和250 μmol/g時,所得復合物的乳化性雖有升高,但已無顯著差別。因此,選擇150 μmol/g為綠原酸的最佳添加量,制備黑豆蛋白-綠原酸非共價和共價復合物,且將其作為乳化劑穩定納米乳液,進一步考察綠原酸交聯對乳液穩定性和抗氧化性的影響。由表3可知,黑豆蛋白-綠原酸非共價和共價復合物穩定的納米乳液具有更小的乳滴粒徑和更均勻的粒徑分布(多分散性指數<0.2)。這說明綠原酸能夠提高黑豆蛋白的兩親能力,增強蛋白質在油水界面的吸附[34]。這一結論也與界面蛋白含量的測定結果一致,隨界面蛋白含量的增加,乳液平均粒徑逐漸降低。Sabouri等[35]在研究兒茶素與酪蛋白的相互作用時也發現酚羥基可與蛋白質中的羧基作用,改善蛋白質的兩親性質,從而降低蛋白質界面張力,促進蛋白質在油水界面上的吸附。另一方面,綠原酸還能夠有效增加乳滴的表面電荷,使乳液Zeta電位的絕對值顯著升高(P<0.05)。這有利于乳滴之間保持比較強的靜電排斥,獲得較小的平均粒徑。其中,穩定的共價作用,可獲得更高的多酚結合率,使黑豆蛋白-綠原酸共價復合物具有更多的負電荷,形成平均粒徑最小的納米乳液。Sui Xiaonan等[13]也發現花青素能夠有效降低大豆蛋白乳液的粒徑,增加乳液的Zeta電位絕對值,并且共價作用的影響更為顯著,有利于高穩定性乳液的制備。

表3 黑豆蛋白-綠原酸復合物乳液的平均粒徑、Zeta電位和 界面蛋白含量Table 3 Mean particle sizes, zeta-potentials and AP contents of BSPI-CA conjugate-stabilized nanoemulsions
2.6.2 乳液的貯存穩定性
如圖5所示,天然黑豆蛋白乳液穩定性較差,在第10天時,粒徑已經顯著升高(P<0.05),說明乳液已經發生了絮凝和聚結。而黑豆蛋白-綠原酸非共價復合物穩定的乳液次之,在第10天乳液粒徑雖然也增加,但升高程度較天然黑豆蛋白低。黑豆蛋白-綠原酸共價復合物乳液的穩定性最好,在第20天才出現乳液粒徑增加。這是因為綠原酸能夠降低乳液的平均粒徑,而較小粒徑的乳滴在布朗運動中更能保持穩定,對抗重力導致的沉降[3]。另外,更高的Zeta電位使乳液具有更強的靜電排斥,有效防止了乳滴之間的聚集,進一步保持了乳液的穩定[34]。所以,綜合粒徑和Zeta電位兩方面的原因,自身粒徑最小、Zeta電位最高的黑豆蛋白-綠原酸共價復合物納米乳表現出了最佳的貯存穩定性。
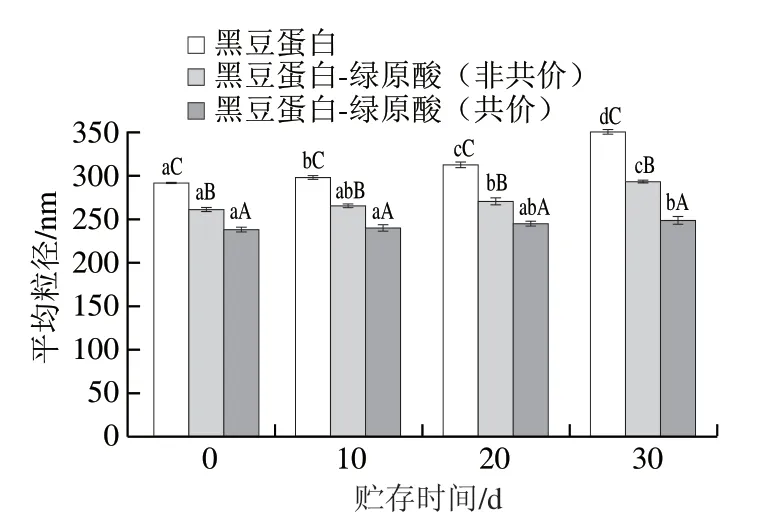
圖5 黑豆蛋白-綠原酸復合物乳液在貯存期間的平均粒徑Fig. 5 Mean particle sizes of BSPI-CA conjugate-stabilized nanoemulsions during storage
2.6.3 乳液的氧化穩定性
如圖6所示,黑豆蛋白納米乳的POV和TBARS值增長最快,油脂氧化迅速,乳液氧化穩定性較差。而黑豆蛋白-綠原酸非共價復合物納乳液的POV和TBARS值整體較天然蛋白低,說明其具有一定抗氧化能力,但氧化穩定性也不理想。相比,黑豆蛋白-綠原酸共價復合物乳液的氧化穩定性改善最為明顯。Jacobsen等[4]研究表明乳液的氧化穩定性與乳化劑的抗氧化性有關。這是因為油脂氧化易于發生在油水界面處,綠原酸交聯提高了蛋白乳化劑的抗氧化性,乳化劑層有效阻擋了氧化劑與油脂的作用,抑制了油脂氧化[36]。同時,與可逆的非共價作用相比,穩定的共價作用使黑豆蛋白-綠原酸共價復合物具有更高的抗氧化性,更強的油水界面吸附能力,有利于形成更加致密的乳化劑膜,使乳液氧化穩定性的提升更加顯著。Fan Yuting等[2]也發現多酚交聯可以明顯降低乳清蛋白乳液的POV和TBARS值的增長速度,提高乳液的氧化穩定性。

圖6 黑豆蛋白-綠原酸復合物乳液在貯存期間的POV(a)和 TBARS值(b)Fig. 6 POVs (a) and TBARS values (b) of BSPI-CA conjugatestabilized nanoemulsions during storage
3 結 論
由于多酚能夠在堿性條件下氧化成醌,與蛋白質之間形成穩定的共價作用,相較于可逆的非共價作用,黑豆蛋白-綠原酸共價復合物的多酚結合率明顯高于非共價復合物。并且共價作用對黑豆蛋白的結構影響也更為顯著,蛋白質結構更為無序和松散。
綠原酸有效改善了蛋白質的親疏水平衡,使蛋白質的乳化性能提升,同時為蛋白質引入了大量的酚羥基,增強了蛋白質的抗氧化性。
較高的多酚結合率和更穩定的結合都使得黑豆蛋白-綠原酸共價復合物的乳化性和抗氧化性更為優越。所以,黑豆蛋白-綠原酸共價復合物所制備的納米乳平均粒徑最小,Zeta電位絕對值最大,界面蛋白含量最高,說明其在油水界面的吸附能力最強,具有較強的空間位阻排斥和靜電排斥,進而使乳液表現出較高的貯存穩定性和氧化穩定性。因此,綠原酸交聯是改善乳液載體穩定性和抗氧化性的可行途徑。

