手動負壓抽吸聯合血管化淋巴結移植治療繼發性下肢淋巴水腫的療效分析
魏苗苗 吳祥奎 吳必華 張天華 李海 肖順娥 魏在榮 鄧呈亮
下肢淋巴水腫是由于各種因素導致的下肢淋巴管輸送功能障礙或淋巴液回流受阻所引發的組織間隙淋巴液淤滯。病理表現為淋巴管、淋巴瓣膜結構損害,和淋巴管擴張,常導致肢體腫脹、變形、功能障礙、反復感染和慢性潰瘍,嚴重者可誘發皮膚惡性腫瘤,嚴重影響患者的生活質量,是迫切需要治療的疾病[1]。下肢淋巴水腫多繼發于婦科或盆腔惡性腫瘤根治術后,其中婦科惡性腫瘤根治術后繼發下肢性淋巴水腫的發生率可高達69%[2]。
淋巴水腫的治療一直是世界性難題,也是研究的熱點。負壓抽吸減容術通過微小的切口去除皮下增生的脂肪組織以達到縮小容積的目的,是一種治療淋巴水腫較為微創、有效的方法[3];血管化淋巴結移植(Vascularized lymph nodes transfer,VLNT)是將帶有自身血液供應的淋巴結移植至病變區域以重建淋巴回流通路,是治療淋巴水腫的生理性手術之一。相對于淋巴管-靜脈吻合術(Lymphatic-venous anastomosis,LVA)只適用于早期淋巴水腫,VLNT 適用于任何病變時期的淋巴水腫,還具有手術難度較低、手術時間短及遠期效果確切的優勢,已越來越受到關注[4-5]。當前,聯合手術治療是淋巴水腫治療的發展趨勢[6]。我科自2018 年11 月至2021 年11 月一期應用手動負壓抽吸聯合VLNT 治療單側下肢繼發性淋巴水腫,效果滿意,現報告如下。
1 資料和方法
1.1 臨床資料
選取2018 年11 月至2021 年11 月在遵義醫科大學附屬醫院整形燒傷外科住院治療的下肢淋巴水腫患者12 例,均為女性,年齡49~75 歲,平均(57±8)歲;Ⅱ期患者5 例,Ⅲ期患者7 例。入選標準:①年齡18~80 歲,根據國際淋巴學學會(ISL)分期診斷為Ⅰ~Ⅲ期的下肢繼發性淋巴水腫;②自愿簽署知情同意書。排除標準:①婦科惡性腫瘤復發或轉移者;②患有嚴重的重要器官病變,不能耐受手術者;③丹毒感染急性期者;④合并上下肢靜脈回流障礙性疾病者。
1.2 手術方法
術前分別測量患肢及健肢大腿上1/3 處、大腿下1/3 處、小腿上1/3 處、小腿下1/3 處各徑線周徑,計算患肢及健肢各徑線周徑差。本組12 例均采用一期患肢大腿手動負壓抽吸減容術,同時切取右鎖骨上血管化淋巴結,一期轉移至患肢小腿,與患肢小腿血管行顯微血管吻合。共切取右鎖骨上血管化淋巴結皮瓣7 例,淋巴結瓣5 例。術后定期隨訪,記錄治療前后患肢周徑變化,并填寫生活質量調查表。
手術時,患者全麻,取平臥位,肩背部適當墊高,頭向左側偏斜45 °,右上肢內收,充分暴露右側鎖骨上區,手術分兩組同時進行,一組于患肢大腿行手動負壓抽吸減容;一組切取右側鎖骨上淋巴結皮瓣或淋巴結瓣。
手動負壓抽吸減容術:分別于患肢大腿上段外側、下段內側皮膚切口,長約0.5~0.8 cm,注入適量腫脹液(每1 000 mL 生理鹽水加入利多卡因0.4 g、腎上腺素1 mg),15 min 后從切口置入20 mL 螺紋注射器連接的抽脂針,在0.75 個大氣壓下進行抽吸,抽吸方向與下肢縱軸平行,抽吸層次為深層脂肪組織,抽吸的終點為捏起皮膚厚度約2~3 cm。
血管化淋巴結移植術:于右鎖骨上方1.5 cm 設計平行于鎖骨的橢圓形皮瓣,皮瓣范圍為7 cm×2 cm~8 cm×3 cm,筋膜瓣大小約9 cm×4 cm;也可做平行于鎖骨的7~10 cm 長的皮膚橫行切口。于切口注射適當腫脹液(500 mL 生理鹽水+腎上腺素1 mg),沿術前設計切開皮膚、皮下組織,顯露頸闊肌,將頸闊肌與下方的頸外靜脈包含在皮瓣內,沿著胸鎖乳突肌外側緣分離,顯露肩胛舌骨肌,牽開胸鎖乳突肌,顯露頸內靜脈,向內下牽開肩胛舌骨肌,沿著頸內靜脈外緣分離,可見靜脈旁的淋巴結,尋找頸橫動脈及伴行靜脈,于前斜角肌表面掀起整個淋巴結瓣,妥善保護位于斜角肌表面的膈神經。于患肢小腿尋找受區供吻合的血管,可供選擇的血管包括踝部附近的脛后血管、脛前血管和腘窩旁的腓腸內側血管。脛前動脈或脛后動脈一般與淋巴結瓣的頸橫動脈做端側吻合,腓腸內側動脈與頸橫動脈做端端吻合,尋找2根靜脈分別與頸橫靜脈和頸外靜脈吻合。
術后處理:患肢大腿彈力繃帶適當加壓包扎,小腿淋巴結移植處留置皮片引流,常規給予活血、預防感染等治療,觀察皮瓣血運,若移植的是淋巴結瓣則觀察傷口愈合情況,術后1 周穿彈力襪下床活動并出院。囑患者出院后穿彈力襪至少3 個月。
1.3 統計學方法
2 結果
2.1 治療前后患肢周徑的變化
本組12 例患者治療后,患肢大腿上下段、小腿上下段與健肢各徑線差值分別為(2.14±3.14)cm、(3.80±3.06)cm、(1.94±2.74)和(0.67±1.37)cm,均較治療前的(5.89±4.14)cm、(7.06±4.92)cm、(4.13±3.25)cm 和(2.83±1.56)cm 明顯減小(P<0.05)。
2.2 治療后患者生活質量的變化
患者術后生活質量調查結果顯示:聯合治療后12 例患者均無蜂窩織炎、丹毒等感染發作。患肢松軟程度、疼痛感、墜脹感及其他不適癥狀均明顯好轉,患者整體生活質量明顯提高,術后滿意度高。
3 典型病例
患者1,女性,53 歲,5 年前在我院行卵巢癌根治術并行術后化療,2 年前出現左下肢淋巴水腫,腫脹持續存在,無法自行消退,期間蜂窩織炎及丹毒發作3 次,伴患肢疼痛、沉重感明顯,于當地醫院止痛、抗感染、補液等對癥支持治療。患者既往有高血壓史,規律服用降壓藥物,血壓控制良好。2020 年5 月收入我科,根據國際淋巴學學會(ISL)分期診斷為右下肢淋巴水腫Ⅲ期。術前復查未見腫瘤復發及轉移征象。收治入院后,擇期行左下肢脂肪抽吸術聯合右鎖骨上血管化淋巴結皮瓣移植術。術后隨訪13 個月,患肢皮膚明顯軟化,沉重感明顯減輕,生活質量明顯提高,術后未發生皮膚感染(圖1、2)。

圖1 典型病例1Fig.1 Typical case 1
患者2,女性,54 歲,4 年前因宮頸癌接受子宮切除及盆腔淋巴結清掃術,術后規律放療及化療,術后不久即出現右下肢腫脹,且腫脹進行性加重,近一年右下肢蜂窩織炎發作2 次,保守治療無效。2021年6 月就診,淋巴核素顯像提示右下肢淋巴回流障礙,根據ISL 分期診斷為右下肢淋巴水腫Ⅲ期,排除手術禁忌后行右下肢脂肪抽吸術聯合右鎖骨上血管化淋巴結皮瓣移植術,手術過程順利,術后1 周出院。隨訪期間患者無蜂窩織炎、丹毒等皮膚感染發作,下肢沉重感明顯緩解(圖3、4)。
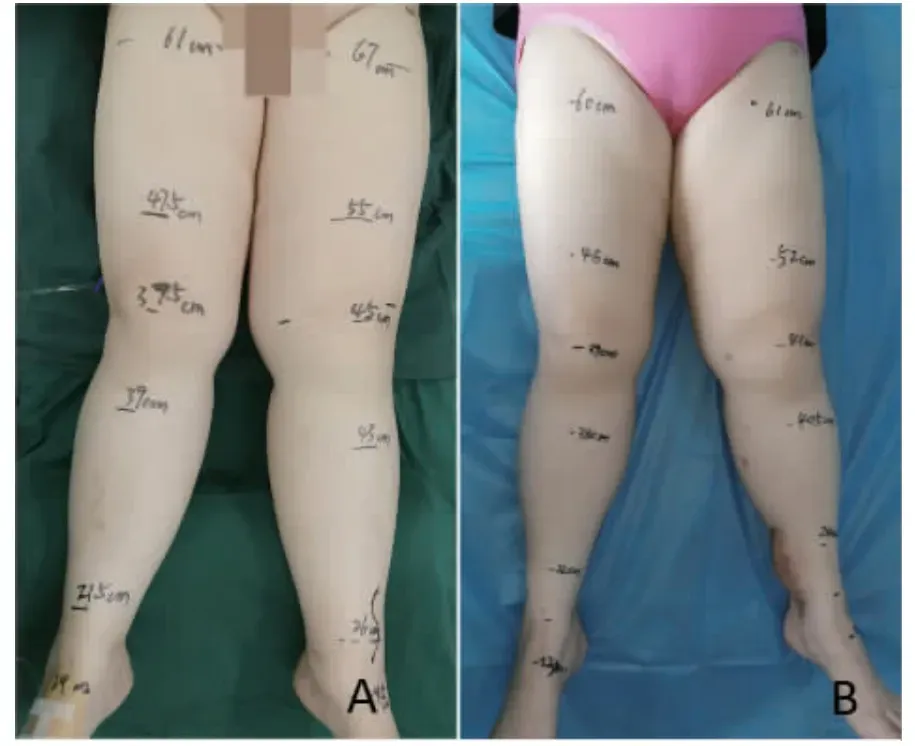
圖2 典型病例1:術前和術后患肢周徑變化Fig.2 Typical case 1:Preoperative and postoperative difference in circumference of lymphedema extremities

圖3 典型病例2Fig.3 Typical case 2

圖4 典型病例2:術前和術后患肢周徑變化Fig.4 Typical case 2:Preoperative and postoperative difference in circumference of lymphedema extremities
4 討論
下肢淋巴水腫的治療大體可分為非手術治療和手術治療。非手術治療包括綜合消腫療法(Complex decongestive therapy,CDT)、氣囊壓迫療法、烘綁療法及光生物調節治療(Photo-biomodulation therapy,PBMT)等[7],其中包含手法淋巴引流、低壓彈力加壓、皮膚護理及消腫功能鍛煉的CDT 被認為是非手術治療中最有效的治療方法[8]。一般認為,CDT 無效或不能堅持治療的下肢淋巴水腫患者,首選手術治療。下肢淋巴水腫手術方式包括兩大類:一類為減負荷手術,主要包括皮下病變組織切除減容術(Charles術)、負壓抽吸減容術等;另一類為生理性手術,主要包括LVA 和VLNT[9]。減負荷手術見效快,尤其是Charles 術,可以起到快速減容的目的,然而,Charles術后并發癥較多,包括經久不愈的潰瘍、增生性瘢痕、外觀丑陋等,目前僅應用于象皮腫期的淋巴水腫患者[10]。負壓抽吸減容可快速去除皮下增生的脂肪組織,微創且療效明顯,但并不能從根本上解決淋巴回流障礙問題[11]。生理性手術可重建淋巴回流通路,從根本上解決淋巴回流障礙,但對已經增生的皮下脂肪及纖維組織并無治療作用[12]。因此,目前淋巴水腫的手術治療趨勢為減負荷手術聯合生理性手術,比如負壓抽吸減容術聯合LVA、負壓抽吸減容術聯合VLNT、負壓抽吸減容術聯合LVA 及VLNT。然而,多數研究推薦分期手術,如一期行VLNT,再根據患者的自身情況在術后1~3 個月進行負壓抽吸減容術[13-14];或一期行患肢抽吸減容術,2~3 個月后再行患肢LVA。然而,分期手術增加手術次數和費用,不被多數患者接受。我們一期應用負壓抽吸減容術聯合VLNT 治療12 例下肢繼發性淋巴水腫患者,結果顯示聯合治療不僅有效減少患肢周徑,改善患者生活質量,且術后未發生丹毒等皮膚感染。目前尚未有與本方法相同的報道。
負壓抽吸減容可快速清除皮下增生的脂肪組織,與傳統的Charles 相比,負壓抽吸減容術切口小、微創、恢復快[15]。但該方法只是單純針對患肢增粗的減容手術,并沒有建立通暢的淋巴回流通路,沒有從根本上解決淋巴水腫的發生。因此,隨著淋巴液的再次淤積,肢體會再次發生腫脹。盡管聯合彈力加壓可一定程度減少復發,但需要終身依賴彈力加壓治療,很多患者不能堅持[16]。生理性手術中,LVA 術后早期療效肯定,而遠期療效存在爭議[17]。LVA 術后早期,淋巴液可順壓力梯度從淋巴管回流入靜脈,淋巴液淤滯逐漸改善,患肢周徑縮小;后期,當淋巴管壓小于靜脈壓時易出現血液逆流,繼而形成吻合口血栓。此外,淋巴管靜脈吻合的數量沒有有效統一,到底吻合多少根淋巴管才能起到治療效果,并不明確[18]。另外,LVA 對顯微設備及手術醫生的顯微操作要求高,學習曲線長,很難推廣。因此,VLNT 治療下肢淋巴水腫成為當前研究的熱點。1982 年,Clodius[19]首次應用腹股溝淋巴結瓣帶蒂轉移治療下肢淋巴水腫,之后顯微外科的發展擴大了淋巴結的供區來源,移植的淋巴結可來源于腹股溝、胸外側、鎖骨上和頦下,甚至是內臟的胃網膜和腸系膜[9]。切取胃網膜和腸系膜淋巴結需要多學科合作,患者接受度不高;腹股溝和胸外側淋巴結切取后可能并發肢體繼發性淋巴水腫,頦下淋巴結瓣切取后供區瘢痕較明顯,且易損傷面神經的下頜緣支。因此,我們選擇鎖骨上作為淋巴結的供區。鎖骨上淋巴結瓣于2013 年由Xiao等[20]率先報道。該處淋巴結數目較多且可靠,供血血管較恒定,管徑較粗,傷口較隱蔽,供區并發癥較少。盡管有文獻報道鎖骨上淋巴結切取后出現1 例右上肢繼發性淋巴水腫,但本組結果顯示供區均未出現明顯的并發癥,這與Sapountzis[14]的研究結果一致。出現右上肢繼發性淋巴水腫可能與手術醫生的切口設計相關[21]。此外,我們并沒有選擇左側鎖骨上作為淋巴結移植的供區,主要考慮左側有胸導管的存在,易發生淋巴漏[22]。
本組的治療經驗提示①淋巴水腫發生于肢體遠端,逐漸蔓延至整個肢體。因此,在淋巴水腫最嚴重的始發部位,也就是患肢小腿,一定要移植淋巴結,淋巴結發揮“泵站”作用,將組織間隙的淋巴液虹吸入淋巴結,經過淋巴結內存在的特殊動力結構,即動脈高壓和靜脈超負壓,將虹吸的淋巴液高壓泵入靜脈,回流入下肢靜脈[23]。②術中為減少對皮膚淋巴系統的損傷,負壓抽吸的方向應與下肢縱軸平行,抽吸層次為深層脂肪組織,不宜抽吸過薄,捏起皮膚厚度約2 cm 即可,且抽脂量不宜過大。③術中切取右鎖骨上血管化淋巴結,應注意對神經的保護,包括鎖骨上神經、膈神經和臂叢神經等,切取淋巴結皮瓣不得不犧牲鎖骨上神經,而淋巴結瓣則可以將鎖骨上神經保留。④鎖骨上淋巴結瓣的供血血管為頸橫動脈,頸橫動脈較恒定,約80%來源于甲狀頸干,存在一定的變異。此外,頸橫靜脈并不總是與頸橫動脈伴行,還存在管徑過細的情況。應盡可能攜帶頸外靜脈,不僅增加可供吻合的回流靜脈,且靜脈旁存在的淺表淋巴組織可增強療效。⑤術中分離右鎖骨上淋巴結,切斷淋巴管時,殘留淋巴管斷端一定要妥善結扎,預防供區淋巴液漏,但淋巴結瓣上的淋巴管斷端,不宜結扎或電凝處理,便于與受區的毛細淋巴管連接再通。⑥單純的血管化淋巴結移植后應使用抗凝、抗痙攣等治療,但聯合負壓抽吸治療,抗凝需謹慎,以防抽脂區域血腫形成,可適當彈力加壓,再靜脈應用抗痙攣等治療,而不予抗凝治療。
本研究存在局限性:①本組僅12 例,樣本量較少,且沒有與單純負壓抽吸、血管化淋巴結移植作對照,隨訪時間也不夠長;②因設備條件限制,本組應用的是手動負壓抽吸,抽脂量不多,最高抽脂量只有1 200 mL;③文獻報道相對于移植1~2 個淋巴結,移植3 個及以上淋巴結的效果更好[24],本研究缺乏對移植的淋巴結瓣中淋巴結數量的可靠計數,今后我們將針對這一方面開展前瞻性研究;④本組患者只統計了肢體的周徑差變化,缺乏體積容量的計算以及影像學數據的支撐;⑤本研究缺乏血管化淋巴結移植治療淋巴水腫的機制探討。

