不同放療劑量對局部晚期肺癌患者近遠期療效、血清腫瘤標志物水平與不良反應發生率的影響
劉剛 甘浪舸
(來賓市人民醫院1,廣西 來賓,546100)
(廣西醫科大學附屬瑯東醫院2,廣西 南寧,530028)
肺癌在臨床較為多見,因疾病早期癥狀多不明顯,導致較多患者就診時病情已經處在中晚期,錯過最佳治療時機。臨床治療時多選擇手術、靶向藥物治療以及放化療等,其中調強放療屬于一類新型腫瘤放療技術,經提升腫瘤靶區的照射劑量能減輕附近正常組織損害,提升患者療效[1]。當前,有關調強放療時的劑量選取臨床仍無統一定論。有研究顯示[2],血清中的腫瘤標志物水平能較好反映出肺癌患者的預后情況。本文分析不同放療劑量對局部晚期肺癌患者近遠期療效、腫瘤標志物水平和副反應的影響,現報告如下:
1.資料和方法
1.1 一般資料 回顧性分析2013.07-2017.07 本院收治的局部晚期肺癌共50 例患者的臨床資料,依據放療劑量差異劃分成A組、B 組各25 例,其中A 組男14 例,女11 例;年齡為18-75歲,均值為(56.25± 5.18)歲;病理分型:腺癌12 例,鱗癌13 例。B 組男15 例,女10 例;年齡為20-74 歲,均值為(56.30± 5.14)歲;病理分型:腺癌11 例,鱗癌14 例。兩組資料比較無顯著差異(P>0.05)。納入標準:(1)均結合病理學以及細胞學檢查明確診斷為肺癌,和《內科學》(第9 版)[3]中有關局部晚期肺癌的診斷標準相符。(2)臨床分期是IIIa 期或者IIIb 期。(3)年齡在18-75 歲。(4)預估生存時間在3 個月以上,同時存在能夠測量的病灶。排除標準:(1)伴其他的惡性腫瘤者。(2)骨髓造血能力不佳者。(3)存在精神病不能開展正常溝通者。(4)存在其他的肺部疾病者。
1.2 方法 所有患者均予以調強放療,指導患者采用仰臥位,使其上舉雙手置于頭頂部位,經真空墊對其開展體位固定,結合其腫瘤部位初步明確中心點位置開展體表標記,于美國GE16層大孔徑CT 機下開展CT 增強掃描,層厚度是5mm,上界是環狀軟骨,下界是腎上腺,掃描獲取圖像經網絡傳輸到放療計劃系統內。主管醫生與物理師一同進行腫瘤區(GTV)、計劃靶區(PTV)、臨床靶區(CTV)與危及器官勾畫,其中GTV 包含CT中明確能觀察到的原發灶和肺門以及縱膈淋巴結(直徑最小>1cm 是陽性);CTV 是于GTV 基礎上往上下、左右以及前后依次向外擴展0.5-0.8cm,上下界結合模擬定位機中原發灶移動范圍確定,通常為上葉病灶往外擴展1.0-1.5cm,下葉病灶往外擴展1.5-2.0cm。對于轉移淋巴結,GTV 和CTV 等同,PTV 為CTV往外擴展0.5-1.0cm,并勾畫出危及器官例如肺部、心臟以及脊髓等。所有計劃均于放療計劃系統內設計,經直線加速器6MV X 線照射,要求95%的等劑量線覆蓋PTV。A 組采取高放療劑量:76-86Gy,單次2.0-2.5Gy,5 次/周,總共開展28-32 次照射。B 組采取低放療劑量:60-66Gy,單次2.0-2.5Gy,5 次/周,總共開展28-32 次照射。兩組患者均采取同步TP 方案化療,第1d 予以135-175mg/m2的紫杉醇注射液靜注,1 次/d,于3h 內完成靜注;第2d 予以300mg/m2的卡鉑注射液靜注,1 次/d,間隔4 周重復1 次,共治療4 個周期。
1.3 觀察指標 近期療效:分別在結束治療后對兩組開展療效評定,完全緩解(CR):腫瘤全部消失,同時時間超過4 周,未觀察到有新發病灶存在。部分緩解(PR):基線病灶的長徑總和減小30%,同時時間超過4 周,未觀察到新發病灶。穩定(SD):基線病灶的長徑總和減小但未達到PR 標準或增加但未達到疾病進展(PD)標準。PD:基線病灶的長徑總和增加超過20%或者產生新病灶[4]。疾病控制率=(PR+CR+SD)例數/總例數×100%。遠期療效:分別在兩組結束治療后開展長達3年隨訪,統計兩組死亡率、復發率情況。腫瘤標志物:分別在放療前后抽取兩組清晨空腹狀態下的靜脈血共5mL,后以2500r/min 速度開展10min 離心處理后分離血清,放到-80° C 冰箱中保存待測,選擇電化學發光法對癌胚抗原(CEA)、細胞角蛋白19 片段抗原(Cyfra21-1)水平開展檢測。副反應:包含骨髓抑制、中粒細胞減少、血小板減少、胃腸道反應以及血紅蛋白減少等。
1.4 統計學處理 采用SPSS23.0 統計軟件分析數據,計數資料用%表示,采取χ2檢驗;計量資料用(± s)表示,采取t檢驗,P<0.05 為差異有統計學意義。
2.結果
2.1 兩組近期療效相比結果 見表1:

表1 兩組近期療效相比結果(%,n=25)
2.2 兩組遠期療效相比結果 見表2:
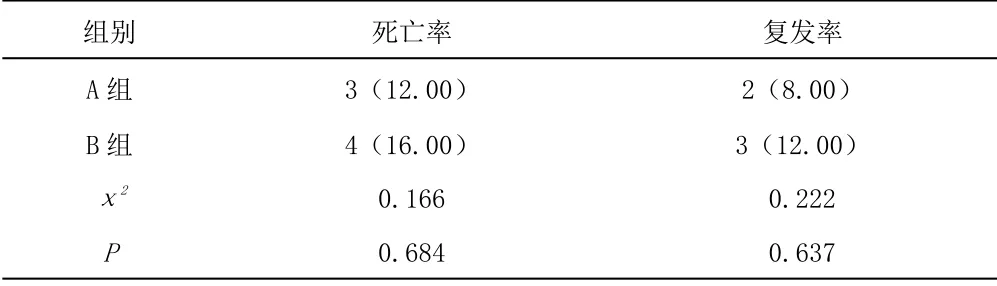
表2 兩組遠期療效相比結果(%,n=25)
2.3 兩組治療前后的腫瘤標志物相比結果 放療前,兩組CEA及Cyfra21-1 水平無顯著差異(P>0.05);放療后,B 組的CEA及Cyfra21-1 水平比A 組更低(P<0.05),見表3:
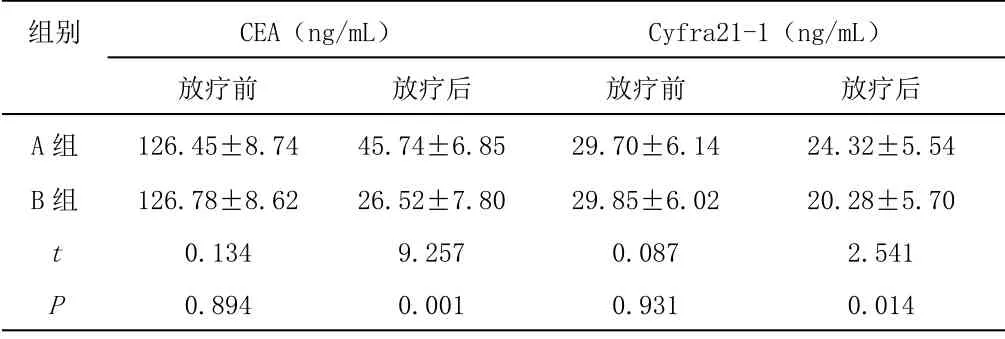
表3 兩組治療前后的腫瘤標志物相比結果(n=25)
2.4 兩組的副反應出現相比結果 B 組的副反應出現比A 組更少(P<0.05),見表4:

表4 兩組的副反應出現相比結果(%,n=25)
3.討論
肺癌屬于臨床一類常見惡性腫瘤,于中老年男性中發病率較高,同時發病年齡呈現日漸年輕化趨勢。放療屬于晚期惡性腫瘤的重要治療方式之一,其通過直線加速器生成射線將腫瘤病灶內部腫瘤細胞殺滅,其中調強放療是以腫瘤病灶為中心開展針對性治療,有著定位準確、選擇性佳等多種優勢,不易對附近的正常組織造成損傷,能適用于放療耐受性不佳的患者。
當前有關晚期肺癌患者的放療劑量選擇不同學者持有不同觀點,易瓊[5]等對局部晚期肺癌共60 例患者開展研究,一組予以高劑量放療設為高劑量組,一組予以低劑量放療設為低劑量組,最終發現,高劑量組的疾病控制率是74.19%和低劑量組65.52%相當,同時經隨訪發現兩組在3年死亡率、復發率及轉移率等指標上也無顯著差異。本次研究發現,A 組疾病控制率是72.00%和B 組64.00%無顯著差異,同時遠期死亡率、復發率以及轉移率和A 組相當,這和易瓊等研究結果一致,說明無論采取高劑量或者低劑量放療均能收獲良好療效,但該結果和郭連洪[6]等研究中結果存在差異,分析原因可能和樣本總數以及放療方式不同有關。本次研究發現,治療后,B 組CEA及Cyfra21-1 水平均低于對照組,說明低劑量放療對改善患者血清腫瘤標志物水平效果更佳,考慮可能和放療劑量反應關系有關。據有關研究顯示[7],日本原子彈爆炸后人體受到輻射量、放療受照射量引發惡性腫瘤之間存在明顯劑量反應關系,在原子彈爆炸后的生還者中,受照者劑量較高人群中出現惡性腫瘤的機率較高,這一劑量反應關系呈現線性相關,因此我們推測高劑量放療有可能會使二次腫瘤發生風險升高,因此,高劑量放療組放療后的CEA 及Cyfra21-1 水平較高,這在當前臨床研究中鮮有報道。此外,在觀察副反應時發現,B 組的副反應出現少于A 組,說明經低劑量放療能減少副反應出現,有著更高的安全性。
綜上所述,予以局部晚期肺癌患者高劑量或者低劑量放療的近遠期療效相當,但低劑量放療能更好改善血清中的腫瘤標志物水平,同時副反應減少,值得采用。

