血栓通注射液與黃芪注射液的配伍穩定性研究
黃運琦 招麗君 楊妹妹 梁詠梅 劉 洋 梁云飛 蘭 星 鄭志遠 呂林艷
血栓通注射液與黃芪注射液的配伍穩定性研究
黃運琦1,2,3招麗君1,2,3楊妹妹1,2,3梁詠梅1,2,3劉 洋1,2,3梁云飛1,2,3蘭 星1,2,3鄭志遠1,2,3呂林艷1,2,3
(1.廣西梧州制藥(集團)股份有限公司,廣西 梧州 543000;2.廣西三七綜合利用技術重點實驗室,廣西 梧州 543000;3.廣西藥物提純工程技術研究中心,廣西 梧州 543000)
目的:考察血栓通注射液與黃芪注射液的配伍穩定性。方法:將血栓通注射液與黃芪注射液依照臨床使用的質量濃度配伍,分別用5%葡萄糖注射液(5%GS)、10%葡萄糖注射液(10%GS)、0.9%氯化鈉注射液(0.9%NS)稀釋,考察室溫下放置0 h、2 h、4 h、6 h、8 h后配伍溶液的性狀、pH值、不溶性微粒、滲透壓摩爾濃度以及三七總皂苷的含量等關鍵指標,綜合評價藥物配伍后穩定性變化。結果:血栓通注射液與黃芪注射液配伍后8 h內性狀、pH值、不溶性微粒、滲透壓摩爾濃度及三七總皂苷的含量均無明顯變化。結論:血栓通注射液與黃芪注射液配伍后8 h內基本穩定。
血栓通注射液;黃芪注射液;葡萄糖注射液;氯化鈉注射液;配伍;穩定性
引言
血栓通注射液是由從中藥三七中提取的有效活性成分三七總皂苷制成的滅菌溶液,臨床用于腦血管疾病包括急性缺血性腦血管疾病、腦血管出血后遺癥、癱瘓及視網膜靜脈阻塞等的治療[1]。而黃芪注射液在臨床上也廣泛應用于循環系統、呼吸系統、泌尿系統及消化系統、免疫系統疾病的治療,且對心血管藥理作用最為顯著。二者在臨床同時使用的情況比較多,有文獻表示與其配伍使用不良反應發生率最高的前3種中藥注射劑分別為注射用血栓通、注射用血塞通、舒血寧注射液[2]。依據2020版《中國藥典》指導原則9001中注射劑穩定性試驗的相關要求及實際用藥情況,本研究通過血栓通注射液與黃芪注射液配伍后pH、不溶性微粒、含量變化等關鍵指標的考察,確定其質量穩定性,為臨床安全合理用藥提供用藥依據。
1 儀器與試藥
1.1 儀器
電子天平(型號:XPE205DR,廠家:METTLER TOLEDO);超凈工作臺(型號:CJ-840,廠家:上海珂淮儀器有限公司);pH計(型號:FE28,廠家:METTLER TOLEDO);滲透壓測定儀(型號:OM819.C,廠家:北京雅森博科科學儀器有限公司);智能微粒檢測儀(型號:GWJ-16,廠家天津市天大天發科技有限公司);澄明度檢測儀(型號:YB-2,廠家:天津市天大天發科技有限公司);Millopore超純水儀[型號:Mill-Q,廠家:默克集團(Merck KGaA)];高效液相色譜儀[型號:U3000,廠家:賽默飛世爾科技(中國)有限公司]。
1.2 試藥
血栓通注射液(廣西梧州制藥(集團)股份有限公司,規格:2 mL,批號200104);5%葡萄糖注射液(規格:250 mL,批號P20042409,廣西裕源藥業有限公司;批號E120091801,貴州科倫藥業有限公司)、10%葡萄糖注射液(規格:250 mL,批號P19122408,廣西裕源藥業有限公司;批號E120101607,貴州科倫藥業有限公司)、0.9%氯化鈉注射液(規格:250 mL,批號P20010306,廣西裕源藥業有限公司;批號E120101812,貴州科倫藥業有限公司)、黃芪注射液(規格10 mL,批號210811D1,神威藥業)。
對照品:三七總皂苷對照品(110870-202105,含R19.6%、Rg135.2%、Re4.7%、Rb129%、Rd3.8%)購自中國食品藥品檢定研究院。
2 方法與結果
2.1 溶液的配制
2.1.1使用0.9%氯化鈉注射液作為溶劑
參考藥品說明書,考察最大使用濃度,開展相關樣品的配制。
配伍溶液A1:取血栓通注射液2支與配伍藥品黃芪注射液4支置于500 mL塑料容量瓶中,用相應的稀釋液定容至刻度,小心翻轉20次,使溶液混合均勻,即得配伍溶液。
對照溶液A1:取配伍藥品黃芪注射液4支,置于500 mL塑料容量瓶中,用相應的稀釋液定容至刻度,小心翻轉20次,使溶液混合均勻,即得對照溶液。
配伍溶液B1:精密量取血栓通注射液10 mL與配伍藥品黃芪注射液25 mL置于50 mL容量瓶中,并用0.9%氯化鈉定容至刻度,小心翻轉20次,使溶液混合均勻,即得配伍溶液。配制完成后于室溫條件下在超凈工作臺中靜置,分別于0 h、2 h、4 h、6 h、8 h精密量取1 mL,作為供試品溶液。
三七總皂苷對照品:精密稱取5.063 mg對照品粉末,加入甲醇稀釋,并定容至20 mL容量瓶,即得對照品溶液,分裝于1 mL進樣小瓶中,置于-20℃環境保存。
2.1.2使用5%葡萄糖注射液作為溶劑
配制方法同0.9%氯化鈉注射液,即得配伍溶液A2、B2,對照溶液A2、三七總皂苷對照品用“2.1.1”項的溶液。
2.1.3使用10%葡萄糖注射液作為溶劑
配制方法同0.9%氯化鈉注射液,即得配伍溶液A3、B3,對照溶液A3、三七總皂苷對照品用“2.1.1”項的溶液。
2.2 血栓通注射液與黃芪注射液配伍后性狀變化
在擬定的時間點內取“2.1”項下配伍藥液,分別在黑色和白色背景下目視,觀察配伍液的顏色,是否有氣體產生,有無渾濁或沉淀。結果見表1,配伍溶液在8 h內始終保持澄清透明,無氣體、沉淀產生,性狀較穩定。
表1 血栓通注射液與黃芪注射液配伍后性狀變化
2.3 血栓通注射液與黃芪注射液配伍后pH變化測定
在擬定的時間點內取“2.1”項下配伍藥液,按照《中國藥典》2020年版四部0631項下pH值測定法測定。結果見表2,變化趨勢見圖1。配伍藥液pH值在8 h內無顯著變化,穩定性良好。
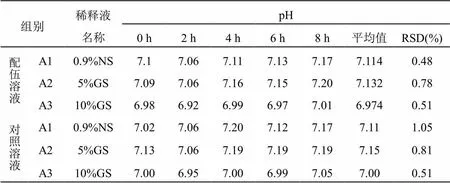
表2 血栓通注射液與黃芪注射液配伍后的pH
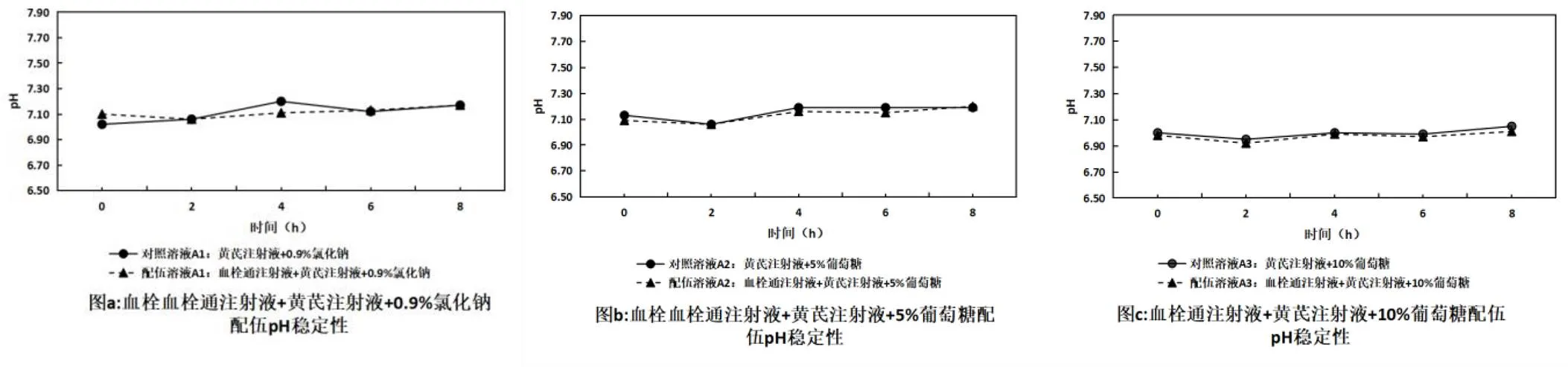
圖1 血栓通注射液與黃芪注射液配伍后pH變化趨勢
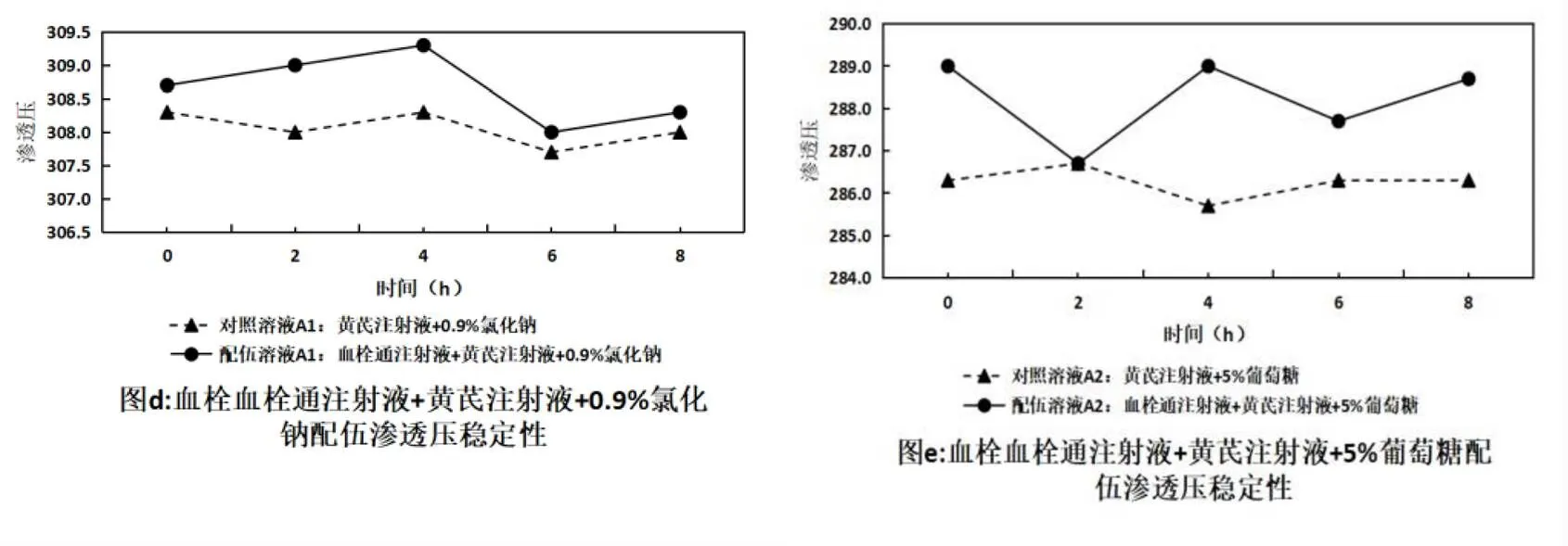
2.4 血栓通注射液與黃芪注射液配伍后滲透壓變化測定
在擬定的時間點內取“2.1”項下配伍藥液,按照《中國藥典》2020年版四部0632項下滲透壓摩爾濃度測定法測定,平行測定3次,取均值,結果見表3,變化趨勢見圖2。滲透壓在8 h內保持穩定,無明顯變化,說明配伍溶液滲透壓較穩定。
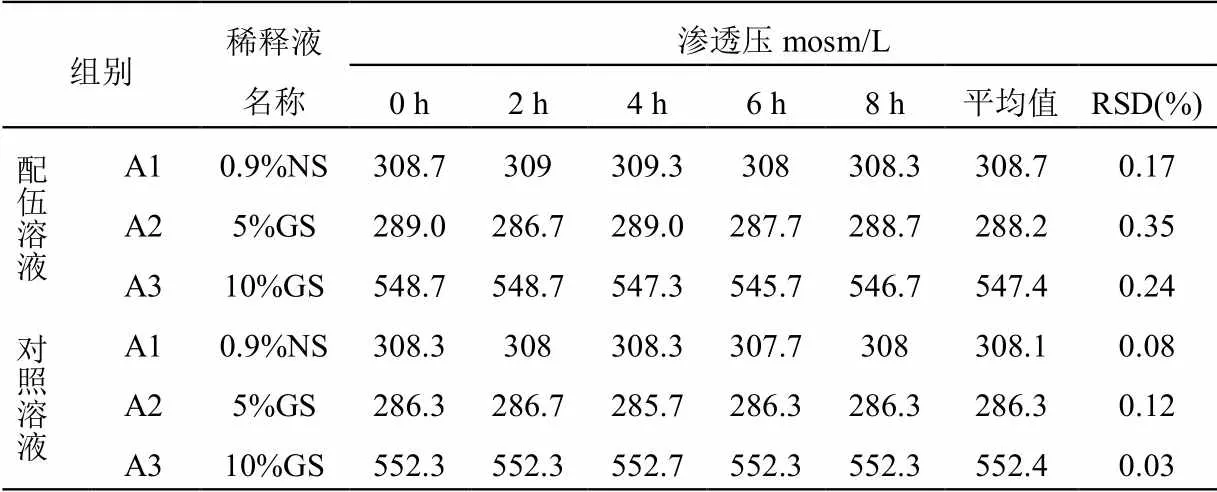
表3 血栓通注射液與黃芪注射液配伍后的滲透壓
2.5 血栓通注射液與黃芪注射液配伍后不溶性微粒變化測定
在擬定的時間點內取“2.1”項下配伍藥液,按照《中國藥典》2020年版四部0903項下不溶性微粒檢查法檢查平行測定4次,去除第一次測定數據,取后3次的均值,結果見表4,變化趨勢見圖3。血栓通注射液與黃芪注射液配伍后8 h內,不溶性微粒呈減少趨勢,且均符合《中國藥典》2020版不溶性微粒顯微計數法規定光阻法測定結果“標示裝量為100 mL或100 mL以上的靜脈用注射液除另有規定外,每1 mL中含10 μm以上的微粒數不得過25粒,含25 μm及25 μm以上的微粒數不得過3粒”。
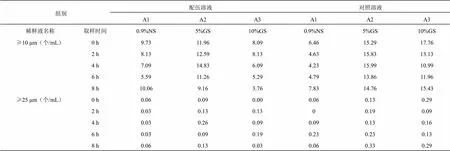
表4 血栓通注射液與黃芪注射液配伍后的不溶性微粒
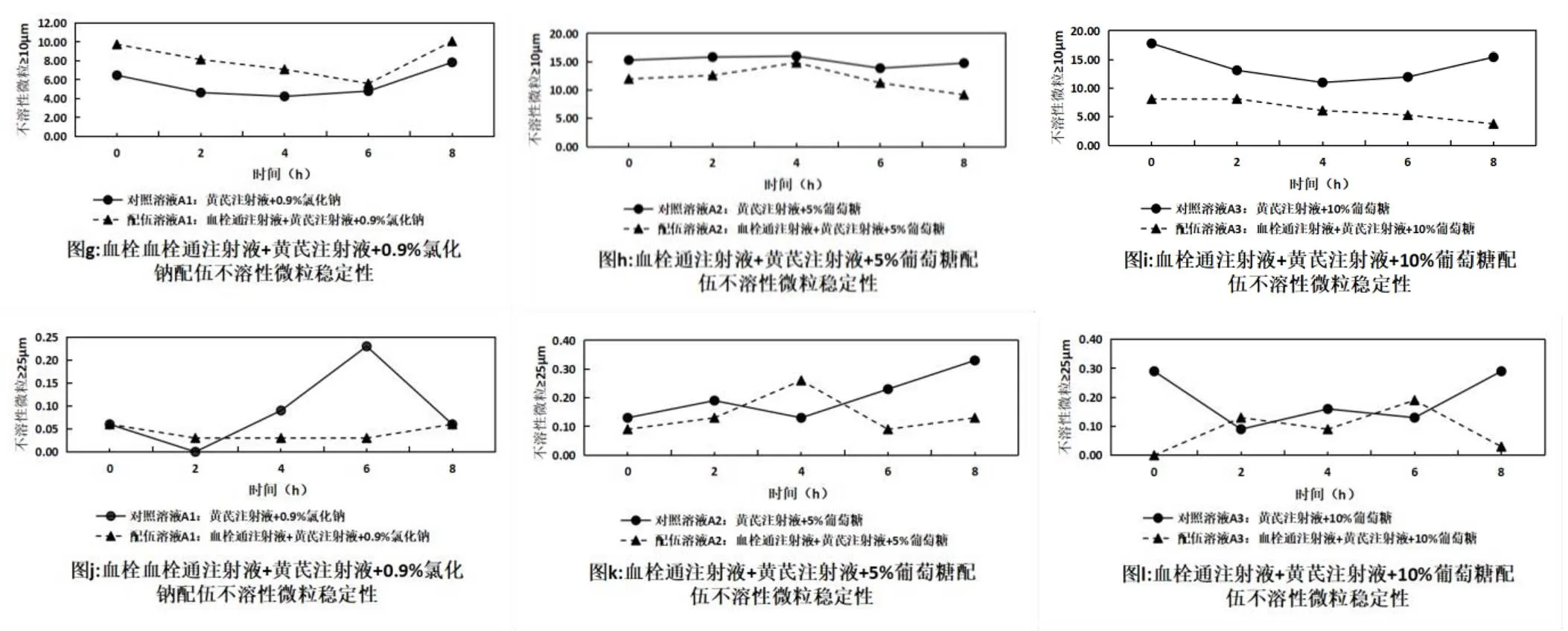
圖3 血栓通注射液與黃芪注射液配伍后不溶性微粒的變化趨勢
2.6 血栓通注射液與黃芪注射液配伍后含量變化測定
2.6.1色譜條件和系統適應性試驗
色譜柱;以乙腈為流動相A,以水為流動相B,按下表進行梯度洗脫;檢測波長為203 nm,流速1 mL/min,波長203 nm,進樣體積10 μL。
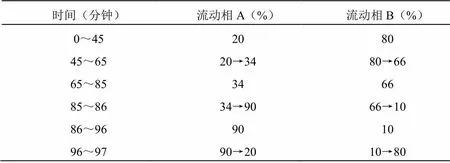
表5 流動相梯度
2.6.2 對照品溶液的制備
精密稱定三七皂苷R1對照品16.60 mg、人參皂苷Rd對照品16.42 mg、人參皂苷Re對照品15.50 mg分別置5 mL容量瓶中,加甲醇至刻度,搖勻;再分別精密量取上述溶液各1 mL及精密稱定人參皂苷Rg1 13.30 mg、人參皂苷Rb1 11.21 mg置10 mL容量瓶中,加甲醇至刻度,搖勻,即得三七皂苷R1濃度為0.3001 mg/mL,人參皂苷Rd濃度為0.3025 mg/mL,人參皂苷Re濃度為0.2911 mg/mL,人參皂苷Rg1濃度為1.2502 mg/mL,人參皂苷Rb1濃度為1.0224 mg/mL的單體混合對照溶液。
2.6.3 供試品溶液的制備
取“2.1”項下的配伍溶液B1、B2、B3,即得。
2.6.4 含量測定結果
按照上述高效液相色譜法檢測注射用血栓通注射液(凍干)與黃芪注射液配伍后8 h內三七總皂苷的含量變化,結果見表6,變化趨勢見圖4。注射用血栓通注射液(凍干)與黃芪注射液配伍,在三種稀釋劑中主成分含量在8 h內皆RSD值≤2%無顯著變化,穩定性良好。
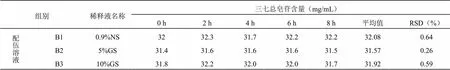
表6 血栓通注射液與黃芪注射液配伍后三七總皂苷的含量
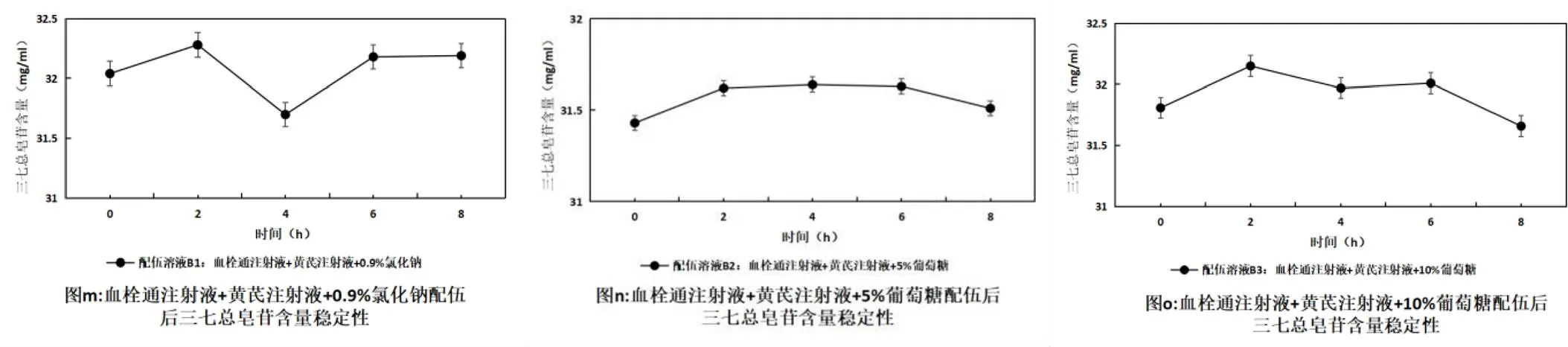
圖4 血栓通注射液與黃芪注射液配伍后三七總皂苷含量的變化趨勢
3 討論與分析
本研究結果表明,血栓通注射液與黃芪注射液配伍后藥液在8小時內的外觀、pH值、滲透壓、不溶性微粒及含量變化均無顯著變化,理化性質穩定性良好。對于減少中藥注射劑的不良反應,筆者有以下幾點建議。(1)靜脈滴注時應謹慎使用10%GS稀釋劑。實驗數據表明10%GS稀釋劑配制的對照和配伍溶液的滲透壓均≥310 mosm/L,屬于高滲溶液[3],靜脈滴注時具有一定風險。(2)建議在中藥注射劑的使用時遵循中醫理論[4]。在藥物的不良反應方面,有學者整理了2009年至2018年十年中監測到的藥物不良反應,發現化學藥物不良反應占80%~90%,而中成藥只占10%~20%[5]。不良反應中中成藥占比低,很大程度上是中醫中“整體統一”理論有效實踐的結果。
我國對于中藥的使用歷史悠久,人用經驗豐富,但成分復雜,且中醫治病遵循“辯證論治”“整體統一”的理論,與之前“組方合理+成分可知+動物試驗”的評審理念相沖突,致使以往的中醫藥行業發展緩慢。針對此困境,我國已經出臺系列政策[6,7],給出以“臨床價值”為導向的藥物創新方向,“中醫藥理論+人用經驗+臨床試驗”三結合的審評理念,至此中醫藥發展進入了快車道。作為我國傳統文化的一部分,中藥一直都有廣泛市場空間和民眾基礎,尤其是在疑難雜病的治療領域。在2020年爆發的新型冠狀病毒肺炎疫情中,血必凈注射液等中藥注射劑,對于危、重患者在改善患者呼吸困難、降低患者體內炎癥因子方面有著明顯的效果,被《新型冠狀病毒感染的肺炎診療方案(試行第七版)》收錄[8]。
4 結論
本實驗根據臨床使用實際情況,以多種關鍵質量屬性作為考察指標,對血栓通注射液與黃芪注射液在8 h內配伍穩定性進行考察,配伍后藥液在8 h內的外觀、pH值、滲透壓、不溶性微粒及含量變化均無顯著變化,表明血栓通注射液與黃芪注射液配后理化性質穩定性良好,建議在臨床上8 h內使用完畢。
[1]于棟偉,顧琴華,盧恒清,等. 中藥注射劑臨床安全使用的管理規范[J]. 醫藥導報,2012,31(7): 962-965.
[2] 易曉霞. 中藥注射劑不良反應分析[J]. 實用中醫藥雜志,2021,37(3): 504-506.
[3] 陸再英,鐘南山. 內科學(第7版)[M]. 北京: 人民衛生出版社,2008.
[4] 王焱. 74例中藥注射劑不良反應報告分析與探討[J]. 中藥新藥與臨床藥理,2020,43(21): 4347.
[5] 王丹,任經天,董鐸,等. 藥品不良反應監測年度報告十年趨勢分析[J]. 中國藥物警戒,2020,17(5): 276-283.
[6] 國務院. 國務院關于改革藥品醫療器械審評審批制度的意見[EB/OL]. http://www.gov.cn/zhengce/content/2015-08/18/ content_10101.htm,2015-8-18.
[7] 國家藥監局. 國家藥監局關于促進中藥傳承創新發展的實施意見[EB/OL]. http://www.gov.cn/zhengce/zhengceku/ 2020-12/26/content_5573463.htm,2021-12-21.
[8] 國家衛生健康委,國家中醫藥管理局. 新型冠狀病毒肺炎診療方案(試行第7版)[J]. 中國醫藥,2020,15(6): 801-805.
Study on Compatibility Stability of Xueshuantong Injection and Astragalus Injection
Objective: To investigate the compatibility stability of Xueshuantong injection and astragalus injection. Methods: Xueshuantong injection and astragalus injection were diluted with 5% glucose injection (5%GS), 10% glucose injection (10%GS) and 0.9% sodium chloride injection (0.9%NS) according to the mass concentration of clinical use. The properties, pH value, insoluble particles, osmotic molar concentration and the content of total saponins of panax notoginseng were investigated after the compatibility solution was placed at room temperature for 0h, 2h, 4h, 6h and 8h, and the stability of the solution was comprehensively evaluated. Results: The properties, pH value, insoluble particles, osmotic molar concentration and total saponins content of panax notoginseng had no significant changes in 8h after the compatibility of Xueshuantong injection and astragalus injection. Conclusion: Xueshuantong injection and astragalus injection are basically stable within 8h after compatibility.
Xueshuantong injection; astragalus injection; glucose injection; sodium chloride injection; compatibility; stability
F
A
1008-1151(2022)12-0049-05
2022-10-08
梧州市科技計劃項目202102011;廣西科技基地和人才專項(桂科AD20297068)。
黃運琦(1995-),男,湖南邵陽人,廣西梧州制藥(集團)股份有限公司助理工程師,研究方向為中藥經典名方開發研究及三七綜合利用研究。
劉洋(1979-),男,廣西藤縣人,廣西梧州制藥(集團)股份有限公司高級工程師,研究方向為藥物研發、藥物分析研究。

