兩種豬偽狂犬gE抗體ELISA檢測試劑盒效果評價
陳瀅鍇 張紅云,2 彭小玉 陳海蘭 王金子 齊豫川
兩種豬偽狂犬gE抗體ELISA檢測試劑盒效果評價
陳瀅鍇1張紅云1,2彭小玉1陳海蘭1王金子2,3齊豫川4
(1.廣西大學,廣西 南寧 530005;2.廣西璞締恩葳生物技術有限公司,廣西 南寧 530007;3.廣西民族大學海洋與生物技術學院,廣西 南寧 530006;4.中國科技開發院廣西分院,廣西 南寧 530022)
目的:為了評估A、B兩種豬偽狂犬gE抗體ELISA檢測試劑盒的檢測效果,為豬偽狂犬gE抗體ELISA檢測試劑盒提供選擇依據。方法:試驗將12份待檢血清樣品進行檢測并計算A、B試劑盒的符合率和陽性率;通過對3份留樣血清樣品進行梯度稀釋、設置平行實驗進行檢測,評估兩種試劑盒的重復性、靈敏度和穩定性。結果:用兩種試劑盒檢測,樣品的陽性率均為33.3%,符合率為100%;通過稀釋留樣血清樣品的檢測和平行試驗發現:用A試劑盒檢測兩份樣品,檢出顯示陽性的最低稀釋度分別為1∶64和1∶16;用B試劑盒檢測2份樣品,檢出顯陽性的最低稀釋度分別為1∶32和1∶8。結論:兩種試劑盒重復性好,均適用于臨床樣品的PRV gE抗體檢測,但A試劑盒靈敏度高于B試劑盒,而B試劑盒穩定性更高且價格更低。說明生產實踐中應對A、B試劑盒的重復性、靈敏度、穩定性和價格因素進行綜合考量,合理選擇性價比更高試劑盒。
豬偽狂犬病;gE抗體;ELISA檢測;靈敏度比較
引言
偽狂犬病(pseudorabies,PR)是由偽狂犬病病毒(pseudorabies virus,PRV)感染豬、牛、羊等多種家畜和野生動物引起的一種高度接觸性傳染病。豬是該病毒的主要天然宿主、貯存者和傳播者[1,2]。豬被感染的典型臨床特征是妊娠階段的母豬出現流產,哺乳仔豬出現高熱、神經癥狀,仔豬流產率高、死亡率高[3],育成階段的豬表現為體表皮膚瘙癢,出現疹塊危及到豬群的健康成長。偽狂犬病在全球養豬業普遍存在[4],我國自1947年首次報道該病以來,已有20多個省(自治區、市)流行過該病,并在許多豬場呈暴發性流行[5],偽狂犬病是現代養豬業要面對的主要病原之一,對生豬養殖業造成的經濟損失十分嚴重[6]。近年來,更有報道認為PRV可引起人眼內炎和腦炎[7-9]。這些發現表明PRV感染是一個潛在的公共衛生風險,不僅限于養豬業。因此,研究豬偽狂犬gE抗體ELISA檢測試劑盒的效果對豬偽狂犬病的檢測與凈化刻不容緩。陳偉杰、董雅琴等研究者曾對市場上的一些PR gE抗體檢測試劑盒進行了比較分析,給出了一定的建議。其中,陳偉杰等[10]側重于對不同試劑盒之間檢測結果的一致性進行評價,董雅琴等[11]側重于比較分析各試劑盒敏感性、特異性以及試驗結果的重復性與準確性。楊濤[1]、陸江[12]等均對進口試劑盒進行比較研究。段群棚[13]、宋詩川[5]等均采用進口試劑盒進行檢測。目前沒有研究對市場上廣泛使用的外國和國產品牌的檢測靈敏度、穩定性、符合率及價格等方面進行系統地比較分析,忽略了國產試劑盒的重要性。本研究從試劑盒的檢測靈敏度、穩定性、符合率及價格等方面進行比較分析,為養豬生產實踐中選擇更合理PRV gE抗體ELISA檢測試劑盒提供依據。
1 材料
1.1 血清樣品
南寧市某規模養殖場送檢的12份臨床背景清楚的待檢血清樣品和實驗室留樣保存的3份血清樣品。
1.2 試劑
A廠家生產的PRV gE 抗體試劑盒(批號為AT 069,阻斷ELISA),簡稱A試劑盒;B廠家生產的PRV gE 抗體試劑盒(批號為EP 0621017,阻斷ELISA),簡稱B試劑盒。
1.3 主要儀器
恒溫培養箱(型號為DHP-9162),購自上海齊欣科學儀器有限公司;酶標儀(型號為F50),購自帝肯(上海)貿易有限公司。
2 方法
2.1 試驗設計
2.1.1待檢血清樣品的檢測
將12份待檢血清按順序編號,按照試劑盒說明書要求分別用A、B兩種試劑盒進行檢測,計算其符合率(指A、B試劑盒檢測同一樣品同時定性為陽性或陰性數量之和除以檢測總數)和陽性率。
2.1.2留樣血清樣品的檢測
3份留樣血清樣品經梯度稀釋后用A、B試劑盒檢測,共設置平行實驗3次,對兩種試劑盒的重復性和靈敏度進行評估;對3份樣品不同稀釋度的3個結果(OD值)計算變異系數(CV=平均值/標準差),再計算每個樣品的平均變異系數,以衡量兩種試劑盒的穩定性。
2.2 結果判定
計算公式:S/N值=樣品OD值/陰性對照OD值
A試劑盒判定標準:S/N值≤0.6為陽性,S/N值>0.7為陰性,S/N值在0.6~0.7判為可疑。
B試劑盒判定標準:S/N值≤0.6為陽性,S/N值>0.6為陰性。
3 結果與分析
3.1 待檢血清樣品的檢測結果
用A、B試劑盒對12份待檢血清樣品的gE抗體進行檢測,結果顯示樣品3、樣品6、樣品7、樣品8四份樣品均為陽性,其余樣品均為陰性,陽性率均為33.3%(見表1);12份樣品中同時為陽性的樣品有4份,同時為陰性的樣品有8份,無可疑項,故兩種試劑盒的符合率為100%(見表2)。
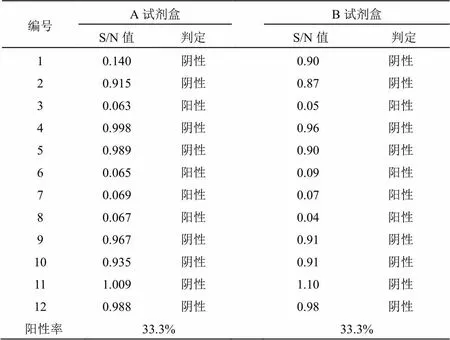
表1 A、B試劑盒對待檢血清樣品的檢測結果
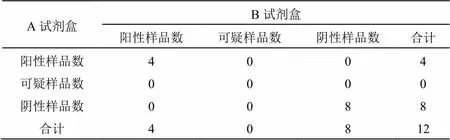
表2 A、B試劑盒對待檢血清樣品的檢測結果的符合率
3.2 留樣血清樣品的檢測結果
用A、B試劑盒檢測三份留樣血清樣品,結果均顯示樣品1、樣品3為陽性,樣品2為陰性(見表3至表4)。用A試劑盒檢測樣品1和樣品3,檢出顯示陽性的最低稀釋度分別為1∶64和1∶16;用B試劑盒檢測樣品1和樣品3,檢出顯陽性的最低稀釋度分別為1∶32和1∶8;(見圖1和圖3)故判斷A試劑盒檢測靈敏度更高,A、B試劑盒均能有效檢出樣品2為陰性(見圖2)。A、B試劑盒各稀釋度的平均變異系數都小于10%,說明其重復性良好,B試劑盒各稀釋度平均變異系數均小于A試劑盒,說明其重復性最好,穩定性最高(見圖4)。
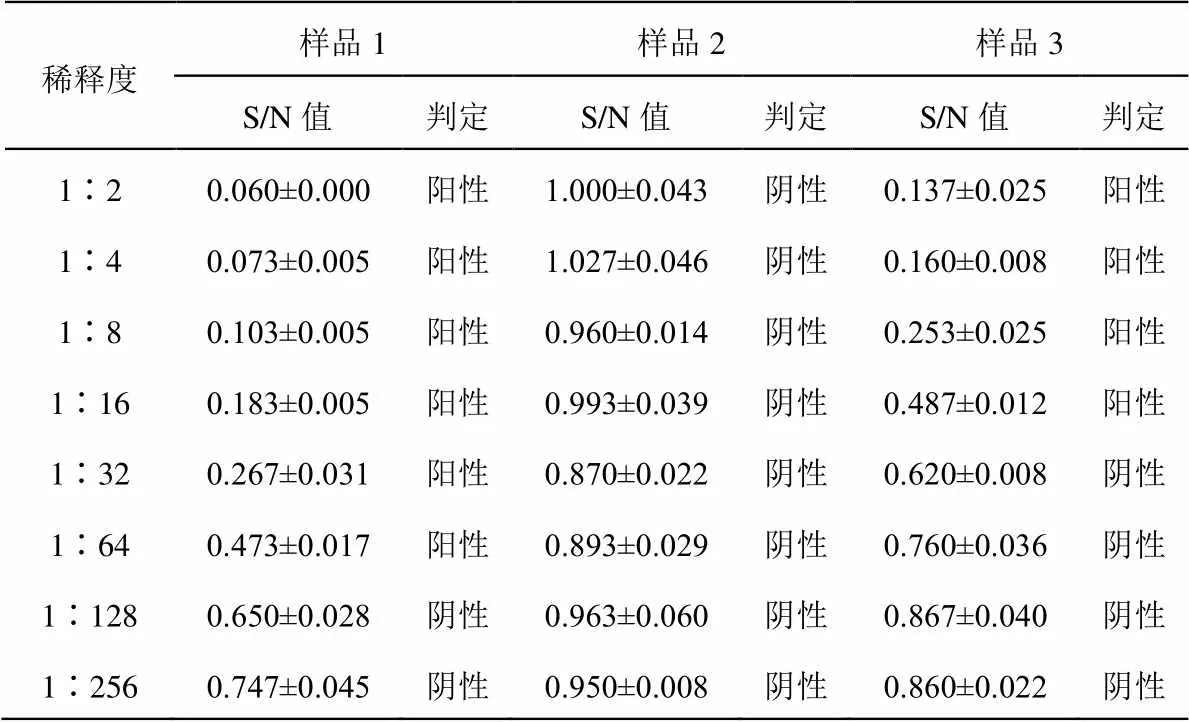
表3 A試劑盒對留樣血清樣品的檢測結果(n=3)
注:S/N值取X±S,其中X為三次平行試驗S/N值的平均值;S為三次平行試驗S/N值的標準偏差。
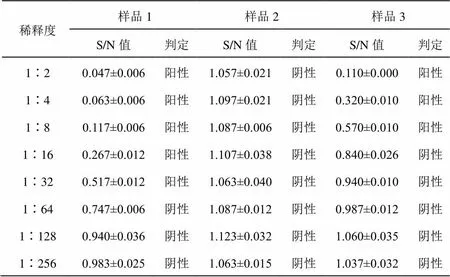
表4 B試劑盒檢測結果(n=3)
注:S/N值取X±S,其中X為三次平行試驗S/N值的平均值;S為三次平行試驗S/N值的標準偏差。
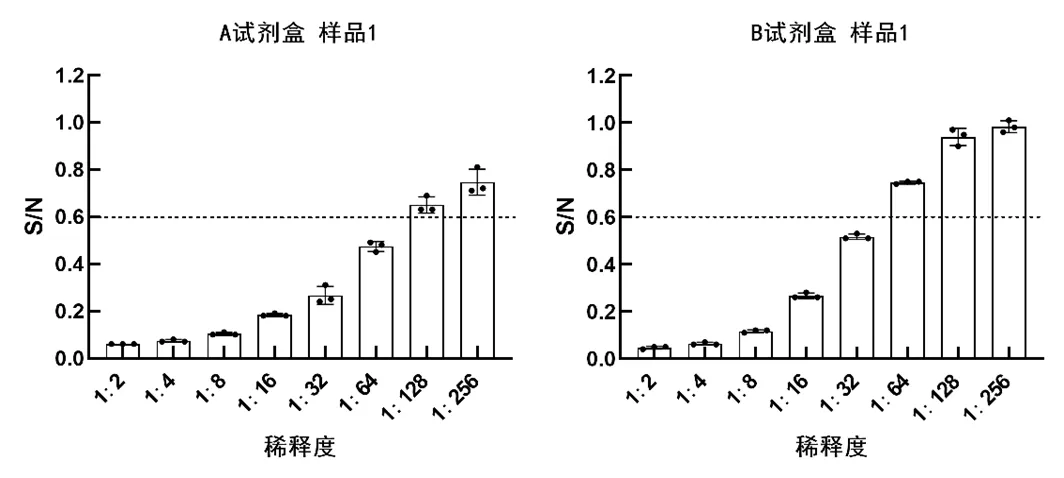
圖1 樣品1檢測結果
注:S/N值低于0.6判定為陽性,下同。
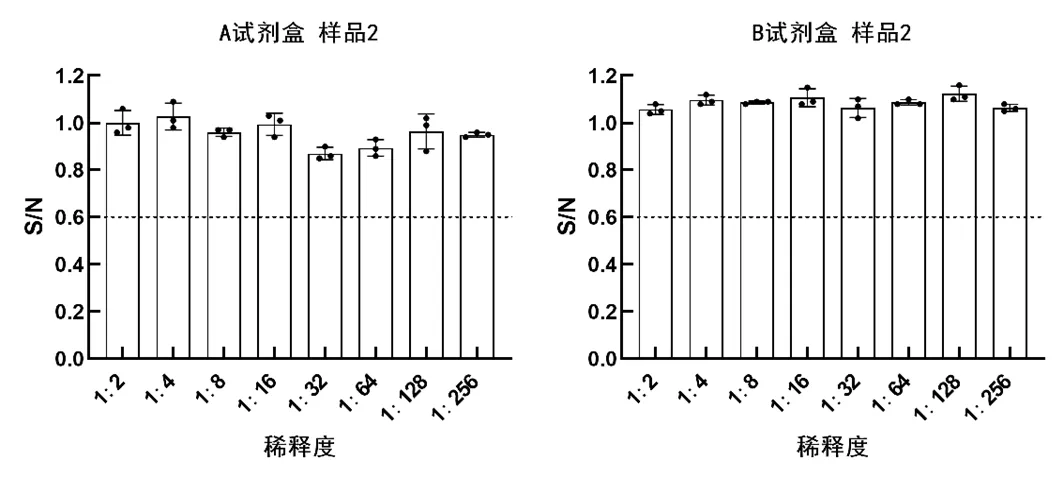
圖2 樣品2檢測結果
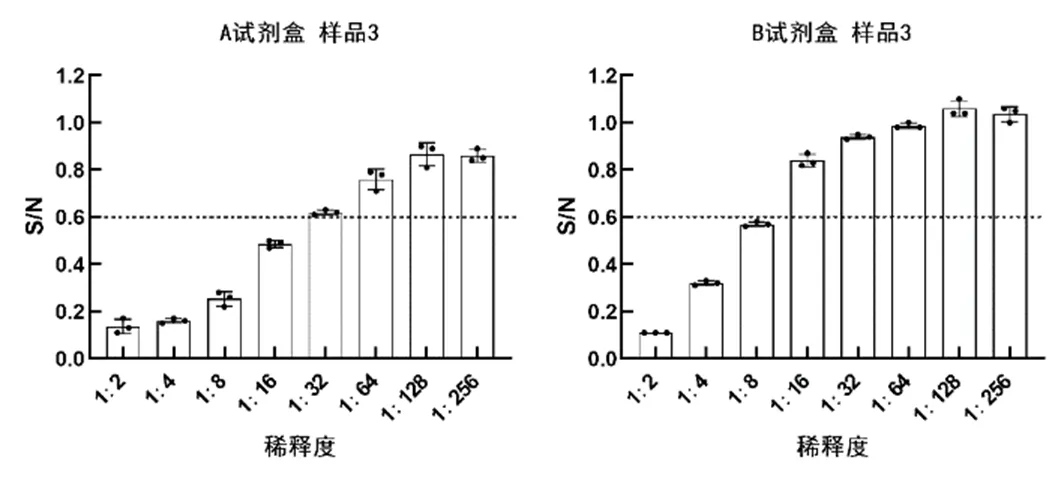
圖3 樣品3檢測結果
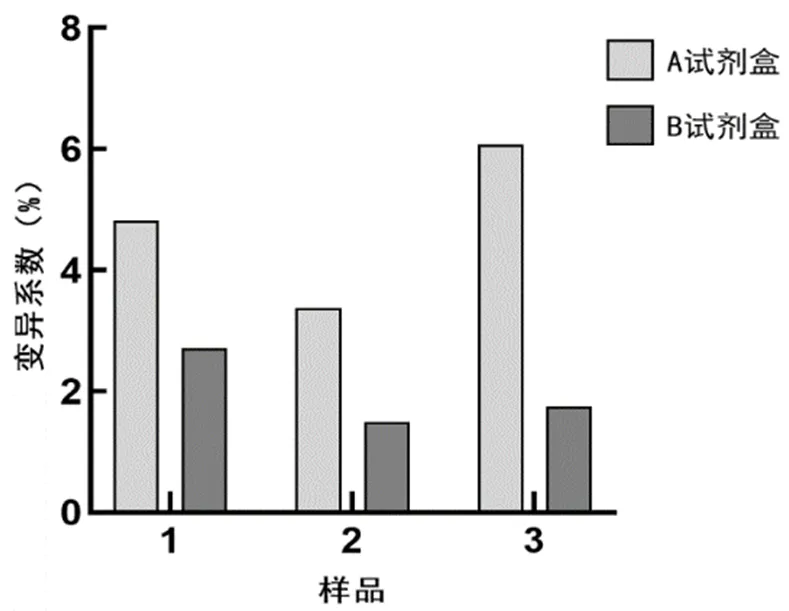
圖4 留樣血清檢測結果的變異系數比較
4 討論
目前,國內基本上是通過PRV gE基因缺失疫苗配合gE-ELISA檢測試劑盒來剔除野毒感染豬,并加強豬場生物安全措施、引種監測、嚴防新毒株的傳入,開展豬偽狂犬病的控制與凈化工作[14]。gE基因是PRV的非必需基因,PRV缺失gE基因后,病毒毒力降低,但不會影響病毒的復制擴增和免疫原性[15],因此gE基因是PRV一個良好的標記基因,目前市面上廣泛使用的PRV疫苗,就是利用這個原理,缺失了gE基因降低了PRV的病毒毒力,但保留了原毒株的免疫原性[16,17],因此在疫苗免疫后檢測不到gE抗體;而PRV所有野毒株有gE基因,在被PRV野毒感染的豬體內能檢測到gE蛋白,這為利用分子生物學和血清學方法進行PRV 野毒感染和gE基因缺失疫苗鑒別診斷提供了條件[18]。國內大多豬場只使用gE基因缺失的偽狂犬疫苗,故利用gE抗體檢測來區分養殖場是否被PRV野毒感染。
當前PR的傳播給國內養豬業造成了巨大的經濟損失,而對PR野毒的及時檢出,是豬場制定有效治療和防控措施的關鍵。由于PRV gE基因缺失疫苗被廣泛應用,通過對豬血清中PRV gE抗體的檢測,可判斷豬場是否存在野毒感染。此方法也是目前豬場進行PR診斷和凈化重要且有效的手段。目前檢測gE蛋白特異性抗體的方法主要有病毒中和試驗(VNT)、酶聯免疫吸附試驗(ELISA)、乳膠凝集試驗(LAT)。其中,VNT因不適宜于大面積的臨床診斷與篩查而難以在實際生產中[19,20];LAT具有較高的可靠性,但其較復雜的操作方法也限制了它的廣泛應用[21]。生豬養殖場普遍采用的是基于阻斷ELISA原理的gE蛋白特異性抗體檢測試劑盒,具有操作簡單、通量高等優勢,備受臨床從業人員的青睞[22]。但各廠家的試劑盒在質量和價格上存在較大差異,因此,如何選擇準確的診斷試劑盒是目前普遍存在的問題。
本試驗通過對12份待檢血清樣品和3份留樣血清樣品的全面檢測,發現兩種試劑盒對待檢血清樣品的檢出率均為33.3%,符合率為100%,均適用于臨床樣品的PRV gE抗體檢測。但是通過稀釋留樣血清樣品的檢測和平行試驗發現,A試劑盒的靈敏度高于B試劑盒,但B試劑盒穩定性更高且價格更低。此外,本試驗A試劑盒符合率與楊濤等[1]結果相似,與其他廠家生產的試劑盒相比有較高的符合率,gE抗體陽性率33.3%與段群棚等[13]的檢測結果相符;比宋詩川檢測結果偏高,可能是本試驗樣品數量較少或與豬場間PRV防控水平差異相關,也可能是與gE抗體陽性率呈上升趨勢有關[5]。陸江等[12]直接將A試劑盒的檢測數據作為標準,評價其他廠家的試劑盒,表現出A試劑盒具有良好的檢測效果。B試劑盒檢測結果與董雅琴等的數據有所差別,可能是不同批次間重復性較差[11]。
5 結論
綜上所述,A、B試劑盒檢測結果高度一致,均可應用于臨床檢測。而A試劑盒是經過我國農業部注冊的PRV進口診斷產品,靈敏度更高,同時其操作方法也列入了農業部的行業標準,質量經過了嚴格的檢驗,在國內和國際上都被高度認可;B試劑盒為常用國產診斷產品,在試劑盒成本上更具優勢,且穩定性更佳,若要對PRV野毒抗體進行持續監測,就需試劑盒具備較好的穩定性,以保證監測數據的可靠性,這時應選擇B試劑盒。若用于PR凈化則建議使用靈敏度較高的A試劑盒,但A試劑盒成本更高,臨床檢測需綜合考量。
[1]楊濤,李謂娟. Kappa檢驗比較2種豬偽狂犬病gE抗體ELISA檢測試劑盒[J]. 福建畜牧獸醫,2015,37(6): 11-13.
[2]陳偉杰,周彩琴,黃怡君,等. 檢測豬偽狂犬病抗體的3種ELISA試劑盒的比較分析[J]. 豬業科學,2008(8): 96-97.
[3]WU Q, ZHANG H, DONG H, et al. Seroprevalence and risk factors associated with Pseudorabies virus infection in Tibetan pigs in Tibet[J]. BMC Veterinary Research, 2018, 172: 14.
[4]劉濤,王瑞,曲哲會,等. 2014—2016年豫南地區規模化豬場豬主要病毒性傳染病流行病學調查分析[J]. 黑龍江畜牧獸醫,2018(20): 106-108.
[5]宋詩川. 廣西地區豬偽狂犬病血清流行病學調查[J]. 今日畜牧獸醫,2020,36(6): 2,9.
[6]MA Z, HAN Z, LIU Z, et al. Epidemiological investigation of porcine pseudorabies virus and its coinfection rate in Shandong province in China from 2015 to 2018[J]. Journal of Veterinary Science, 2020, 21(3): E36.
[7]AI J W, WENG S S, CHENG Q, et al. Human endophthalmitis caused by pseudorabies virus infection, China, 2017[J]. Emerging Infectious Diseases, 2018, 24(6): 1087-1090.
[8]YANG X, GUAN H, LI C, et al. Characteristics of human encephalitis caused by pseudorabies virus: A case series study[J]. International Journal of Infectious Diseases, 2019, 87: 92-99.
[9]WONG G, LU J, ZHANG W, et al. Pseudorabies virus: A neglected zoonotic pathogen in humans[J]. Emerging Microbes and Infections, 2019, 8(1): 150-154.
[10] 陳偉杰,趙靈燕,周彩琴,等. 3種ELISA試劑盒檢測豬偽狂犬病gE抗體的比較[J]. 畜牧與獸醫,2009,41(11): 57-59.
[11] 董雅琴,劉爽,鄭輝,等. 三種偽狂犬病病毒gE抗體ELISA檢測試劑盒的比較[J]. 中國動物檢疫,2017,34(11): 79-81,88.
[12] 陸江,葉志樹,米樹運,等. 試劑盒的檢測結果比較三種豬偽狂犬病毒gE抗體診斷[J]. 四川畜牧獸醫,2017, 44(4): 32-33.
[13] 段群棚,秦毅斌,盧冰霞,等. 2013—2016年廣西部分規模豬場豬偽狂犬病gE抗體檢測分析[J]. 中國動物傳染病學報,2018,26(05): 77-81.
[14] 向敏,夏瑜,王定發,等. 豬偽狂犬病最新研究進展[J]. 湖北農業科學,2020,59(23): 20-23,31.
[15] 肖亞朋,龍進學,黨占國,等. 兩種豬偽狂犬病gB抗體檢測ELISA試劑盒的應用比較[J]. 養豬,2015(4): 3-4.
[16] EGAWA K, SHIMOJIMAL M, TANIGUCHI S, et al. Virulence, pathology, and pathogenesis of Pteropine orthoreovirus (PRV) in BALB/c mice: Development of an animal infection model for PRV[J]. PLoS Neglected Tropical Diseases, 2017, 11(12): e0006076.
[17] PEDERSEN K I, BEVINS S N, BAROCJ J A, et al. Pseudorabies in feral swine in the United States, 2009-2012[J]. Journal of Wildlife Diseases, 2013, 49(3): 709-713.
[18] 馬力,楊麗梅,徐倩倩,等. 豬偽狂犬病病毒gE蛋白在野毒診斷中的應用進展[J]. 中國畜牧獸醫,2014, 41(2): 249-253.
[19] EN F X, WEI X, JIAN L, et al. Loop-mediated isothermal amplification establishment for detection of pseudorabies virus[J]. Journal of Virological Methods, 2008, 151(1): 35-39.
[20] ZHANG C F, CUI S J, ZHU C. Loop-mediated isothermal amplification for rapid detection and differentiation of wild-type pseudorabies and gene-deleted virus vaccines[J]. Journal of Virological Methods, 2010, 169(1): 239-243.
[21] PENSAERT M, LABARQUE G, FAVOREEl H, et al. Aujeszky's disease vaccination and differentiation of vaccinated from infected pigs[C]. International Conference on Control of Infectious Animal Diseases by Vaccination, 2004.
[22] WANG Y B, LI Y H, LI Q M, et al. Development of a blocking immunoperoxidase monolayer assay for differentiation between pseudorabies virus-infected and vaccinated animalss[J]. Polish Journal of Veterinary Sciences, 2019, 22(4): 717-723.
Effect Evaluation of Two ELISA Kits for Detecting gE Antibody in Swine Pseudorabies
Objective: To evaluate the detection effect of ELISA kit for gE antibody of swine pseudorabies A and B, and to provide a basis for selection of ELISA kit for gE antibody of swine pseudorabies. Methods: 12 serum samples were tested and the coincidence rate and positive rate of kit A and B were calculated; the repeatability, sensitivity and stability of the two kits were evaluated by gradient dilution of 3 retention serum samples and parallel test. Results: The positive rate of samples was 33.3% and the coincidence rate was 100% when tested with two kinds of kits; through the detection of diluted serum samples and parallel test, it was found that the lowest dilution of positive results were 1∶64 and 1∶16 respectively when two samples were detected with kit A; two samples were tested with kit B, and the minimum dilution of positive reaction was 1∶32 and 1∶8, respectively. Conclusion: The two kits have good repeatability and are suitable for the detection of PRV gE antibody in clinical samples. However, the sensitivity of kit A is higher than that of kit B, while kit B has higher stability and lower price. It indicates that the repeatability, sensitivity, stability and price factors of A and B reagent kits should be comprehensively considered in production practice, and a more cost-effective kit should be reasonably selected.
swine pseudorabies; gE antibody; ELISA test; sensitivity comparison
S828
A
1008-1151(2022)12-0039-04
2022-09-23
南寧市優秀青年科技創新創業人才培育項目(RC20190102)。
陳瀅鍇(1998-),男,四川宜賓人,廣西大學在讀碩士研究生,研究方向為動物疾病快速檢測。
王金子(1982-),男,黑龍江齊齊哈爾人,廣西民族大學海洋與生物技術學院副教授,博士,碩士生導師,研究方向為微生物資源利用;齊豫川(1991-),男,河南鄭州人,中國科技開發院廣西分院工程師,碩士,研究方向為分子生物學。

