PCOS患者AMH水平與性激素及胰島素抵抗的相關性研究
周 楊,王曉琳,賀永艷,曹 楊,呂淑蘭
(1.西北工業大學醫院婦科,陜西 西安 710072;2.西安交通大學第一附屬醫院婦產科,陜西 西安 710061)
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是育齡期女性最常見的生殖內分泌代謝紊亂性疾病,以高雄激素血癥(hyperandrogenism,HA)或高雄激素臨床表現、稀發排卵或無排卵、卵巢多囊樣改變(polycystic ovarian morphology,PCOM)為特征,并常常與肥胖、胰島素抵抗(insulin resistance,IR)、代謝紊亂和心血管疾病等相關[1];應用鹿特丹診斷標準,其發生率約為6%~21%[2]。目前研究認為HA和IR在PCOS的病理生理發展過程中起重要作用[3]。抗苗勒管激素(anti-Müllerian hormone,AMH)是轉化生長因子β(transforming growth factor-β,TGFβ)超家族中的二聚體糖蛋白。在女性中,AMH由卵巢顆粒細胞分泌,主要表達于2~6mm的竇卵泡(60%)[4]。近年來學者們對AMH與PCOS的關系進行了關注,已有多項研究顯示血清AMH水平在PCOS患者中升高2~4倍,并與疾病的嚴重程度相關[5-7]。目前尚不清楚PCOS中高水平AMH是高雄激素、IR、促性腺激素及其復雜交互作用的結果,還是多囊卵巢卵泡的固有特性。本研究旨在探討PCOS患者中不同AMH水平與性激素及IR之間的相關性,以期為臨床上對PCOS的診治提供參考。
1研究對象與方法
1.1研究對象
收集2019年1月至12月在西安交通大學第一附屬醫院婦科內分泌門診及西北工業大學醫院婦科門診確診的PCOS患者109例,所有研究對象均知情同意。納入標準:①年齡為19~40歲。②符合2003年鹿特丹診斷標準(修訂版)[8]:a.月經稀發或閉經;b.高雄激素臨床表現,多毛(改良Ferriman-Gallwey評分≥4分)、痤瘡和(或)高雄激素血癥(HA)(根據西安交通大學第一附屬醫院參考值設定,睪酮(testosterone,T)>1.67nmol/L為HA);c.超聲檢查顯示PCOM,超聲顯象單側或雙側卵巢體積>10mL,和(或)直徑2~9mm的卵泡≥12個;d.前面3項中符合2項,并排除其他可能引起高雄激素、排卵異常的疾病,即可診斷為PCOS。排除標準:①近3個月內應用激素類藥物或近1個月內服用可能會影響檢測結果的藥物者;②合并甲狀腺功能亢進癥、甲狀腺功能減退癥、高泌乳素血癥等疾病者。
1.2研究方法
1.2.1基本信息的收集
收集患者的年齡、體重、身高、體質量指數(body mass idex,BMI)。根據最新的肥胖診療指南[9],將BMI為18kg/m2~<24kg/m2,BMI為24kg/m2~<28kg/m2,BMI≥28kg/m2分別定義為正常體重(nonobese,NO)、超重(overweight,OW)和肥胖(obese,O)。
1.2.2標本的收集
患者于月經周期第3~5天;月經稀發或閉經者,超聲測量子宮內膜<5mm,卵泡<10mm時,空腹狀態下采集靜脈血。采用全自動化學發光分析儀(ROCHE)檢測血清AMH、黃體生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇(estradiol,E2)、T、催乳素(prolactin,PRL)、脫氫表雄酮(dehydroepiandrosterone,DHEA);根據實驗室參考值,T>1.67nmol/L為HA。采用全自動生化分析儀檢測空腹血糖(fasting plasma glucose,FPG)水平,采用電化學發光免疫測定法檢測空腹胰島素水平(fasting insulin,FINS)。
1.2.3相關指標的計算
采用穩態模型評估胰島素抵抗指數(homeostatic model assessment for insulin resistance,HOMA-IR),HOMA-IR=FPG(mmol/L)×FINS(μIU/L)/22.5,當HOMA-IR≥2.68時定義為IR[10]。
1.3統計學方法
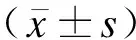
2結果
2.1一般資料情況
本研究共納入PCOS患者109例,平均年齡為(25.67±4.14)歲;體重正常者69例(63.30%),BMI平均值為(20.69±1.96)kg/m2;超重及肥胖者40例(36.70%),BMI平均值為(28.12±2.98)kg/m2;應用HOMA-IR指數計算IR者83例(76.15%),平均值為(4.70±2.67),見表1。

表1 PCOS患者臨床及內分泌特征Table 1 Clinical and endocrine characteristics of
2.2 PCOS患者不同AMH水平臨床特征及內分泌指標
將109例PCOS患者根據血清AMH檢測值按百分位(<25%,25%~75%,>75%)進行分層,比較各層的年齡、BMI、LH、FSH、T、FPG、FINS、HOMA-IR之間的差異。隨著AMH百分位升高,BMI、HOMA-IR值降低,差異均有統計學意義(P<0.05);同時,LH、T值升高,差異均有統計學意義(P<0.05);不同AMH百分位間的年齡、FSH、FPG、FINS值比較差異均無統計學意義(P>0.05),見表2。
2.3 PCOS患者AMH與BMI、LH、FSH、T、HOMA-IR值間的相關性
經Pearson雙變量相關性分析顯示,AMH與BMI、HOMA-IR均呈顯著負相關(r=-0.228,P<0.05;r=-0.214,P<0.05),與LH、T均呈顯著正相關(r=0.344,P<0.01;r=0.327,P<0.01),與FSH無顯著相關性,見表3。
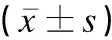
表2 PCOS患者不同AMH百分位間臨床特征及內分泌指標的比較Table 2 Comparison of clinical characteristics and endocrine indicators of different AMH percentiles in patients with PCOS

表3 PCOS患者AMH與BMI、LH、FSH、T、HOMA-IR值間的相關性分析Table 3 Correlation analysis of AMH with BMI,LH,FSH,T and HOMA-IR in patients with PCOS
2.4影響AMH的多元線性回歸分析
為進一步研究BMI、HOMA-IR、LH、T值對AMH的影響,進行多元線性回歸分析。在回歸模型中,控制BMI前,LH回歸系數β=0.275,P<0.01,T回歸系數β=0.287,P<0.01,表明LH、T對AMH均具有顯著正向影響,而HOMA-IR系數β=-0.232,P<0.05,表明HOMA-IR對AMH具有顯著負向影響;控制BMI后,HOMA-IR對AMH的影響消失(β=-0.170,P=0.133),LH、T仍均對AMH存在顯著正向影響(β=0.258,P<0.05;β=0.291,P<0.01),見表4。

表4 PCOS患者的AMH及各臨床指標回歸分析Table 4 Regression analysis of AMH and clinical indexes in patients with PCOS
3討論
本研究首次將109例符合鹿特丹標準的PCOS患者根據血清AMH檢測值按百分位(<25%,25%~75%,>75%)進行分層,探討PCOS患者血清AMH水平與性激素及IR的關系。已有大量研究顯示,PCOS患者血清AMH水平升高,甚至被認為是診斷PCOS,尤其是PCOM的潛在生物標志物[11-12],但PCOS患者中高水平AMH的發生機制尚不清楚。
3.1 PCOS患者血清AMH水平與雄激素的關系
眾所周知,雄激素在卵泡發育中起重要作用,隨著卵泡正常生長發育,所需雄激素水平逐漸降低,反之,卵泡發育過程中雄激素持續高水平會導致卵泡功能障礙[13]。目前關于雄激素對AMH作用的研究有限,且結果不一。有研究認為AMH可通過血腦屏障進入中樞系統,導致LH進一步升高,從而促進卵泡膜細胞分泌雄激素。
Crisosto等[14]從牛卵巢小卵泡(3~4mm)中分離培養顆粒細胞,加入相當于PCOS濃度的T后,AMH mRNA及AMH蛋白表達均顯著下降,因此認為PCOS中過量雄激素可通過抑制AMH表達,從而促進了小卵泡的發育。Zhang等[15]觀察到T可刺激小鼠顆粒細胞AMH mRNA表達及AMH分泌。Pierre等[16]研究顯示,在人PCOS卵泡液中AMH、AMHR2和雄激素受體mRNA較對照組顯著升高,給予5α-雙氫睪酮(5α-dihydrotestosterone,5α-DHT)可顯著上調PCOS顆粒細胞AMH和AMHR2的表達。但Dilaver等[17]從小竇卵泡中分離出顆粒細胞,加入不同濃度的T、雙氫睪酮(dihydrotestosterone,DHT)后,結果顯示低濃度T(10-9~10-7M)可降低AMH水平,10-6M以上濃度的T對AMH無顯著影響,10-8M濃度的5α-DHT可顯著降低AMH水平,大于10-5M濃度后AMH表達顯著增加。本研究顯示,隨著AMH百分位升高,T值逐漸升高,差異有統計學意義(P<0.05),雙變量分析亦顯示AMH與T值呈顯著正相關(P<0.01);同時,進一步回歸分析證明T對AMH的顯著正向影響。這與Dewailly等[18]的研究結果一致,其通過主成分分析顯示總T及游離雄激素指數與AMH及卵泡數均呈顯著正相關,并認為卵巢內卵泡數結合AMH可作為卵巢HA的替代指標。因此,本研究結果提示,PCOS中HA參與了AMH的過度表達,并具有正向調節作用。
3.2 PCOS患者血清AMH水平與LH的關系
本研究顯示,隨著AMH百分位升高,LH值逐漸升高,此外,Pearson分析顯示LH與AMH呈顯著正相關(P<0.01),經多元線性回歸分析顯示LH仍對AMH具有顯著的影響(P<0.05)。
近年關于促性腺激素對AMH的調節研究呈現出矛盾的結果。Catteau-Jonard等[19]的研究中對PCOS患者應用重組卵泡刺激素低劑量遞增方案治療,結果顯示,血清FSH升高伴隨著AMH檢測值水平的顯著下降,AMH與LH呈正相關,與FSH呈負相關,多元回歸分析后仍顯示LH、FSH對AMH具有顯著影響。Cimino等[20]對圍生期經過雄激素處理的PCOS小鼠腦室內注射AMH后,出現促性腺激素釋放激素(gonadotropin releasing hormone,GnRH)依賴性的LH脈沖和分泌增加,且相關性分析顯示AMH與LH呈顯著性正相關,未發現AMH與FSH之間存在相關性。本研究結果與Cimino等[20]的研究結果,不論是根據AMH的分層,還是Pearson相關性分析及回歸分析,均未顯示出AMH與FSH之間的關系,但與LH均呈顯著正相關。最近Crisosto等[21]的一項病例對照研究顯示,較正常對照組相比,PCOS患者子代女性初潮后時期具有更高水平的LH分泌,且LH脈沖水平與BMI呈負相關,與AMH及雄激素均呈顯著性正相關。
3.3 PCOS患者血清AMH水平與IR的關系
IR在PCOS中普遍存在,不同種族、檢測方法及診斷標準所得出的IR發生率在50%~80%之間[22]。本研究中,IR的發生率為76.15%。關于PCOS患者AMH與IR的關系研究結果不一。Feldman等[23]研究發現AMH與IR呈負相關;Wiweko等[24]研究顯示,PCOS患者的AMH與HOMA-IR呈正相關;ahin等[25]的研究結果則發現AMH與HOMA-IR無相關性。本研究顯示,隨著AMH百分位逐漸增高,BMI、HOMA-IR值均降低,差異均有統計學意義(P<0.05),相關性分析同樣顯示AMH與BMI、HOMA-IR均呈顯著負相關(P<0.05);但進一步行多因素回歸分析結果顯示,未控制BMI前,HOMA-IR對AMH有顯著負性影響,但在控制BMI后,這種影響消失;提示IR對AMH的影響可能是通過BMI所致。
雖然IR獨立于肥胖發生,但肥胖無疑會加劇PCOS患者的IR[26-27]。Moslehi等[28]進行的一項薈萃分析顯示,肥胖女性的AMH水平低于非肥胖女性,AMH與BMI呈顯著性負相關,因此認為肥胖對顆粒細胞產生的凋亡作用可以減少每個卵泡的AMH產生。最近Rios等[29]的一項研究顯示,低AMH水平與幾種不利的心臟代謝指標相關,但這些關系在控制BMI后消失。本研究顯示,控制BMI后,AMH與IR的相關性不再具有顯著性,提示HOMA-IR對AMH的影響可能是通過BMI所致。
綜上所述,PCOS患者血清AMH水平與LH及T均呈正相關,且LH、T對AMH具有正向調控作用;血清AMH水平與HOMA-IR的負相關性可以由BMI解釋。未來研究需進一步擴大樣本量,同時探討PCOS患者血清AMH水平與LH、T及BMI之間的具體調控機制,為PCOS診斷提供理論依據。

