油茶三萜類成分及其藥理活性的研究進展
徐 依,唐思琪,黃 浩,劉向前,李小軍
油茶三萜類成分及其藥理活性的研究進展
徐 依1, 2,唐思琪1,黃 浩1,劉向前3,李小軍1
1. 贛南醫學院藥學院 國家中藥現代化工程技術研究中心客家中醫藥資源研究分中心,江西 贛州 341000 2. 贛南醫學院第一附屬醫院,江西 贛州 341000 3. 湖南中醫藥大學藥學院,湖南 長沙 410208
油茶是我國重要的木本食用油料樹種,也是世界4大木本油料作物之一。大量現代植物化學研究發現油茶中主要含有三萜類、黃酮類及鞣質類等成分,其中三萜皂苷是油茶中的主要化學成分,該種植物的皂苷母核多為齊墩果烷型五環三萜,且具有豐富的藥理活性,如抗腫瘤、心血管系統保護、降血糖、調血脂、殺菌、神經細胞保護、抗炎等活性。對油茶三萜類成分及其藥理活性的研究進展進行綜述,同時,針對其抗腫瘤活性進行構效關系分析,以期為油茶這一藥食兩用資源的綜合開發利用提供一定的科學依據和理論參考。
油茶;三萜;三萜皂苷;抗腫瘤;心血管系統保護;降血糖;調血脂;殺菌;抗炎;構效關系
油茶Abel.為山茶科(Theaceae)山茶屬Linn植物,狹義上指普通油茶,廣義上則指山茶屬植物中油脂含量較高且有栽培經濟價值的一類植物的總稱[1]。油茶又名茶子樹、油茶樹,遍布我國17個省區,主要產于我國的西南部和東南部。茶油已被《中國藥典》2020年版收載,其藥用部位主要有茶子心、茶子餅、茶油、油茶葉、油茶根皮等,同時油茶也是我國基本的木本食用油料樹種。從南宋年間開始種植,至今已有2300多年的歷史[2],素有“東方橄欖油”“油中珍品”“綠色油庫”“鐵桿莊稼”“長壽油”“美容酸”之稱。與油橄欖、油棕、椰子并稱世界4大木本油料樹種[3]。其榨取的油色清,味香,營養豐富,耐貯藏,是優質食用油,同時,也可作為潤滑油、防銹油用于工業。現有研究表明油茶主要含有皂苷類、黃酮類及鞣質類等成分,具有多種藥理活性包括抗菌、抗腫瘤、抗炎、抗突變等。皂苷類化合物在山茶屬植物中普遍存在,尤其在種子和葉中含量較高。基于皂苷類化合物具有多種良好的生理活性,近年來,對于新的油茶三萜皂苷的發現及其相關的藥理活性研究屢見報道。本文對油茶三萜類成分及其藥理活性的研究進展進行綜述,以期為這一藥食同源資源的進一步綜合開發利用提供一定的科學依據和理論參考。
1 化學成分
目前對油茶的研究主要集中在根、籽、餅粕及莖上,三萜及其皂苷類成分為油茶中最主要的化學成分,本文總結了從油茶中分離并報道的96個三萜類化合物,化學成分及結構見圖1和表1。分析發現,從油茶中分離到的三萜類成分有很多共同的結構特征。第一,該屬植物三萜類成分的母核多為齊墩果烷型的五環三萜,且母核上有多個活性取代位點,主要有C-3、C-15、C-16、C-21、C-22、C-23、C-28位。第二,多數油茶皂苷的結構由皂苷元、糖基、有機酸3部分組成,且糖基取代基一般在C-3位,糖鏈部分主要包括五碳糖[阿拉伯糖(Ara)、木糖(Xyl)]、六碳糖[葡萄糖(Glc)、半乳糖(Gal)、鼠李糖(Rha)]、葡萄糖醛酸(GlcA)和葡糖糖醛酸甲基酯等。這些糖一般以低聚糖的形式與苷元結合,構成三萜類皂苷。第三,油茶皂苷有機酸的部分主要包括乙酸、當歸酸、惕各酸、己烯酸、2-甲基丁酸和肉桂酸等,它們可與皂苷元上的某些活潑羥基縮合形成酯。
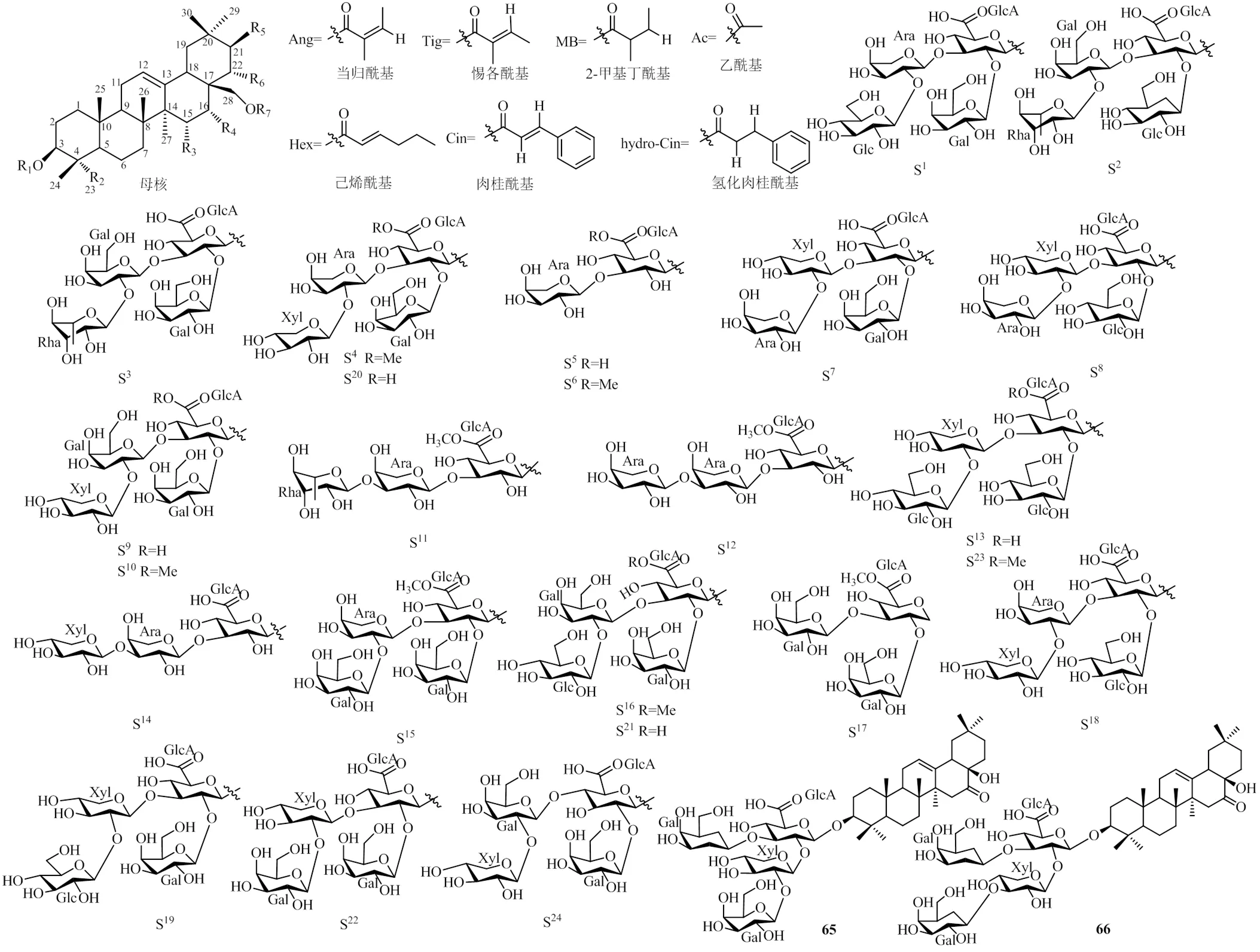
圖1 油茶三萜類化合物的化學結構
表1 油茶中的三萜類化合物
Table 1 Triterpenoids inC. oleifera
編號化合物名稱R1R2R3R4R5R6R7部位文獻 13α,16α,22α,28-四羥基-12-齊墩果烯HHHOHHOHH果仁4 23β,16α,21β,22α,28-五羥基-4β-醛基-齊墩果烯Hβ-CHOHOHOHOHH果仁4 33β,16α,21β,22α,28-五羥基-4α-醛基-齊墩果烯HCHOHOHOHOHH果仁4 4sasanquasaponinS1CH2OHHOHHOAngH籽5 5yuchasaponin AS2CH3OHOHOTigOTigH花6 6yuchasaponin BS2CH3HOHOTigOTigH花6 7yuchasaponin CS3CH3OHOHOTigOTigH花6 8yuchasaponin DS3CH3HOHOTigOTigH花6 9jegosaponin BS2CH3HOHOTigOHAc花6 10camelliasaponin B1S1CHOHOHHOAngH籽、餅粕、種子、根7-10 11theasaponin E2 methyl esterS4CHOHOHOAngOHAc餅粕11 1221,22-二當歸酰基山茶皂苷元EHCHOHOHOAngOAngH根12-14 1321-當歸酰基-22-(2-甲基-丁酰基)山茶皂苷元EHCHOHOHOAngOMBH根12,14 142l,22-二當歸酰基-R1-玉蕊醇HCH3OHOHOAngOAngH根12-15 1521-當歸酰基-22-(2-甲基-丁酰基)-R1-玉蕊醇HCH3OHOHOAngOMBH根12-14 16油茶根素IHCHOOHOHOAngOAngH根12,14 17油茶根素ⅡHCHOOHOHOAngOMBH根12,14 1822-當歸酰基-玉蕊醇A1HCH3OHOHHOAngH根12-14 1921,22-二當歸酰基-玉蕊皂苷元CHCH3HOHOAngOAngH根12-14 2021-當歸酰基-22-(2-甲基-丁酰基)玉蕊皂苷元CHCH3HOHOAngOMBH根12-15 21油茶根素ⅢHCH2OHOAcOAcOAngOAngH根12 22油茶根素ⅣHCH2OHOAcOAcOAngOMBH根12 23油茶皂苷IS5CH2OHOAcOAcOAngOAngH根12 24油茶皂苷ⅡS5CH2OHOAcOAcOAngOMBH根12 25油茶皂苷ⅢS6CH2OHOAcOAcOAngOAngH根12 26油茶皂苷ⅣS6CH2OHOAcOAcOAngOMBH根12 27油茶皂苷ⅤS5CH2OHOHOHOAngOAngH根12,16 28oleiferasaponin A1S1CHOHOHHHexOH餅粕、種子9,17 2921β,22α-diangeloyloxy-3β,15α,16α,28-tetrahydroxyolean-12-en-23-alHCHOOHOHOAngOAngH根13 3021β-angeloyloxy-3β,15α,16α,28-tetrahydroxy-22α-(2-methylbutanoyloxy)-olean-12-en-23-alHCHOOHOHOAngOMBH根13 3121β-angeloyloxy-3β,16α,28-trihydroxy-22α-(2-methylbutanoyloxy)-olean-12-en-23-alHCHOHOHOAngOMBH根13 32oleiferasaponin B1S7CHOHOHCH2OHOTigH籽18 33oleiferasaponin B2S8CHOHHHhydro-cinOH籽18 34oleiferoside AS9CHOOHOHOAngOAngH根14,16,19 35oleiferoside BS9CHOOHOHOAngOMBH根14,16,19
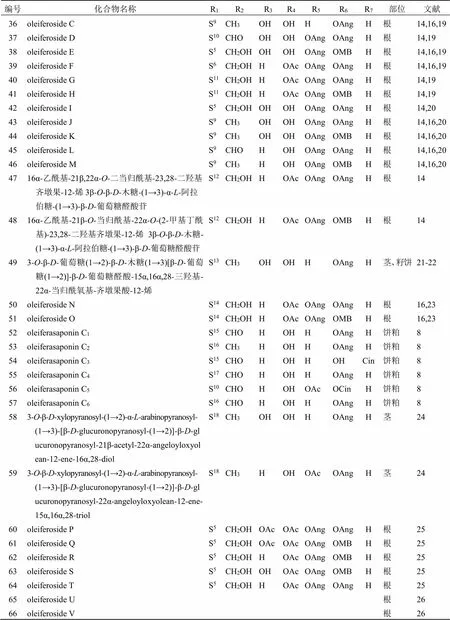
續表1
續表1
編號化合物名稱R1R2R3R4R5R6R7部位文獻 673-O-β-D-半乳糖(1→2)[β-D-葡萄糖(1→2)-β-D-木糖(1→3)]-β-D-葡萄糖醛酸-15α,16α,28-三羥基-22α-當歸酰氧基齊墩果-12-烯S19CH3OHOHHOAngH莖、籽餅22 683-O-β-D-葡萄糖(1→2)[β-D-木糖(1→2)-α-L-阿拉伯糖(1→3)]-β-D-葡萄糖醛酸-15α,16α,28-三羥基-22α-當歸酰氧基齊墩果-12-烯S18CH3OHOHHOAngH莖、籽餅22 693-O-β-D-半乳糖(1→2)[β-D-木糖(1→2)-α-L-阿拉伯糖(1→3)]-β-D-葡萄糖醛酸-15α,16α,28-三羥基-22α-當歸酰氧基齊墩果-12-烯S20CH3OHOHHOAngH莖、籽餅22 703-O-β-D-半乳糖(1→2)[β-D-木糖(1→2)-β-D-半乳糖(1→3)]-β-D-葡萄糖醛酸-16α,28-二羥基-22α-巴豆酰氧基齊墩果-12-烯-23-醛S9CHOHOHHOTigH莖、籽餅22 713-O-β-D-半乳糖(1→2)[β-D-木糖(1→2)-β-D-半乳糖(1→3)]-β-D-葡萄糖醛酸-16α,28-二羥基-22α-當歸酰氧基齊墩果-12-烯-23-醛S9CHOHOHHOAngH莖、籽餅22 723-O-β-D-半乳糖(1→2)[β-D-木糖(1→2)-β-D-半乳糖(1→3)]-β-D-葡萄糖醛酸-16α,28-二羥基-22α-當歸酰氧基齊墩果-12-烯S9CH3HOHHOAngH莖、籽餅22 733-O-β-D-半乳糖(1→2)[β-D-木糖(1→2)-β-D-半乳糖(1→3)]-β-D-葡萄糖醛酸-16α,28-二羥基-22α-O-(2-甲基-丁酰基)齊墩果-12-烯-23-醛S9CHOHOHHOMBH莖、籽餅22 743-O-β-D-半乳糖(1→2)[β-D-葡萄糖(1→2)-β-D-半乳糖(1→3)]-β-D-葡萄糖醛酸-16α,28-二羥基-22α-巴豆酰氧基齊墩果-12-烯-23-醛S21CHOHOHHOTigH莖、籽餅22 753-O-β-D-半乳糖(1→2)[β-D-半乳糖(1→2)-β-D-木糖(1→3)]-β-D-葡萄糖醛酸-15α,16α,28-三羥基-22α-當歸酰氧基齊墩果-12-烯S22CH3OHOHHOAngH莖、籽餅22 763-O-β-D-葡萄糖(1→2)[β-D-葡萄糖(1→2)-β-D-木糖(1→3)]-β-D-葡萄糖醛酸甲酯苷-15α,16α,28-三羥基-22α-當歸酰氧基齊墩果-12-烯S23CH3OHOHHOAngH莖、籽餅22 773-O-β-D-半乳糖(1→2)[β-D-葡萄糖(1→2)-α-L-阿拉伯糖(1→3)]-β-D-葡萄糖醛酸-16α,28-二羥基-22α-巴豆酰氧基齊墩果-12-烯-23-醛S1CHOHOHHOTigH莖、籽餅22 78油茶皂苷AaS22CH3OHOHHOAngH莖26 79camelliasaponin B2S1CHOHOHHOTigH莖、種子18,26 80gordonsaponin HS19CH3OHOHHOAngH莖26-27 81oleiferoside WS24CH3OHOHHOAngH根16,28 8215α,16α-二乙酰基-21β,22α-O-二當歸酰基-23,28-二羥基齊墩果-12-烯 3β-O-α-L-阿拉伯糖-(1→3)-β-D-葡萄糖醛酸苷S5CH2OHOAcOAcOAngOAngH根16
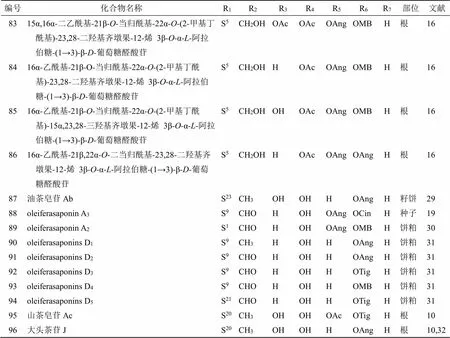
續表1
2 藥理活性
油茶三萜皂苷具有山茶屬植物皂苷的通性,生物活性多樣,現代藥理學研究表明其主要藥理活性為抗腫瘤,另外,還具有心血管保護、降血糖、調血脂、殺菌、神經細胞保護、抗炎等作用。
2.1 抗腫瘤
油茶三萜類化合物具有廣泛的抗腫瘤活性,如化合物34對多種癌細胞的增殖有抑制作用,可通過使B淋巴細胞瘤-2基因表達下調,半胱氨酸天冬氨酸蛋白酶-3表達上調誘導非小細胞肺腺癌A549細胞、人肝癌BEL-7402細胞發生凋亡[33]。化合物35通過調節p53蛋白表達和活性氧的釋放誘導人肝癌SMMC-7721細胞、人乳腺癌MCF-7細胞發生凋亡與自噬;在動物實驗中,0.5、1.0、2.0 mg/kg化合物35顯著抑制小鼠肝癌H22移植瘤生長且呈劑量相關性,但是,2.0 mg/kg化合物35表現出一定的細胞毒性[34]。化合物4抑制人胃癌MGC803細胞和人鼻咽癌CNE1、CNE2細胞的增殖且呈濃度相關性,對人胃癌細胞株治療安全性較大。動物實驗中,化合物4能抑制肉瘤S180荷瘤小鼠的腫瘤生長,在120 mg/kg劑量時對S180荷瘤小鼠的抑瘤率為41.77%,其抗腫瘤機制可能是增強荷瘤小鼠免疫功能,增加炎癥因子腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素(interleukin,IL)-2的釋放[35]。另外,化合物4可通過上調基因表達,下調細胞周期蛋白D1基因表達來抑制MCF-7細胞增殖,使細胞周期停滯在G1期,誘導腫瘤細胞凋亡,其機制可能是轉錄因子E2F1介導的非p53依賴性途徑[36]。化合物10、79對A549細胞有顯著的抑制活性,10 μmol/L劑量時的抑制率分別為94.44%、79.12%。化合物81對A549細胞呈現時間和劑量相關性抑制作用,使細胞周期阻滯在G2/M期;可誘導細胞發生凋亡與自噬,凋亡途徑與線粒體和活性氧相關[16]。化合物32、33對人結腸癌HCT-15細胞有很強的毒性,半數抑制濃度(median inhibitory concentration,IC50)值分別為(1.6±0.3)、(0.80±0.06)μmol/L[對照組米托蒽醌的IC50為(3.8±0.7)μmol/L][13]。化合物58、59分別對人結腸癌HCT-8、Bel-7402細胞和人低分化前胃癌BGC-823、A549細胞及人卵巢癌A2780細胞有抗增殖活性,IC50值為3.15~7.32 μmol/L[24]。化合物34~41[19]、42~46[20]、50~51[23]分別對A549細胞、小鼠黑色素瘤B16、BEL-7402細胞和MCF-7細胞表現出不同程度的抗增殖活性,其中化合物36的活性最強,IC50<10 μmol/L。化合物90~94分別對HCT-116細胞、人肝癌HepG2、BGC-823細胞和人肺癌NCI-H1650、A2780細胞有毒性,其中化合物90、91的毒性更強,IC50為3.31~10.23 μmol/L[31]。油茶三萜類化合物可以作為很好的抗腫瘤候選藥物,對于這些活性化合物的抗腫瘤機制研究有待進一步的深入探討。
2.2 心血管系統保護
研究表明,化合物4具有抗異丙腎上腺素(isoprenaline,ISO)所致大鼠心肌缺血時氧自由基和脂質過氧化作用,對缺血心肌線粒體膜的損傷有保護作用,具體表現為可降低線粒體丙二醛生成量,提高心肌線粒體超氧化物歧化酶和谷胱甘肽過氧化物酶活力,增強其清除氧自由基的能力,并呈現一定的劑量相關性[37]。同時,化合物4具有抗鈉鈣超載的心肌細胞保護作用,其作用機制可能是通過提高Ca2+, Mg2+-ATPase活性,維持線粒體結構和功能完整性來發揮抗心肌缺血的保護作用[38]。化合物4對ISO所致心肌缺血大鼠可產生藥理性預適應保護作用,可能通過以下作用機制:一是激活一氧化氮合酶,誘導一氧化氮和腺苷的形成[39],二是激活KATP通道引起K+外流加速復極,縮短動作電位時程,減少Ca2+內流而發揮作用[40]。另外,化合物4對熱應激所致人臍靜脈血管內皮細胞HUVECs的損傷具有保護作用,可抑制熱應激誘導內皮細胞與白細胞黏附的增加,且呈一定的濃度相關性,作用可能與下調細胞間黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表達有關[41]。此外,對缺氧-復氧誘導的HUVECs細胞損傷同樣有保護作用,其機制可能與其抗脂質過氧化和抑制白細胞黏附有關[42]。化合物4還可抑制脂多糖誘導的HUVECs細胞ICAM-1的表達,其機制可能與絲裂原活化蛋白激酶-細胞外信號調節激酶1/2信號轉導通路有關[43]。綜上所述,化合物4具有潛在的心血管系統保護作用。
2.3 抗菌
油茶皂苷對多種細菌和真菌具有一定的抑制作用。總皂苷含量為(95.42±0.10)%的油茶粕提取物對金黃色葡萄球菌、大腸桿菌、枯草芽孢桿菌、菌毛霉菌、米曲霉、根霉、酵母菌、青霉菌的最低抑菌質量濃度分別為31.3、31.3、62.5、250、250、250、31.3、125 μg/mL[44]。1、10 mg/mL純化油茶籽總皂苷只對金黃色葡萄球菌、大腸桿菌有弱的抗菌活性,但對真菌表現出更強的抑制作用,特別是對玉米小斑病菌和念珠菌,且0.1 mg/mL的皂苷提取物就能顯著抑制菌絲體生長,因此,油茶籽皂苷提取物有開發為真菌抑制劑的較好前景[45]。化合物10在1×10?4時對AG-4RST-04菌落的抑制率達63.43%,其IC50值為5.57×10?5,可作為植物源農藥來抑制蔬菜種子絲核菌的衰減[46]。
2.4 神經細胞保護
研究表明,從油茶籽粕中提取的皂苷元對由1-甲基-4-苯基-1,2,3,6-四氫吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)誘導的帕金森小鼠的多巴胺神經細胞具有保護作用。皂苷元及其胺化衍生物通過抗神經炎癥作用機制,能抑制TNF-α和IL-1β在小鼠腦組織中的表達并保護大腦中的多巴胺能神經元免受破壞。此外,還能改善MPTP引起的小鼠運動功能障礙,其機制是激活多巴胺受體而不是腺苷受體;和皂苷元相比,胺化衍生物能更好地改善帕金森癥狀,可能是因為其對多巴胺受體有更強的親和力[46]。因此,油茶皂苷有望開發成治療帕金森病的有效候選藥物。oleiferasaponin A1(28)可顯著降低H2O2損傷模型的腎上腺髓質嗜鉻細胞瘤PC12細胞的死亡率,和實驗組(5 mm/L H2O2)相比,5 mm/L H2O2+25 μm/L oleiferasaponin A1和5 mm/L H2O2+125 μm/L oleiferasaponin A1能顯著提高PC12細胞的存活率,表現出神經細胞保護作用[48]。
2.5 降血糖和調血脂
化合物28對高血糖造成的胰島β細胞損傷具有一定的保護作用,且隨著濃度(25、50、100 μmol/L)的升高,大鼠胰島β細胞瘤細胞RIN-m5f分泌的胰島素水平升高,即具有潛在的降血糖作用[9],因此,油茶皂苷類化合物具有潛在的糖尿病治療效果。化合物89具有抑制HepG2細胞脂質聚集的活性,在濃度為10 μmol/L時,顯示出顯著的調血脂作用。其機制是通過影響脂肪酸代謝過程中的多種基因和相關蛋白質的表達來調節脂肪酸代謝,從而抑制HepG2細胞的脂質聚集[30]。
2.6 對燒傷引起的炎癥保護作用
化合物4可以有效地減輕燒傷引起的炎癥反應,能明細降低燒傷大鼠血清中sICAM-1的水平,同時能在一定程度上降低大鼠主動脈中的mICAM-1表達和轉錄。此外,還能顯著地降低燒傷大鼠皮膚毛細血管通透性且呈劑量相關性,起到抗炎保護作用[47]。
3 油茶皂苷的抗腫瘤活性構效關系分析
隨著油茶皂苷單體化合物及新化合物不斷的被分離鑒定,對油茶皂苷的抗腫瘤活性的研究已成為熱點,通過系統分析,總結其構效關系,可以大致預測其抗腫瘤活性。
3.1 C-28位羥基對活性有至關重要的影響
宗建法[8]把從油茶籽餅粕中分離鑒定出的7種皂苷化合物oleiferasaponins C1~C6(52~57)對5種腫瘤細胞株(BEL-7402、BGC-823、MCF-7、HL-60和KB細胞)進行抗癌活性研究,除oleiferasaponin C3(54)外,其余化合物均表現出很強的抗癌活性。從構效關系分析,除oleiferasaponin C3的C-28位碳連接了肉桂酸基團外,其余化合物的C-28位碳連接的都是羥基,大致可以推斷C-28位取代基類型對活性有重要影響,進一步與結構相似的oleiferasaponin B2(32)進行比較,oleiferasaponin B2的C-28位也為羥基,可以推測C-28位碳上的羥基是抗癌活性必需基團,當羥基被取代后,抗癌活性將消失。
3.2 C-16位上的羥基對抗腫瘤活性有重要影響
Li等[20]把從油茶根中分離出的8個三萜皂苷oleiferosides A~H(34~41)對人的4種腫瘤細胞株(A549、B16、BEL-7402和MCF-7細胞)進行毒性測試,將oleiferoside F(39)、oleiferoside G(40)、oleiferoside H(41)和前面的幾種皂苷比較發現,化合物39~41對上述4種癌細胞的抑制效果更差,從化學結構上分析化合物39~41的C-16位碳上均無羥基取代,基于此可以推測C-16位碳上的羥基對腫瘤細胞抑制活性起到重要的作用。吳江平[16]檢測了從油茶根中分離到的YW1~8(82~86、65~66、81)對3種不同的腫瘤細胞(A549、SMMC-7721與MCF-7細胞)增殖的影響。結果發現只有YW8(81)表現出很強的細胞毒性。分析其結構發現,只有YW8的C-16位碳上為羥基,進一步說明C-16位碳上的羥基對抗腫瘤活性的重要性。Wu等[25]將油茶根中分離到的5個油茶皂苷oleiferosides P~T(60~64)對3種人腫瘤細胞系(A549、SMMC-7721和MCF-7細胞)進行毒性測試,發現除oleiferosides S(63)表現出很弱的活性外,其余化合物均無活性。分析結構發現oleiferosides P~T的C-16位碳上取代基都不是羥基,更明確了C-16位碳上的羥基取代對腫瘤細胞抑制活性的重要性。
3.3 C-21位上取代對活性的影響
Li等[20]發現oleiferoside C(36)對4種腫瘤細胞都有很好的抑制作用,其IC50值均小于10 μmol/L,然而oleiferosides A、B、D、E(34、35、37、38)的抑制活性要稍弱一些。經構效關系分析發現,它們的結構差別主要在C-21位碳上連接的基團不同,oleiferoside C的C-21位碳上的氫未被取代,而oleiferosides A、B、D、E的C-21位碳上的氫被當歸酰氧基取代,推測C-21位碳上的氫未被其他基團取代的油茶皂苷有更好的抑制腫瘤細胞活性。吳江平[16]發現YW8(81)有很好的抗癌細胞增殖活性,經構效關系分析發現其C-21位碳上的氫也未被其他基團取代,研究結果表明油茶皂苷C-21位碳上的氫未被取代時抗癌活性更好。
3.4 C-22位上取代基類型對活性的影響
連有當歸酰氧基(C-22-O-Ang)的活性要強于2-甲基丁酰氧基(C-22-O-MB)和惕各酰氧基(C-22-O-Tig)。將oleiferoside A(34)與oleiferoside B(35)[19]、oleiferoside J(43)與oleiferoside K(44)[20]、oleiferasaponins D2(91)與oleiferasaponins D4(93)[31]的抗癌活性結果進行比較,結果表明連接在C-22位碳上的取代基為當歸酰氧基時的抗腫瘤效果要強于2-甲基丁酰氧基;將oleiferasaponins D2(91)與oleiferasaponins D3(92)[31]、camelliasaponin B1(10)與camelliasaponin B2(79)[9]的抗癌活性結果進行比較,結果表明當母核C-22位上的取代基為當歸酰氧基時的抑制效果要強于惕各酰氧基。
3.5 C-3位上連接的糖體部分對活性的影響
將oleiferoside A(34)與oleiferoside D(37)[19]的抗癌活性結果進行比較發現,兩者的結構區別只在于C-3位上連接的糖體部分不同,推測糖體部分的葡萄糖醛酸甲氧化變成葡萄糖醛酸甲基酯之后活性略減弱。
3.6 其他
Zhou等[18]把從油茶籽餅粕中分離出的2種油茶皂苷oleiferasaponin B1(32)、oleiferasaponin B2(33)對4種腫瘤細胞株(A549、SK-OV-3、SK-MEL-2和HCT15)進行細胞毒性測試,實驗結果表明這2種油茶皂苷都有較好的抗癌活性,但oleiferasaponin B2對4種癌細胞IC50值都要小于oleiferasaponin B1,說明oleiferasaponin B2的活性要強于oleiferasaponin B1,從構效關系分析看,兩者的結構區別只在于oleiferasaponin B2在C-22位碳上連接了氫化肉桂酸基團,而oleiferasaponin B1連接的是惕各酸基團,推測帶有苯環的取代基的化合物可能具有更大的細胞毒性。
以上構效關系研究都只是通過簡單的化合物結構比較分析得出的結論,實際的抗腫瘤細胞毒活性究竟是哪個部位起關鍵性作用或還有其他活性部位聯合起作用都有待于更深入的探索與研究。
4 結語及展望
隨著生活水平的提高,人們對綠色食品的需求逐漸提高,越來越關注油茶,對其研究也逐年增多,這種發展趨勢符合我國人民乃至全人類對綠色食品的認識和研究需求。油茶三萜類成分及其皂苷作為油茶的主要物質基礎,表現出多種生物活性,特別是其抗腫瘤活性和對心血管系統的保護作用為其開發成藥食兩用資源奠定了基礎,對其進行深入研究具有一定的社會意義和科學價值。在我國油茶的種植面積廣大,品質繁多,這為研究油茶提供了天然條件。隨著各種現代分離分析技術的應用,越來越多的油茶皂苷以及油茶中其他生物活性成分被發現,這為深入研究其藥理活性和綜合利用油茶創造了條件,同時也表明油茶皂苷具有廣泛的研究前景與藥用價值。
另外,糖萜素是我國首項具有自主知識產權的新飼料添加劑,其主要有效成分是油茶皂苷和茶籽糖復合物。現有研究表明,糖萜素和油茶皂苷對豬繁殖與呼吸綜合征病毒、偽狂犬病病毒具有顯著直接滅活作用和增殖抑制作用,糖萜素和油茶皂苷對呼吸綜合征病毒、偽狂犬病病毒具有一定感染阻斷作用;糖萜素對豬細小病毒有一定直接滅活和增殖抑制作用。糖萜素和油茶皂苷具有明顯體外抗病毒活性[48]。然而,到目前為止有關油茶皂苷提取物及三萜成分是否也對新型冠狀病毒有抑制效果未見任何相關報道,值得進一步研究。
利益沖突 所有作者均聲明不存在利益沖突
[1] Ruter J M. Nursery production of tea oil camellia under different light levels [A] // Janick J, Whipkey A.[M]. ASHS Press, Alexandria, VA: 2002: 222-224.
[2] 中國科學院華南植物研究所. 海南植物志[M]. 北京:科學出版社, 1964: 10.
[3] 李遠發, 胡靈, 王凌暉. 油茶資源研究利用現狀及其展望 [J]. 廣西農業科學, 2009, 40(4): 450-454.
[4] 張友杰, 田世雄, 何堅. 油茶(Abel)皂苷元的分離及結構的研究 [J]. 武漢生物工程學院學報, 2005(1): 43-45.
[5] Huang Q R, He M, Chen H P,. Protective effects of sasanquasaponin on injury of endothelial cells induced by anoxia and reoxygenation[J]., 2007, 101(5): 301-308.
[6] Sugimoto S, Chi G H, Kato Y,. Medicinal flowers. XXVI. Structures of acylated oleanane-type triterpene oligoglycosides, yuchasaponins A, B, C, and D, from the flower buds of-gastroprotective, aldose reductase inhibitory, and radical scavenging effects- [J]., 2009, 57(3): 269-275.
[7] Kuo P C, Lin T C, Yang C W,. Bioactive saponin from tea seed pomace with inhibitory effects against[J]., 2010, 58(15): 8618-8622.
[8] 宗建法. 油茶籽皂苷分離鑒定及其抗腫瘤細胞增殖活性初步研究 [D]. 合肥: 安徽農業大學, 2015.
[9] Di T M, Yang S L, Du F Y,. Cytotoxic and hypoglycemic activity of triterpenoid saponins fromAbel. seed pomace [J]., 2017, 22(10): E1562.
[10] 任琦, 陳岡, 周志強, 等. 油茶根中1個新的三萜皂苷 [J]. 中草藥, 2019, 50(18): 4261-4265.
[11] Chen J H, Wu H Y, Liau B C,. Identification and evaluation of antioxidants defattedseeds by isopropanol salting-out pretreatment [J]., 2010, 121(4): 1246-1254.
[12] 佟小靜. 油茶根化學成分研究 [D]. 蘇州: 蘇州大學, 2011.
[13] Wang S L, Chen Z, Tong X J,. Triterpenoids from the roots ofAbel. and their cytotoxic activities [J]., 2013, 96(6): 1126-1133.
[14] 李夏. 油茶根化學成分研究(II) [D]. 蘇州: 蘇州大學, 2014.
[15] 佟小靜, 陳重, 李夏, 等. 油茶根化學成分的研究 [J]. 中草藥, 2011, 42(10): 1936-1938.
[16] 吳江平. 油茶根中皂苷類化學成分及其抗腫瘤活性的研究 [D]. 蘇州: 蘇州大學, 2016.
[17] Zhang X F, Han Y Y, Bao G H,. A new saponin from tea seed pomace (Abel.) and its protective effect on PC12 cells [J]., 2012, 17(10): 11721-11728.
[18] Zhou H, Wang C Z, Ye J Z,. New triterpene saponins from the seed cake ofand their cytotoxic activity [J]., 2014, 8: 46-51.
[19] Li X, Zhao J P, Peng C P,. Cytotoxic triterpenoid glycosides from the roots of[J]., 2014, 80(7): 590-598.
[20] Li X, Zhao J P, Li X R,. New triterpenoid glycosides from the roots ofAbel [J]., 2015, 98(4): 496-508.
[21] 鄢慶偉, 鐘瑞建, 周國平, 等. 油茶莖化學成分研究 [J]. 中藥材, 2015, 38(10): 2102-2104.
[22] 鄢慶偉. 油茶化學成分研究 [D]. 南昌: 南昌大學, 2016.
[23] Yang P, Li X, Liu Y L,. Two triterpenoid glycosides from the roots ofand their cytotoxic activity [J]., 2015, 17(8): 800-807.
[24] Yan Q W, Fu H Z, Luo Y H,. Two new triterpenoid glycosides from the stems ofAbel. [J]., 2016, 30(13): 1484-1492.
[25] Wu J P, Zhao J P, Liu Y L,. Five new triterpenoid saponins from the roots ofAbel. with cytotoxic activities [J]., 2015, 13: 379-385.
[26] 焦玉蘭, 付輝政, 周國平, 等. 油茶莖中1個新的三萜皂苷 [J]. 中草藥, 2016, 47(15): 2592-2596.
[27] Fu H Z, Li C J, Yang J Z,. Triterpenoid glycosides from the stems of[J]., 2013, 85: 167-174.
[28] Wu J P, Kang N X, Zhang M Y,. Oleiferoside W from the roots ofAbel., inducing cell cycle arrest and apoptosis in A549 cells [J]., 2018, 20(8): 793-806.
[29] 熊磊, 付輝政, 鄢慶偉. 油茶枯餅中1個新的三萜皂苷 [J]. 中草藥, 2017, 48(21): 4375-4380.
[30] Di T M, Yang S L, Du F Y,. Oleiferasaponin A?, a novel saponin fromAbel. seeds, inhibits lipid accumulation of HepG2 cells through regulating fatty acid metabolism [J]., 2018, 23(12): E3296.
[31] Fu H Z, Wan K H, Yan Q W,. Cytotoxic triterpenoid saponins from the defatted seeds ofAbel. [J]., 2018, 20(5): 412-422.
[32] Fu H Z, Li C J, Yang J Z,. Potential anti-inflammatory constituents of the stems of[J]., 2011, 74(5): 1066-1072.
[33] 張鐵. 油茶皂苷A抗腫瘤作用及其機制研究 [D]. 貴州: 貴陽醫學院, 2015.
[34] 楊萍. 油茶皂苷B抗腫瘤作用及其機制研究 [D]. 蘇州: 蘇州大學, 2015.
[35] 譚珍媛, 黃慧學, 梁秋云, 等. 油茶皂苷抗腫瘤作用研究 [J]. 中藥材, 2015, 38(1): 143-146.
[36] Chen L Y, Chen J, Xu H H. Sasanquasaponin fromAbel. induces cell cycle arrest and apoptosis in human breast cancer MCF-7 cells [J]., 2013, 84: 123-129.
[37] 黃起壬, 何明, 李萍, 等. 油茶皂苷抗心肌缺血大鼠氧自由基和脂質過氧化作用 [J]. 中國藥理學通報, 2003, 19(9): 1034-1036.
[38] 黃起壬, 曹守儀, 萬福生, 等. 油茶皂苷對缺血大鼠心肌線粒體Na+、Ca2+、Mg2+含量及ATPase活性的影響[J]. 中國臨床藥理學與治療學雜志, 1999, 4(3): 195-197.
[39] 黃起壬, 曹守儀, 何明, 等. NO介導的油茶皂苷對在體大鼠產生的藥理性預適應保護作用 [J]. 中草藥, 2001, 32(1): 46-48.
[40] 黃起壬, 曹守儀, 何明, 等. KATP通道介導的油茶皂甙對在體大鼠心肌產生的缺血預適應樣保護作用 [J]. 中國臨床藥理學與治療學, 2003, 8(2): 170-172.
[41] 黃起壬, 戴育成, 何明, 等. 熱應激誘導內皮細胞與白細胞黏附及油茶皂苷的拮抗作用 [J]. 中國藥理學通報, 2005, 21(9): 1092-1095.
[42] 黃起壬, 何明, 戴育成, 等. 油茶皂苷對缺氧-復氧誘導的內皮細胞損傷及中性粒細胞黏附的影響 [J]. 中草藥, 2005, 36(12): 1831-1834.
[43] 黃起壬, 戴育成, 陳和平, 等. 油茶皂苷對脂多糖誘導人臍靜脈內皮細胞ICAM-1表達的抑制作用 [J]. 中國藥學雜志, 2006, 41(22): 1706-1709.
[44] Hu J L, Nie S P, Huang D F,. Antimicrobial activity of saponin-rich fraction fromcake and its effect on cell viability of mouse macrophage RAW264.7 [J]., 2012, 92(12): 2443-2449.
[45] Zhang X F, Yang S L, Han Y Y,. Qualitative and quantitative analysis of triterpene saponins from tea seed pomace (Abel.) and their activities against bacteria and fungi [J]., 2014, 19(6): 7568-7580.
[46] Ye Y, Fang F, Li Y. Isolation of the sapogenin from defatted seeds ofand its neuroprotective effects on dopaminergic neurons [J]., 2014, 62(26): 6175-6182.
[47] Huang Q R, Shao L J, He M,. Inhibitory effects of sasanquasaponin on over-expression of ICAM-1 and on enhancement of capillary permeability induced by burns in rats [J]., 2005, 31(5): 637-642.
[48] 李燕. 糖萜素和油茶皂苷體外抗病毒活性研究 [D]. 杭州: 浙江大學, 2009.
Research progress on triterpenoids fromand their pharmacological activities
XU Yi1, 2, TANG Si-qi1, HUANG Hao1, LIU Xiang-qian3, LI Xiao-jun1
1. National Engineering Research Center for Modernization of Traditional Chinese Medicine - Hakka Medical Resources Branch, School of Pharmacy, Gannan Medical University, Ganzhou 341000, China 2. First Affiliated Hospital of Gannan Medical University, Ganzhou 341000, China 3. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
is an important woody edible oil tree species in China. Also, it is one of the four major woody oil crops in the world. A large number of modern phytochemical studies have found thatmainly contains triterpenoids, flavonoids, and tannins, and so on. Among them, pentacyclic triterpene saponins with oleanane-type are the main chemical components which possess many pharmacological activities, such as anti-tumor, cardiovascular system protection, hypoglycemic, hypolipidemic, bactericidal, nerve cell protection, and anti-inflammatory activities. Research progress on triterpenoids fromand their pharmacological activities as well as the structure-activity relationship analysis of anti-tumor activity of these natural products were reviewed in this paper, to provide a certain scientific basis and theoretical reference for the comprehensive development and utilization ofas a dual-purpose resource of medicine and food.
Abel.; triterpenes; triterpene saponins; anti-tumor; cardiovascular system protection; hypoglycemic; regulating blood-lipid; bactericidal activity; anti-inflammation; structure-activity relationship
R282.710.5
A
0253 - 2670(2022)04 - 1210 - 10
10.7501/j.issn.0253-2670.2022.04.029
2021-07-09
江西省自然科學基金資助項目(20202BABL216070);江西省教育廳科研項目(GJJ201538);贛南醫學院校級科研項目(QD201905,ZD201911,YB201910)
徐 依,女,碩士研究生,主要從事中藥及天然藥物活性成分研究。E-mail: 871148129@qq.com
李小軍,男,講師,碩士生導師,博士。E-mail: xjli@gmu.edu.cn
[責任編輯 崔艷麗]

