丹酚酸A對誘導Aβ42聚集的干預作用研究
劉美艷 李學波 魏鴻 潘曉麗
(成都中醫藥大學藥學院,成都 611137)
阿爾茨海默病(alzheimer disease,AD)是一種老年癡呆最常見的形式,由于慢性退行性神經系統而導致的疾病,尤其好發于老年人當中[1-3]。AD的病死亡率很高,僅次于心血管疾病和癌癥,不僅給患者帶來了巨大的傷痛,同時給患者家屬帶來了沉重的經濟負擔[4]。然而不幸的是到目前為止,AD的發病原因尚無定論,人們也還未找到治療AD的特異性藥物和方法。目前,關于AD有多種發病機理假說[5-11],很多病理學和基因證據支持淀粉樣蛋白假說。AD患者腦內老年斑的主要成分是β-淀粉樣蛋白(amyloid β-protein, Aβ) ,其聚集會產生細胞毒性,從而損傷神經細胞,最終導致患者出現認知功能障礙、記憶力衰退等臨床現象[12-14]。近年來,通過Aβ為靶點治療AD已成為研究熱點[15]。
科研人員尸檢時發現老年斑中金屬離子含量異常,其含量遠遠超過正常人,并且發現金屬離子如Zn2+和Cu2+等在體外能促進Aβ的聚集[16-17]。金屬離子穩態假說認為大腦中金屬離子紊亂會影響AD的病理進程。由于Aβ上具有金屬螯合位點, 而AD患者腦內的金屬離子含量高于正常人,因此許多金屬離子如Fe3+、Cu2+、Zn2+和Al3+等都能與Aβ結合形成Aβ-金屬復合物。因此,通過調節腦內金屬離子平衡可能成為治療AD的方向之一[18]。
近年來,丹參作為傳統中藥,其主要活性成分如醌類和酚酸類或與其他中藥配伍的方劑都能明顯改善AD癥狀[19-21]。丹酚酸A是從唇形科鼠尾草屬植物丹參(Salvia miltiorrhiza Bunge)中提取分離得到的一種酚酸類活性成分[22]。本文基于淀粉樣蛋白聯級假說和金屬離子穩態假說,利用ThT熒光實驗探究金屬Zn2+對Aβ聚集的影響,以及丹酚酸A對Zn2+誘導Aβ聚集的干預作用;同時在體外合成丹酚酸A金屬配合物,并對其進行結構表征,研究其可能的配位情況。希望通過本研究為探索中藥丹參治療AD的作用機制奠定基礎。
1 儀器與試劑
1.1 儀器
TDZ5-WS型多管架自動平衡離心機購自湖南湘儀儀器開發有限公司;BP211D型電子分析天平購自德國Sartorius公司;A560型雙光束紫外可見分光光度計購自翱藝儀器有限公司;DF-101S型集熱式恒溫加熱磁力攪拌器購自成都市國偉科技有限公司;全自動酶標儀購自Thermo公司;Tensor-27型傅立葉變換中紅外光譜儀購自Bruker公司;DZF型真空干燥箱購自北京科偉永興儀器有限公司;移液槍、96孔板購自成都勝拓儀器有限公司; AM-600型超導核磁共振購自Bruker公司。
1.2 試劑
六氟異丙醇、乙酸鋅、硫黃素T購自上海麥克林生化科技有限公司;氘代DMSO購自上海泰坦科技股份有限公司;Aβ42購自上海吉爾生化有限公司;丹酚酸A購自成都普思生物科技有限公司(純度大于98%);色譜甲醇購自諾爾施公司;Herpes緩沖液購自北京索萊寶科技有限公司;無水乙醇購自成都科隆有限公司。
2 樣品溶液的配制
2.1 Aβ42單體化
將Aβ42溶于六氟異丙醇中配成1 mmol/L清澈透明的溶液,然后置于通風廚內讓六氟異丙醇自然揮發12 h,而后真空冷凍干燥4 h后于-20℃儲存[23]。
2.2 Aβ42及各待試樣品溶液的配制
HFIP處理后的Aβ42用適量的DMSO完全溶解,隨后用Herpes緩沖液(0.1 mol/L, pH7.4)稀釋至所需濃度;1 mmol/L金屬Zn2+和丹酚酸A母液均用DMSO配制;5 mmol/L ThT母液用Herpes緩沖液(0.1 mol/L,pH7.4)配制,避光保存,實驗時使用上述Herpes緩沖液稀釋。
3 ThT熒光實驗
3.1 研究金屬Zn2+對Aβ42聚集的影響
配制一系列Aβ42濃度恒定而金屬Zn2+濃度不同的溶液。具體步驟:將Aβ42溶液分別與不同濃度的金屬Zn2+溶液混合,于37℃恒溫箱中共同孵育48 h。
3.2 研究丹酚酸A對Aβ42聚集的影響
配制一系列Aβ42濃度恒定而丹酚酸A濃度不同的溶液。具體步驟:將Aβ42溶液分別與不同濃度的丹酚酸A溶液混合,于37℃恒溫箱中共同孵育48 h。
3.3 研究丹酚酸A對金屬Zn2+誘導的Aβ42聚集的影響
配制一系列Aβ42和金屬Zn2+濃度恒定而丹酚酸A濃度不同的溶液。具體步驟:將Aβ42和金屬Zn2+溶液混合,于37℃恒溫箱中共同孵育5 min,加入不同濃度的丹酚酸A溶液,繼續置于37℃恒溫箱中孵育48 h。
3.4 研究丹酚酸A對Aβ42聚集體解聚的影響
配制一系列Aβ42濃度恒定而丹酚酸A濃度不同的溶液。具體步驟:將Aβ42溶液放置于37℃恒溫箱中孵育48 h,形成聚集體,隨后加入不同濃度的丹酚酸A溶液,繼續置于37℃恒溫箱中孵育48 h。
3.5 研究丹酚酸A對金屬Zn2+誘導的Aβ42聚集體解聚的影響
配制一系列Aβ42和金屬Zn2+濃度恒定而丹酚酸A濃度不同的溶液。具體步驟:將Aβ42和金屬Zn2+溶液混合,于37℃恒溫箱中共同孵育48 h,形成聚集體,隨后加入不同濃度的丹酚酸A溶液,繼續置于37℃恒溫箱中孵育48 h。
上述孵育液孵育好后,取20 μL至黑色96孔板中,加入180 μL硫黃素T溶液(5 μmol/L),同時設置3個復孔。最后,用多功能酶標儀測量熒光吸收值,設定激發波長450 nm,發射波長482 nm,記錄5 min末的熒光強度。
4 金屬配合物的合成
準確稱取丹酚酸A 49.4 mg(0.1 mmol)溶于5 mL無水乙醇中,在磁力攪拌器中溶解,待丹酚酸A完全溶解后滴加含有21.95 mg乙酸鋅(0.1 mmol)的無水乙醇溶液,反應液隨著乙酸鋅溶液的滴加逐漸從淡黃色變為黃綠色,同時反應液變渾濁,繼續在室溫下攪拌反應1 h,靜置一段時間后有沉淀,沉淀離心,再用無水乙醇洗滌數次直至上清液變為無色,產物于35℃真空干燥,得黃綠色粉末狀固體產物,稱重,W=實際重量,W0=理論重量,計算配合物產率。
產率(%)=W/W0×100%
5 統計學方法
實驗所得數據均用SPSS 20.0進行單因素方差分析,并且比較組間差別,當P<0.05判定為有統計學意義。根據Aβ42蛋白的熒光值來描述金屬Zn2+和丹酚酸A對Aβ42聚集的影響。
6 結果與討論
6.1 ThT熒光實驗結果
6.1.1 金屬Zn2+對Aβ42聚集的影響
本研究結果顯示,隨著金屬Zn2+濃度增加,Aβ42的熒光值逐漸升高。具體結果見圖1。
6.1.2 丹酚酸A對Aβ42聚集的影響
本研究結果顯示,隨著化合物丹酚酸A濃度增加,Aβ42的熒光值逐漸降低。具體結果見圖2。
6.1.3 丹酚酸A對金屬Zn2+誘導的Aβ42聚集的影響
本研究結果顯示,隨著化合物丹酚酸A濃度增加,金屬Zn2+誘導Aβ42聚集的熒光值逐漸降低。具體結果見圖3。
6.1.4 丹酚酸A對Aβ42聚集體解聚的影響
本研究結果顯示,隨著化合物丹酚酸A濃度增加,Aβ42聚集體的熒光值逐漸降低。具體結果見圖4。
6.1.5 丹酚酸A對金屬離子誘導的Aβ42聚集體解聚的影響
本研究結果顯示,隨著化合物丹酚酸A濃度增加,金屬Zn2+誘導Aβ42聚集體的熒光值逐漸降低.具體結果見圖5。
6.2 配合物的表征
6.2.1 配合物的一般性質
丹酚酸A-Zn(Ⅱ)配合物收率為53.47%。丹酚酸A-Zn(Ⅱ)配合物與丹酚酸A及乙酸鋅相比較,外觀顏色和性質都發生了顯著的變化。丹酚酸A-Zn(Ⅱ)配合物粉末顏色為黃綠色,難溶于丙酮、乙醚、三氯甲烷和乙酸乙酯等極性小的試劑,微溶于甲醇,溶于DMSO。
6.2.2 紫外光譜
本研究結果顯示,在200~600 nm范圍內對丹酚酸A和丹酚酸A-Zn(Ⅱ)配合物進行UV-vis 掃描分得到紫外吸收光譜(表1)。丹酚酸A的紫外吸收光譜中,205 nm為苯環的E帶吸收,289 nm為苯環的K帶吸收。丹酚酸A-Zn(Ⅱ)配合物的紫外光譜中仍有2個主要吸收峰。具體結果見表1。

表1 丹酚酸A及其金屬配合物的UV(nm)主要數據Tab.1 UV (nm) main data of salvianolic acid A and its metal complexes
6.2.3 紅外光譜
本研究結果顯示,在400 cm-1~4000 cm-1范圍內對丹酚酸A和丹酚酸A-Zn(Ⅱ)配合物進行掃描得到紅外光譜主要特征峰。具體結果見表2。
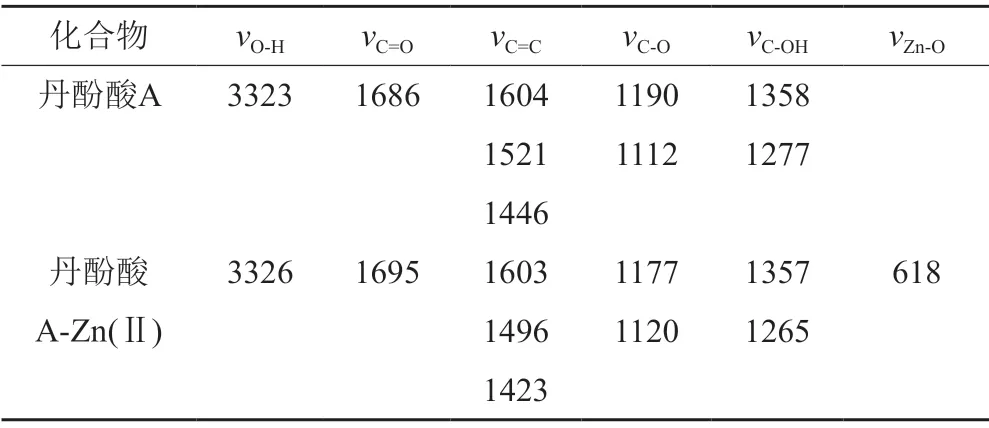
表2 丹酚酸A及其金屬配合物的IR(cm-1)主要數據Tab.2 Main data of IR (cm-1) of salvianolic acid A and its metal complexes
6.2.4 核磁共振氫譜
本研究結果顯示,丹酚酸A及其金屬配合物的核磁共振氫譜(表3)。由數據可見,金屬配合物相比于丹酚酸A,其核磁共振氫譜發生了少許變化。具體結果見表3。

表3 丹酚酸A及其金屬配合物的1H NMR 的數據(DMSO-d6)Tab.3 1H NMR data of salvianolic acid A and its metal complexes (DMSO-d6)
由參考文獻[24]和以上結構表征結果,可推測金屬配合物可能結構式:1分子丹酚酸A與1分子金屬Zn2+通過丹酚酸A的羧基和羧基鄰位的苯環形成配合物(圖6)。
6.3 討論
許多文獻已證明金屬離子能加速Aβ的聚集[25-26],通過本次ThT熒光實驗的結果,可推斷金屬Zn2+能快速誘導Aβ42的聚集,并且其促進作用呈現劑量依賴性,符合文獻所報道的。許多天然產物如楊梅素、槲皮素等,不僅自身能抑制Aβ的聚集,而且還能和金屬離子絡合從而抑制金屬離子誘導Aβ的聚集,具有雙靶點同時抑制作用[27-28]。丹酚酸A為酚酸類天然產物,通過本次ThT熒光實驗初步顯示丹酚酸A不僅能明顯抑制Aβ42的聚集,而且可以明顯促進Aβ42聚集體的解聚,并且其抑制作用和解聚作用均呈劑量依耐性;同時,丹酚酸A和Aβ42競爭性的絡合金屬Zn2+,從而抑制金屬Zn2+誘導Aβ42的聚集和促進金屬Zn2+誘導Aβ42聚集體的解聚。
紫外吸收峰的形狀基本保持不變,但吸收峰的位置發生了一定程度的紅移,表明配合物形成的同時沒有破壞丹酚酸A的共軛結構[29]。峰位移動的原因可能是:丹酚酸A與金屬Zn2+形成配合物后, 整個分子中電子的離域程度增大, 致使電子躍遷時需要的能量降低, 使吸收峰發生紅移[30]。
在紅外吸收光譜中丹酚酸A-Zn(Ⅱ)配合物的羧酸羰基吸收峰相比于丹酚酸A發生了一定程度的紅移,而且吸收強度明顯減弱,可能是配合物中配位作用使 C=O鍵作用力減弱,從而使電子云密度減少,表明羧基參與了配位成鍵[30]。芳環骨架振動頻率為1450 cm-1、1600 cm-1,丹酚酸A和丹酚酸A-Zn(Ⅱ)配合物在此區域內均出現吸收峰。然而丹酚酸A-Zn(Ⅱ)配合物的苯環吸收峰相比丹酚酸A發生了小幅度的藍移,吸收強度明顯減弱 ,并且從參考文獻[24]可知分子的空間結構上離配位點最近的苯環或雙鍵是最重要的影響因素,苯環的影響力要大于直鏈雙鍵,由苯環參與的配位更加穩定,說明苯環參與了配位反應。同時丹酚酸A-Zn(Ⅱ)配合物在低頻區600 cm-1左右出現了一個新的弱吸收峰,表明氧原子與金屬Zn2+形成了Zn—O配位鍵[31]。
配合物和丹酚酸A1H NMR 中均有六個酚羥基信號,只是化學位移有不同程度的變化,可能是受配位作用的影響。丹酚酸A1H NMR 中δ13.03(1H,S)為羧基的活潑氫信號[32],然而配合物的氫譜中未見此羧基氫的信號峰,表明羧基參與了配位反應。
因此,通過本次實驗得到的結果以及以往的文獻,可推測丹酚酸A-Zn(Ⅱ)配合物可能結構式為1分子丹酚酸A與1分子金屬Zn2+通過丹酚酸A的羧基和羧基鄰位的苯環形成配合物。
7 結論
本實驗基于淀粉樣蛋白學說和金屬離子穩態學說,采用ThT熒光法得出中藥丹參藥效成分丹酚酸A對Aβ42以及金屬Zn2+誘導Aβ42的聚集均有抑制作用,并且對Aβ42以及金屬Zn2+誘導Aβ42的聚集體均有解聚作用。體外模擬丹酚酸A和金屬Zn2+的絡合方式,并采用紫外光譜、紅外光譜、核磁共振氫譜對丹酚酸A-Zn(Ⅱ)配合物進行結構表征,研究其可能的配位結構。我們在對丹參大量化合物進行活性篩選的基礎上,發現丹酚酸A具有雙靶點同時抑制作用,因此希望通過本次實驗能為探索中藥丹參治療AD的作用機制奠定基礎。

