刺參(Apostichopus japonicus)幼參對高溫和低鹽協同脅迫的生理響應:生長和誘導型熱休克蛋白基因表達
于姍姍 ,李學玉 ,何振平,王青林,,孫桂清,付仲
(1.河北科技師范學院 海洋資源與環境學院,河北 秦皇島 066004;2.河北省海洋動力過程與資源環境重點實驗室,河北秦皇島 066004;3.秦皇島市海洋生境與資源重點實驗室,河北 秦皇島 066004;4.河北省海洋生物資源與環境重點實驗室,河北 秦皇島 066004;5.河北省海洋與水產科學研究院(河北省海洋漁業生態環境監測站),河北 秦皇島 066004)
1 引言
刺參(Apostichopus japonicus)為淺海底、溫帶物種,主要分布于35°~44°N 的西北太平洋沿岸[1]。作為海洋生態系統的重要組成部分,刺參能夠分解海底生物碎屑,在碳循環中發揮著極其重要的作用[2-4]。此外,由于刺參具有極高的藥用滋補作用,其消費市場需求不斷升高,養殖產量和增養殖規模隨之增長,其已成為我國北方和東南沿海重要的養殖種類之一[5]。據統計,2020 年全國刺參產量為1 965 64 t(占海水養殖總量的0.92%),年總產值高達315 億元(占海水養殖總產值的8.20%)[6]。但是,作為一種水生變溫生物,刺參對高溫和低鹽等環境脅迫非常敏感,2013 年、2016 年和2018 年夏季的極端高溫天氣和暴雨導致了池塘養殖刺參的大幅減產甚至絕產。然而,全球氣候變化背景下的極端高溫天氣和短時強降雨頻發,導致高溫期大量淡水注入刺參池塘,從而使養殖海水鹽度大幅降低,而且這種持續的高溫和低鹽狀況在河口地區更嚴重[7-8],給刺參池塘養殖帶來了嚴峻的挑戰。因此,研究極端環境下刺參的生理響應,對刺參產業的綠色發展具有重要的指導意義。
刺參的適宜生長溫度為10~20℃,且隨著刺參規格的增大而降低,體長為5~15 cm 的刺參的最適生長溫度為10~15℃[9]。諸多研究表明[1,10-13],溫度對刺參的生長、耗氧率、酶活力、攝食行為、腸道質量、配子的受精能力、熱休克蛋白(Heat Shock Protein,HSP)表達等各方面都有顯著的影響。鹽度是影響水生生物的另一個重要生態因子,作為狹鹽性的棘皮動物,刺參對鹽度的耐受程度有限,其適宜生長鹽度為28~34[14]。鹽度變化能顯著影響刺參的呼吸代謝、能量轉換和生長等,當鹽度低于22 時,可造成刺參大量死亡[15-16]。在遭受溫度、鹽度等環境因子脅迫時,水生生物體內會誘導產生HSP[17-18]。誘導型HSP 是指生物體在不利環境因素刺激下應激合成的一組在結構上高度保守、具有重要生理功能的特殊蛋白質分子家族。它最主要的功能是作為分子伴侶,可修復錯誤折疊蛋白、降解變性蛋白等[19-20]。研究表明[10,21],hsp70和hsp90基因在刺參抵抗溫度和鹽度脅迫的過程中發揮重要的作用。熱休克蛋白基因表達量與生物體的熱耐受性有關,且生物前期經歷的高溫脅迫能誘導熱休克蛋白高表達來防止蛋白損傷和聚集[22-23]。長期環境脅迫對生物來說是一種馴化,是指通過實驗誘導,使生物對某種生態因子的耐受性增強的過程[10,24]。這種脅迫能增加生物對新環境的適應性,特別是細胞結構和生理生化能隨著環境條件的改變而改變[25]。溫度和鹽度單因子脅迫對刺參的影響已有報道[10,22,26],但由于hsp基因具有交叉耐受性,一種環境脅迫誘導產生的hsp基因不僅能夠提高機體對該種脅迫的耐受性,同時也能增加對于其他環境脅迫的耐受能力[27-28]。因此,有必要研究多環境因子尤其是極端天氣導致的持續性高溫和低鹽協同脅迫對刺參生長和誘導型熱休克蛋白基因表達的影響。
為應對極端天氣帶來的挑戰,刺參從業者們采取了提高池塘水位、安裝增氧降溫設備、排表層淡水等一系列措施,起到了一定的效果。提高刺參自身抵抗逆境的能力也是非常關鍵的一個環節,這需要科研工作者加強多環境因素脅迫下刺參響應機制相關的研究,進而探索提高刺參抵抗逆境能力的途徑。因此,本研究通過分析高溫和低鹽長期協同脅迫(40 d)對刺參幼參生長和誘導型hsp70和hsp90基因表達的影響,探討兩個外源性因子對刺參的交互影響,從而為指導極端天氣下刺參生產實踐,促進刺參養殖產業的健康持續發展提供一定的理論依據。
2 材料與方法
2.1 實驗材料
實驗用刺參幼參購自山東省青島市養殖場。選取體表無損傷且活力好的刺參幼參在溫度為16℃,鹽度為32 的海水中暫養兩周。暫養期間每天足量投喂1 次配合飼料(主要成分:粗蛋白(18.58±0.23)%、脂肪(2.67±0.06)%、灰分(42.66±0.54)%、水分(9.94±0.17)%)。每天更換1/3~1/2 溫度為16℃,鹽度為32 的新鮮沙濾海水以保證養殖水質。暫養期間持續充氣,光照周期設置為14 h∶10 h(白天∶黑夜),pH為7.8~8.2,氨氮含量低于0.24 mg/L。
2.2 實驗設計
實驗設置4 個溫度梯度(16℃、20℃、24℃和28℃)和3 個鹽度梯度(22、27 和32),共12 個組合,每個組合3 個重復。將經過暫養的216 頭刺參幼參隨機分配到36 個規格為450 mm×250 mm×350 mm(長×寬×高)的玻璃缸中,每缸6 頭。采用水浴法并每天升高0.5~1℃的溫度,采用向自然海水中添加曝氣自來水的方法每天降低1~2 的鹽度,直至到達實驗設定溫度和鹽度,并在設定溫度和鹽度下持續40 d。
2.3 不同溫鹽協同脅迫下幼參的生長
刺參幼參饑餓24 h 后稱量初始濕體重,平均體重為(3.541±0.046)g。實驗期間每天足量投喂1 次配合飼料,每日換水1 次,換水前將沙濾海水調整到實驗所需的溫度和鹽度。每20 d 稱量體重1 次,實驗持續40 d。實驗結束后,刺參幼參饑餓24 h 后稱重,并計算幼參每天的特定生長率(Specific Growth Rate,SGR),公式為
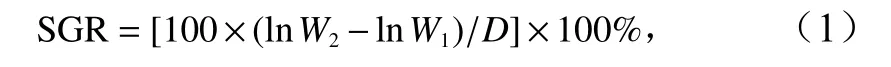
式中,W2和W1分別表示刺參幼參的末體重和初始體重;D為實驗持續的時間。
2.4 誘導型熱休克蛋白基因的表達
2.4.1 樣品的獲取
將經過40 d 高溫和低鹽協同脅迫的刺參幼參轉移至溫度為30℃,鹽度為20 的海水中急性脅迫2 h,之后在溫度為16℃,鹽度為32 的自然海水中進行恢復。在恢復6 h 的每個處理組隨機取4 頭刺參,迅速保存于液氮中。并取自然海水中的刺參作為空白對照。帶回實驗室進行后續實驗。
2.4.2 引物設計
本實驗中選取的2 條基因(hsp70,hsp90)篩選自NCBI 刺 參cDNA 文 庫(Ajhsp70,GH 985449;Ajhsp90,JF907619)。實驗中使用的引物(Hsp70-F 和Hsp70-R,Hsp90-F 和Hsp90-R)見表1。以刺參的部分β-actin 序列(312 bp)作為內參基因,其引物序列來自文獻[17]。

表1 用于本實驗的引物序列Table 1 Primers used in this study
2.4.3 總RNA 提取和基因表達分析
利用Trizol 試劑從體重約為80 mg 刺參體壁組織中提取總RNA。cDNA 第一鏈利用Oligo dT18 作為引物合成。合成的第一鏈cDNA 通過內參基因PCR檢驗其是否可用。PCR反應體系25μL,包括:2.5μL10×PCR擴增緩沖液、1.6μLMgCl2(25mmol/L)、2.0μLdNTPs(2.5mmol/L)、各1μL的上下游引物(10pmol/mL)、15.875μL滅菌水、0.125μL(5U/μL)TaqDNA聚合酶以及1μLcDNA模板。hsp70和hsp90反應程序為94℃反應5 min,接著是94℃ 45 s,53℃ 45s,72?C 1 min,30 個循環,最后72℃延伸10 min;內參基因反應程序為94℃反應5 min,接著是94℃ 45s,55℃ 45s,72?C 1 min,28 個循環,最后72℃延伸10 min。PCR 產物使用EB 染色的1.2%瓊脂糖凝膠電泳檢測,為了確保PCR 反應的特異性,產物進行膠回收并測序。電泳圖使用GeneTools 軟件分析,基因相對表達量通過其電泳圖中光密度值與內參基因光密度值的比值表示。
2.5 數據統計與分析
數據統計采用IBM SPSS Statistics 21.0 進行。用K-S 檢驗和Levene 檢驗分別對數據進行正態性和方差齊次性檢驗。應用雙因子方差分析(Two-way ANOVA)分析溫度和鹽度協同脅迫對刺參體重、特定生長率以及熱休克蛋白基因表達量的交互作用。采用Tukey’s 多重比較進行處理間的顯著性檢驗,以p<0.05作為差異顯著的標準。
3 結果與分析
3.1 高溫和低鹽協同脅迫對刺參幼參生長的影響
各組間刺參幼參的初始體重無顯著差異(F11,24=0.401,p=0.942),經過40 d 實驗,各組刺參幼參的末體重差異顯著(F11,24=69.534,p<0.001)(表2)。在同一鹽度下,刺參幼參的末體重隨溫度的升高而下降。在同一溫度下,刺參幼參的末體重隨鹽度的降低也呈下降的趨勢。其中溫度為16℃、鹽度為32 組的刺參幼參末體重最大,溫度為28℃、鹽度為22 組的末體重最小,并且在此處理組,刺參幼參出現死亡現象。雙因子方差分析顯示,溫度和鹽度對刺參幼參體重均有顯著性影響(溫度:F3,24=172.761,p<0.001;鹽度:F2,24=114.546,p<0.001),且兩者的交互作用顯著(F6,24=2.917,p=0.028)(表3)。
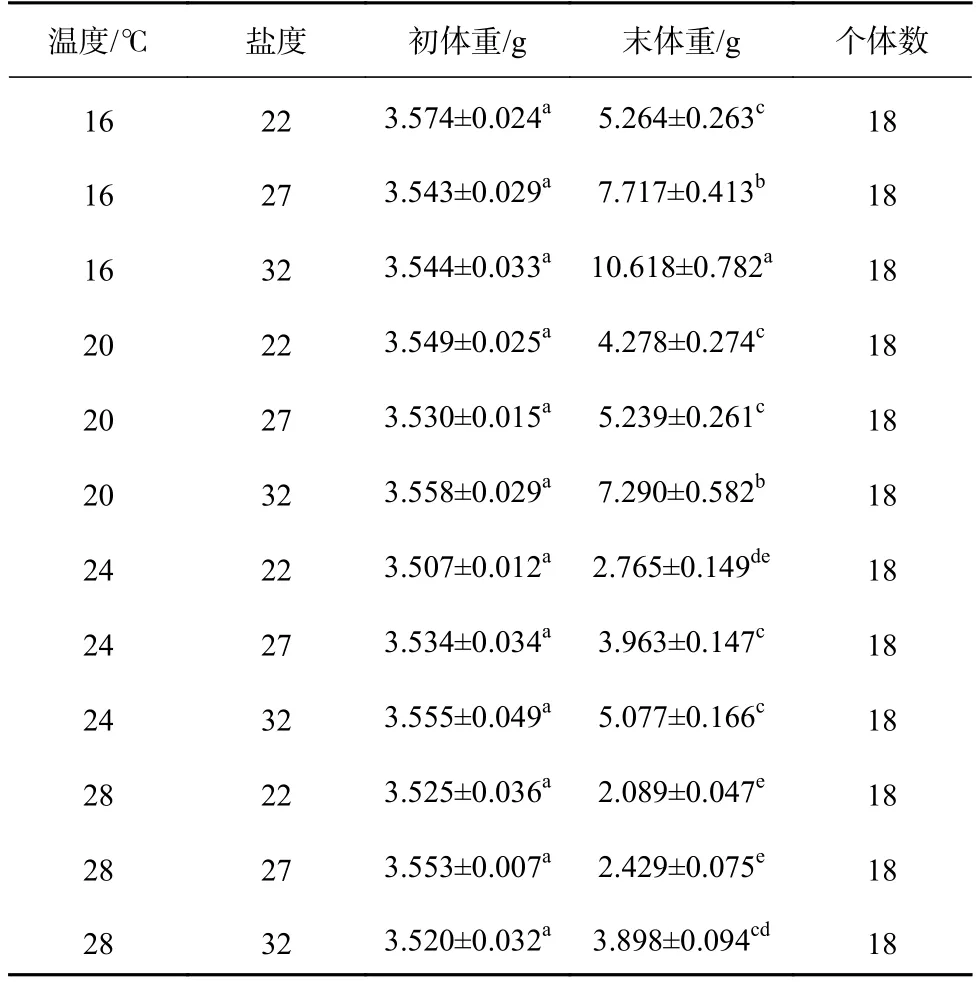
表2 高溫和低鹽協同脅迫對刺參幼參生長的影響Table 2 Effects of high temperature and low salinity collaborative stress on growth of juvenile Apostichopus japonicus
各處理組刺參幼參的特定生長率不同(圖1)。從圖上可以看出,經過40 d 實驗,溫度和鹽度對刺參幼參的特定生長率影響差異顯著(F11,24=87.132,p<0.001),在同一溫度或鹽度下,SGR 均隨著鹽度的降低以及溫度的升高而下降。雙因子方差分析顯示,溫度和鹽度對刺參幼參的SGR 均有顯著性影響(溫度:F3,24=220.109,p<0.001;鹽度:F2,24=143.439,p<0.001),但是兩者的交互作用不顯著(F6,24=1.874,p=0.127)(表3)。
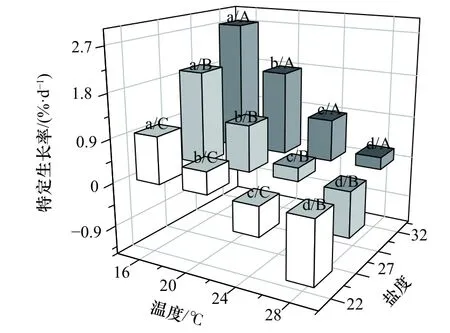
圖1 高溫和低鹽協同脅迫對刺參幼參特定生長率的影響Fig.1 Effects of high temperature and low salinity collaborative stress on specific growth rate of juvenile Apostichopus japonicus
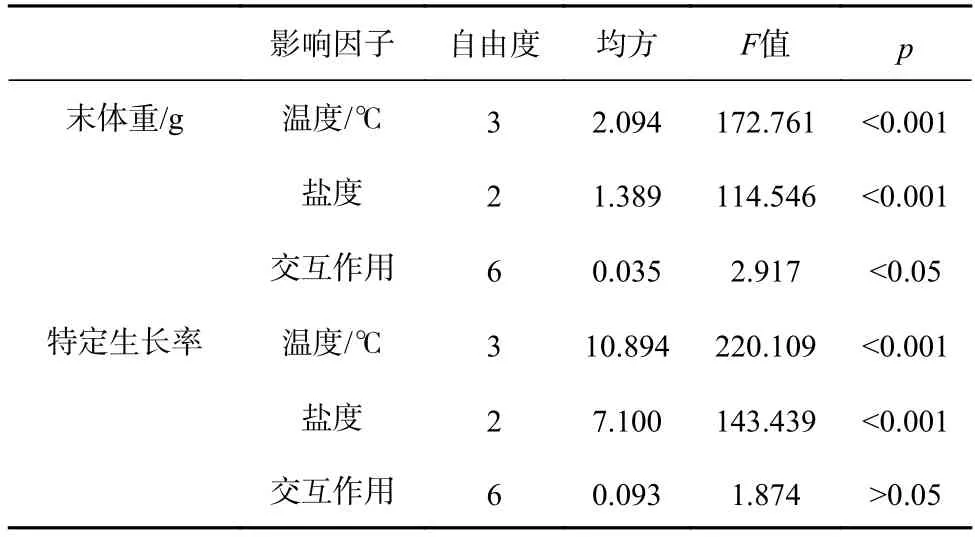
表3 溫度和鹽度對刺參幼參生長的雙因子方差分析Table 3 Two-way ANOVA of growth for the juvenile Apostichopus japonicus maintained in different temperature and salinity
3.2 高溫、低鹽協同脅迫對刺參幼參誘導型hsp70 和hsp90 基因表達的影響
雙因子方差分析結果表明,溫度對hsp70和hsp90相對表達量具有顯著影響(hsp70:F3,24=7.207,p=0.001;hsp90:F3,24=8.541,p<0.001)。但是鹽度以及兩者的交互作用對基因表達量的影響不顯著(hsp70:鹽度:F2,24=2.502,p=0.103;交互作用:F6,24=0.159,p=0.985;hsp90:鹽度:F2,24=1.861,p=0.177;交互作用:F6,24=0.157,p=0.986)(表4)。
表4 溫度和鹽度對刺參幼參誘導型hsp 基因表達量的雙因子方差分析Table 4 Two-way ANOVA of hsp gene expression for the juvenile Apostichopus japonicus maintained in different temperature and salinity levels
圖2a 為刺參幼參hsp70基因的相對表達量,各組間表達量差異顯著(F11,24=2.508,p=0.029)。在同一鹽度下,不同溫度組刺參幼參hsp70基因表達量均在溫度為28℃時最大,并且表達量隨著馴化溫度的升高而上升(圖2a)。在同一溫度下,鹽度為32 時,hsp70基因相對表達量最少。溫度為16℃和20℃時,hsp70基因相對表達量隨著鹽度的降低而升高,但是溫度為24℃和28℃時,鹽度27 條件下的表達量最大,鹽度22 時出現小幅度的下降。
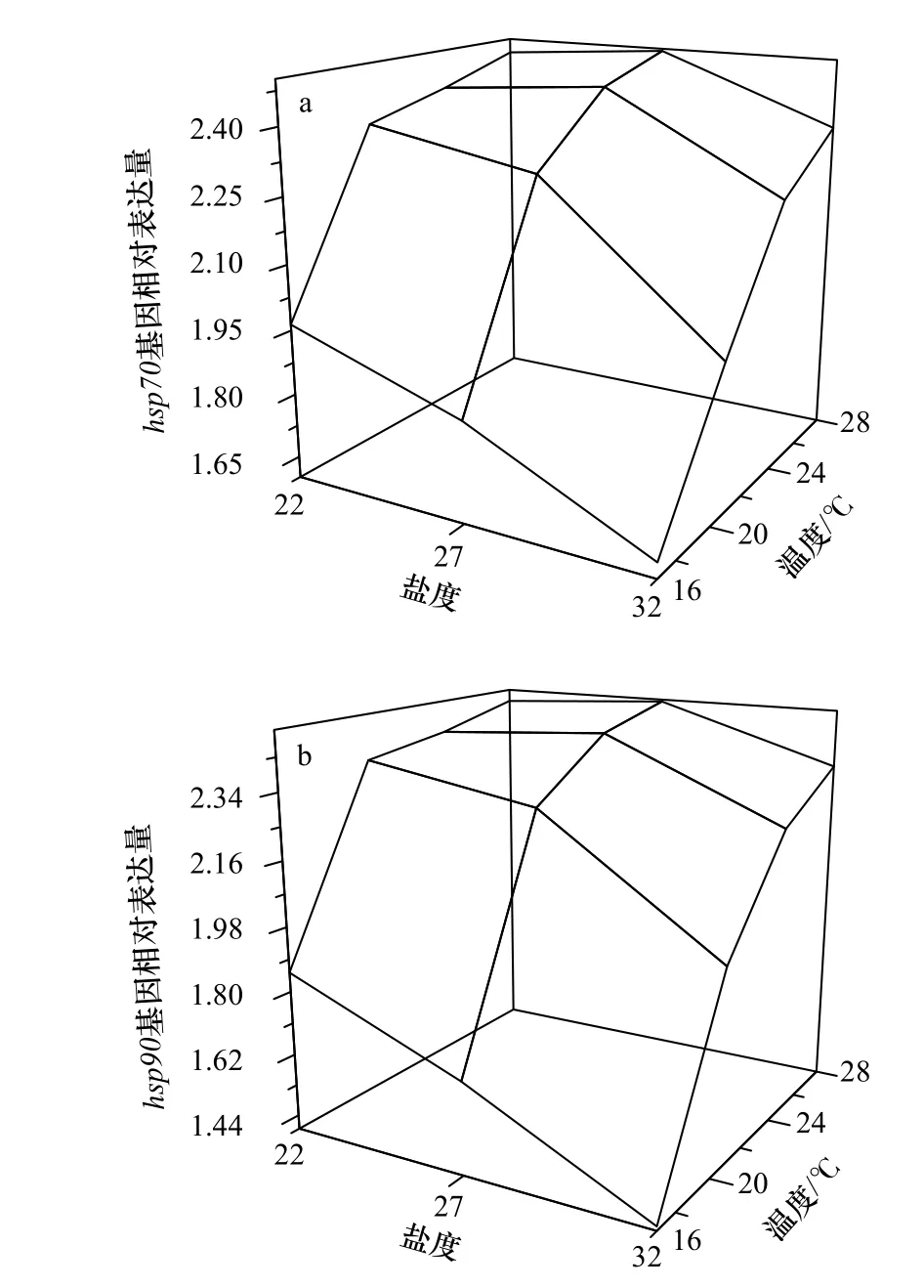
圖2 高溫和低鹽協同脅迫對刺參幼參hsp70(a)以及hsp90(b)表達的影響Fig.2 Effects of high temperature and low salinity collaborative stress on hsp70 (a) and hsp90 (b) expression of juvenile Apostichopus japonicus
刺參幼參hsp90基因的相對表達量見圖2b。從圖上可以看出,hsp90的表達趨勢與hsp70基本相同。即在同一鹽度下,hsp90相對表達量隨著馴化溫度的升高而上升;在同一溫度下,鹽度從32 下降到27 時,hsp90相對表達量上升,鹽度從27 下降到22 時,hsp90相對表達量或升或降。
4 討論
我國刺參的養殖方式主要有池塘養殖、圍堰養殖、工廠化養殖、底播養殖、吊籠養殖和網箱養殖,其中池塘養殖面積最大,主要集中在渤海和黃海的潮間帶地區[29-30]。這種室外池塘的水質條件易受天氣的影響,夏季高溫期的持續暴雨天氣會使大量淡水注入池塘,導致池塘海水鹽度在十幾個小時內從30 陡降至20 以下,而且這種高溫、低鹽的狀況在河口地區更為突出,并且會持續相當長一段時間[31],給刺參池塘養殖造成了巨大的損失。
刺參屬于一種溫帶和狹鹽生物,溫度、鹽度過低和過高對其生長和存活都有很大的影響。本研究的結果顯示,溫度為16℃和鹽度為32 時刺參幼參的體重以及特定生長率要明顯高于其他處理組(表2,圖1)。且隨著溫度的升高以及鹽度的降低,幼參的體重增加量減少,甚至在溫度為24℃、鹽度為22 以及溫度在28℃以下的鹽度27 和鹽度22 處理組,刺參幼參的體重下降。這說明,在高溫脅迫下,刺參幼參對低鹽脅迫的耐受能力降低。溫度和鹽度單因子脅迫對刺參生長影響的研究已有報道。Wang 等[22]研究表明,高溫脅迫下刺參的生長速率降低,原因主要有3 個:(1)高溫脅迫下攝食量較少;(2)高溫脅迫下耗氧率升高,呼吸耗能增加;(3)高溫脅迫下hsps合成以及發揮功能所產生的能量消耗高。趙斌等[32]對比5 個鹽度梯度(23、27、31、35 和39)下刺參的生長發現,生長率隨著鹽度的升高呈現先上升后下降的趨勢,并且在鹽度為31 時達到最大值。王欠欠等[33]研究進一步表明,低鹽度下刺參需要更多的能量來用于滲透壓調節,這是導致低鹽度下刺參負增長的一個重要的原因。本研究中,在高溫和低鹽的協同脅迫下,刺參幼參需要消耗更多的能量用于維持機體的正常機能,在外源能量攝入減少的前提下,體重下降成為一種必然結果。因此,在刺參池塘養殖過程中,高溫暴雨季節要采取有效措施調節海水鹽度,避免鹽度的大幅降低。此外,高溫季節池塘底部有機質、雜草等物質容易發酵,產生大量熱量,造成底熱。由于刺參屬于底棲生物,要及時打破這種底熱造成的養殖水體分層現象,促進上下層水體交換,避免造成更大的損失。
雖然隨著脅迫溫度的升高和脅迫鹽度的降低,幼參的體重呈下降趨勢。但是高溫脅迫下刺參幼參的誘導型熱休克蛋白基因的表達量要高于低溫脅迫組(圖2)。說明長期高溫脅迫能提高機體在急性熱脅迫下合成熱休克蛋白的能力,并保持高水平的表達量來防止蛋白變性和聚集[25,34-35]。長期環境脅迫對生物來說是一種馴化,而馴化溫度是影響生物耐熱性的關鍵環境因素之一[10,36]。生活在不同區域的同一生物對溫度的耐受程度不同,且生物體的致死溫度受到其前期所經歷環境溫度的很大影響[11,37]。俞丹等[38]通過比較不同水溫條件下馴化的尖頭鳉(Rhynchocypris oxycephalus)的熱耐受特征發現,尖頭鳉耐受的最大臨界溫度隨馴化溫度的升高而升高,說明尖頭鳉的熱耐受性明顯有賴于馴化溫度。此外,生物體會對長時間的溫度馴化產生適應機制,包括對環境因子變化的感知、將外界信號傳遞到細胞內以及細胞內分子伴侶的激活等[39]。作為重要的分子伴侶,當應對高溫脅迫時,機體通過誘導和表達熱休克蛋白來緩解熱脅迫帶來的損傷[17,34,40-41]。
hsp基因具有交叉耐受性,高溫脅迫誘導的hsp可以增加機體抵抗氨氮[42]、弧菌[28]、鹽度[27]等脅迫的能力。本研究中,在溫度為24℃和28℃時,鹽度為22 的處理組刺參幼參誘導型熱休克蛋白基因的表達量較鹽度為27 時低,但是差異并不顯著(圖2)。可能的原因是,經過長期高溫脅迫,刺參誘導熱休克蛋白表達的起始鹽度以及表達量達到峰值時的鹽度較低溫脅迫的個體降低。因此對其進行鹽度20 的脅迫,誘導熱休克蛋白基因的表達量尚未達到最大值。這與前人報道的實驗生物的誘導熱休克蛋白開始表達的最低溫度和達到峰值時的最高溫度以及誘導熱休克蛋白的最大表達量會隨著馴化溫度的升高而增加的研究結果相似[43-44]。但是,熱休克蛋白的表達是耗能的過程[45],高溫及低鹽條件下熱休克蛋白的表達量較高,需要消耗大量的能量,這也是在此條件下刺參生長緩慢的原因之一。
Wang 等[17]通過研究溫度和鹽度雙因子急性脅迫下刺參滲透壓和基因表達發現,鹽度變化后,相對于低溫處理組,高溫處理組刺參體腔液滲透壓變化速度更快,而且相較于鹽度因子,溫度因子對熱休克蛋白表達的影響更為顯著。本研究中,高溫和低鹽對特定生長率和誘導型熱休克蛋白基因表達量的交互作用均不顯著,并且鹽度對誘導型熱休克蛋白基因表達量也沒有顯著的影響(表3,表4)。這也說明高溫比低鹽對刺參幼參的影響更大。因此可以將高溫作為選擇壓力開展刺參新品系選育工作,選育的個體在獲得耐高溫特性的同時可能對低鹽也有一定的耐受能力。此外,刺參對溫度和鹽度的耐受性具有可塑性[26,46]。在高溫和低鹽條件下馴化的刺參幼參在遭受溫度30℃、鹽度20 的急性脅迫時,誘導型熱休克蛋白表達量具有相對較高的水平。這說明經過高溫和低鹽馴化,刺參幼參具有較強的耐高溫和耐低鹽的能力,并能夠增加在相應極端條件脅迫下的誘導型熱休克蛋白的合成,防止脅迫導致的蛋白質變性和聚集,從而維持機體的正常功能。
綜上所述,本研究通過分析長期高溫和低鹽協同脅迫下刺參幼參的生長以及誘導型熱休克蛋白基因表達量,發現相較低鹽,高溫對刺參幼參的影響更大。長期高溫、低鹽協同脅迫增加了刺參幼參誘導型hsp70和hsp90基因表達量,進而在一定程度上提高了刺參幼參應對高溫季節暴雨環境的能力。高溫期應該采取有效措施降低海水溫度,并防止養殖池塘底熱造成的養殖水體分層,避免損失。該研究豐富了刺參生理生態學理論,為刺參良種選育工作提供思路,為指導極端天氣下刺參生產實踐活動提供一定的理論依據。

