基于功能化介孔硅納米材料的miRNA超靈敏檢測
李晶晶,吳 丹,歐陽津,那 娜
(北京師范大學 放射性藥物重點實驗室,化學學院,北京 100875)
隨著納米技術的發展,其在生物檢測、臨床診斷中逐漸展示出巨大的應用前景。通過對納米材料進行合理的設計和合成,可將目前臨床上的診斷和治療兩個分離的過程或功能匯集于同一納米材料中,構成診療一體化納米平臺[1-4]。利用該平臺,可以實時、精確診斷病情并進行同步治療,還可在治療過程中,監控療效并隨時調整給藥方案,得到最佳治療效果,減少毒副作用[5-7]。這類納米材料由于具有良好的可修飾性和負載活性(或功能)物種的能力,非常有利于構筑納米診療一體化平臺,在精準醫學領域具有巨大的應用價值[8-11]。其中,介孔二氧化硅納米顆粒(MSN)憑借其可控的介孔結構、高的比表面積、良好的生物相容性和易化學修飾的優點[12-13],被認為是制備零提前釋放、靶向釋放和時空可控釋放藥物的最有前途的候選藥物。到目前為止,已經開發了大量基于MSN 的納米藥物系統,這些系統基于納米材料的合成,結合超分子組裝、聚合物多層膜包覆進行構建,并可以利用DNA 和蛋白質作為藥物釋放“守門人”。進入細胞內或體內后,基于氧化還原反應、pH 值或溫度的變化、酶催化、競爭性結合或光輻射等作用,刺激觸發藥物釋放[3,14-15],發揮治療作用。雖然這些釋放系統設計良好,但由于腫瘤細胞與周圍正常組織在溫度、pH值、化學成分、酶濃度等方面的差異不明顯,使得其在體外和體內的實際應用仍有很長的路要走[16-18]。因此,構建對特定的內源性刺激響應的有效藥物釋放系統,特別是對腫瘤組織中異常表達的生物分子的響應,仍然是人們關注的研究熱點之一。
核糖核酸(Ribonucleic acid,RNA)是遺傳信息與蛋白質之間的橋梁。經研究,目前多種RNA 分子都可以作為腫瘤標志物用于癌癥的早期診斷。作為RNA分子的一種,microRNA(miRNA)已經成為一種新型的癌癥特異性生物標志物。miRNA是較小(約22 bp)的高度保守非編碼RNA,在不同的細胞類型中進行內源性表達,可通過堿基互補配對的方式使基因沉默,從而起到基因表達關鍵調控因子的作用。與正常組織相比,腫瘤細胞表現出特異的miRNA表達譜,因而miRNA可以作為新的生物標志物指示不同的癌癥[13,19-20],為潛在的靶點治療提供新的可能性[21-22]。其中,基于擴增反應使納米材料在細胞內完成高效擴增,從而放大細胞內極低濃度RNA的響應信號,是腫瘤標志物高靈敏檢測的有效途徑之一。
本研究合成了一種基于適配體的發夾DNA 包封介孔二氧化硅納米材料,進行癌癥診療試劑遞送。二氧化硅納米材料的高比表面積及吸附性,使之可有效負載擴增檢測試劑及癌癥治療藥物,集miRNA擴增檢測及可控藥物釋放于一體進行疾病診療研究。該工作擴充了基于納米材料的疾病診療研究,為硅基納米材料的應用發展提供了數據支持。
1 實驗部分
1.1 試劑與材料
正硅酸乙酯(TEOS,Aldrich chemistry),十六烷基三甲基氯化銨(CTAC,國藥集團化學試劑有限公司),三乙醇胺(TEA,98%)、3-氨丙基三乙氧基硅烷(APTES,98%)(Alfa Aesar),水楊醛(99%,分子量122.12,山東西亞化學工業有限公司),氯化鎂(分析純,分子量95.21,北京化學試劑公司);阿霉素(Dox)、HG1(序列:5'-TCAGACTGATGTTCGTAGCTTATCAACA/iCy3dT/CAGTCTGATAAGCTATTTTT TTTGGTGGTGGTGGTTGTGGTGGTGGTGG-3')、HG2(序 列:5' -TTCGTAGCTTATCAGACTGA/iCy5dT/GTTGATAAGCTACGAACATCAGTTTTTTTTTGGTGGTGGTGGTTGTGGTGGTGGTGG-3')、miRNA-21(序列:5'-TAGCTTATCAGACTGATGTTGA-3')、TBE 緩沖劑(1×,17.05 g)均為上海生工生物工程股份有限公司產品。PBS緩沖溶液(0.01 mol/L,pH 7.2 ~7.4,Solarbio),瓊脂糖(Agarose B,BBI Life Sciences),4sgreen Plus 染色劑(BBI Life Sciences)。電泳所需試劑(25 ~500 bp DNA Marker、6×DNA Loading Buffer,寶生物工程大連有限公司),Tris 溶液:28 mmol/L Tris-HCl(含200 mmol/L KCl,4 mmol/L MgCl2,pH 7.4),乙醇(分析純,分子量46.07,天津市致遠化學試劑有限公司)。
實驗所用去離子水均由Milli-Q純水系統處理(18.0 MΩ·cm)。
1.2 儀器
FEI Talos F200S 透射式掃描電子顯微鏡(賽默飛世爾科技)、RF-6000 熒光光譜儀(島津公司)、SX2-2.5-10 箱式電阻爐(上海博訊實業有限公司醫療設備廠)、ChampGel5000 凝膠成像分析儀(北京賽智創業科技有限公司)、Mini-PROTEAN ? Electrophoresis Systems 凝膠電泳儀(美國Bio-Rad 公司)、BS124S 電子天平(北京塞多利斯儀器系統公司)、CRY-2102C 恒溫振蕩器(上海市百典儀器)、Zetasizer Nano ZS90 動態光散射(馬爾文帕納科有限公司)、DZF-6020 真空干燥箱(北京中科博達儀器科技有限公司)、TG16-WS臺式高速離心機(湖南湘儀實驗室儀器開發有限公司)、大龍實驗室手動單道可調式移液器(量程0 ~10 μL,20 ~200 μL,100 ~1 000 μL)、DF-101Z 集熱式恒溫加熱磁力攪拌器(鄭州特爾儀器設備有限公司)、Q-G1000/C6干式恒溫器(北京六一生物科技有限公司)、MTC-100恒溫混勻儀(杭州米毆儀器有限公司)、KQ-50DE數控超聲波清洗器(昆山市超聲儀器有限公司)。
1.3 介孔硅納米顆粒合成
在40 mL 去離子水中加入4 g CTAC 和0.16 g TEA 攪拌混合,升溫至95 ℃,并于95 ℃加熱1 h 后,加入1.5 mL TEOS,繼續攪拌混合1 h[23]。離心收集MSNs,用水、乙醇多次洗滌,真空干燥。550 ℃空氣煅燒5 h除去殘余的有機物CTAC,于乙醇中重分散,置于4 ℃冰箱儲存備用。
1.4 介孔硅納米顆粒表面氨基化
取20 mg的MSNs 分散于40 mL 乙醇中,超聲處理。加入40 μL APTES,室溫攪拌反應3 h。分別用乙醇和去離子水洗滌3 次,除去多余的反應物,加入500 μL 的Tris 緩沖液,混合均勻,于4 ℃儲存備用。
取少量洗滌后的介孔二氧化硅于離心管中,10 000 r/min 離心去除上清液,乙醇洗滌2 次,10 000 r/min 離心,留少量固體于管底。加入10 μL 水楊醛溶液,離心管底部沉淀變黃,證明介孔二氧化硅納米顆粒氨基化成功。
1.5 介孔硅納米顆粒載藥
取10 μL 氨基化介孔硅納米顆粒分散在含Dox 的PBS 溶液(2 mL,0.5 mg/mL)中,在黑暗條件下室溫攪拌24 h后,離心收集負載Dox的納米顆粒(Dox@MSNs)。用PBS溶液洗滌除去表面吸附的Dox殘留物,加入252 μL PBS緩沖液,混合均勻,待用。
1.6 介孔硅納米顆粒修飾DNA
將DNA 鏈在28 mmol/L Tris-HCl 溶液中于95 ℃加熱5 min,緩慢退火至室溫,使鏈完美形成DNA二級結構(含HG1 和HG2)。將84 μL 10 μmol/L 探針HG1 和84 μL 10 μmol/L 探針HG2 溶液與252 μL 載藥介孔硅納米顆粒于室溫渦旋攪拌30 min制備DNA納米復合物。混合物以15 000 r/min離心10 min,用PBS緩沖液多次洗滌以去除過量的DNA 探針。加入1 mL PBS緩沖液混合均勻,得到核酸-硅基納米復合物(Dox@MSNs-DNA)。
2 結果與討論
2.1 硅納米復合材料的設計
本研究中硅納米復合材料的合成思路是:首先,在介孔二氧化硅納米顆粒的孔隙內部載入腫瘤藥物Dox;同時,發夾G-四鏈體DNA(HG1、HG2(分別用熒光基團Cy3 和Cy5 標記))可在中性pH 值下通過靜電吸附作用,靈活吸附在APTES 修飾的單分散二氧化硅表面,對癌癥標志物miRNA 進行特異性響應。如圖1 所示,在沒有刺激的情況下,Cy3 和Cy5 熒光團與猝滅劑的距離很遠,不會發生熒光共振能量轉移(FRET),熒光信號很弱。同時,無目標識別響應觸發納米載體的孔隙解鎖,藥物傳遞系統處于鎖定狀態。納米載體在靶標miRNA-21刺激響應下,會啟動與HG1的雜交,解開HG1的發夾結構以產生單鏈尾,增加HG1在顆粒表面的移動性,促進其與HG2雜交。HG2與HG1雜交,引發發夾組裝,產生雙鏈G-四鏈體,形成更穩定、更剛性的雜化物,剛性雙鏈構象對納米組裝體的親和力降低,因此從表面解離。解離產物中的HG1、HG2分別修飾的熒光染料Cy3、Cy5 由于距離拉近激活了F?ster 共振能量轉移(FRET)信號,使得熒光信號放大,進一步指示靶標miRNA-21的表達。與此同時,靶標miRNA-21的釋放可成為下一次發夾組裝的引發物,并不斷循環擴增,以實現對腫瘤內痕量靶標miRNA-21的靈敏檢測。值得提出的是,該類硅基納米材料具有良好的生物安全性,其進入體內完成使命后會水解,水解產物的主要成分為硅酸,可通過尿液排出體外,因而在生物活體檢測中具有很大優勢。
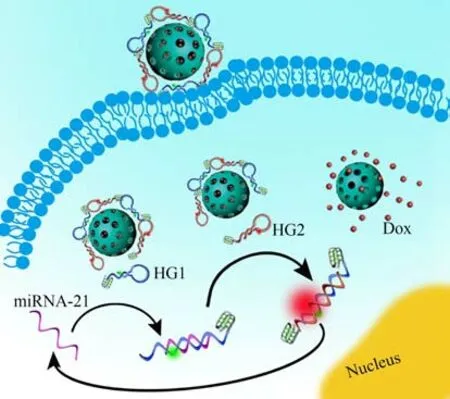
圖1 Dox@MSNs-DNA納米材料用于miRNA-21響應的藥物控釋示意圖Fig.1 Schematic diagram of Dox@MSNs-DNA nanoparticals for controlled drug release in response to miRNA-21
2.2 硅納米復合材料的合成與表征
MSNs的透射電子顯微鏡(TEM)結果如圖2A、B所示。由圖可見,所得到的MSNs大小相似且均勻,平均直徑約為55 nm,有明顯介孔存在。同時,動態光散射(DLS)表征也進一步驗證了單分散MSNs 的大小(圖2C)。用Zeta 電位分析了DNA 修飾的MSNs的組裝過程。中間產物MSNs-NH2納米配合物具有正的ζ電位(圖2D),作為生物門的核酸吸附在MSNs-NH2上后,核酸修飾的MSNs(MSNs-DNA)顯示出5.6 mV 的ζ電位,相比MSNs-NH2降低。這種降低是由于在修飾過程中,MSNs-NH2吸附的核酸上有大量的負磷酸基團。DLS也進一步驗證了DNA修飾的MSNs成功組裝。
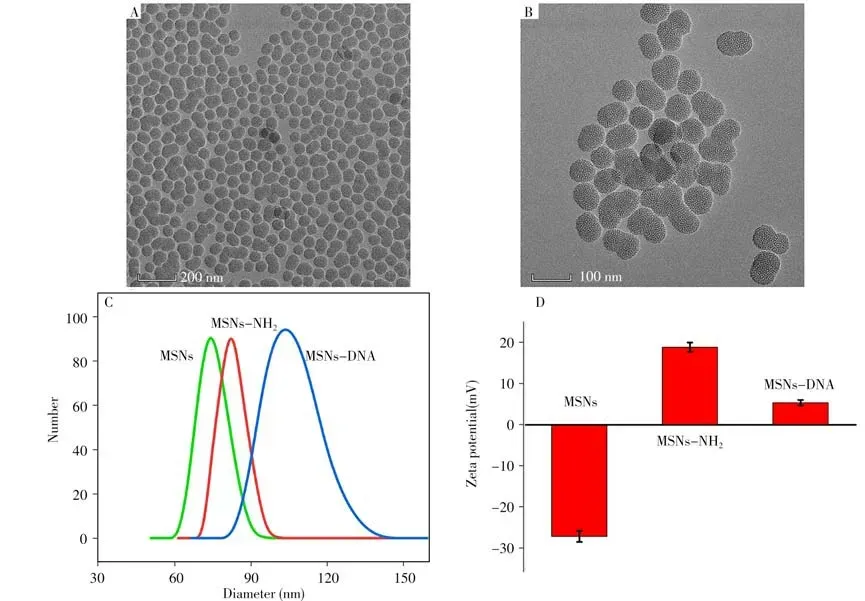
圖2 MSNs的TEM圖像(A、B),及MSNs、MSNs-NH2、MSNs-DNA的DLS(C)與Zeta電勢(D)Fig.2 TEM images of MSNs(A,B),DLS data(C)and Zeta potentials(D)of MSNs,MSNs-NH2 and MSNs-DNA
2.3 瓊脂糖凝膠電泳
通過聚丙烯酰胺凝膠電泳驗證了miRNA-21 觸發釋放的機制(圖3)。未加入靶標miRNA-21 時,HG1與HG2的雜交產物較少,添加5 nmol/L 靶標后,觀察到較慢的遷移速率,這是由于miRNA-21與DNA 雜交形成了22 個堿基對。表明在靶標的參與下,HG1、HG2 能更有效地進行發夾組裝,實現對miRNA-21的高效循環擴增。
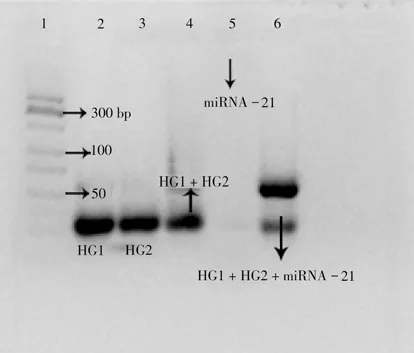
圖3 瓊脂糖凝膠電泳圖像Fig.3 Agarose gel electrophoresis images
2.4 體外FRET效應
基于FRET的設計以及熒光供體和受體的激活,循環擴增的納米傳感器策略在體外檢測miRNA-21靶標時表現出特殊的熒光響應。如圖4 所示,隨著靶標miRNA-21 濃度的增高,HG1 鏈上修飾的Cy3染料于566 nm 處的熒光逐漸減弱,而HG2 鏈上修飾的Cy5 染料于668 nm 處的熒光逐漸增強,表明Cy3供體和Cy5受體之間存在有效的能量共振轉移,體現了該方法對細胞內miRNA熒光激活成像的可行性。在0 ~30 nmol/L miRNA-21 濃度范圍內,Cy5、Cy3 分別在668 nm 和566 nm 處的熒光響應比值(y)與miRNA-21 濃度的對數(x)呈線性關系,線性方程為y=0.064 4x+0.087,r2=0.989 1,檢出限(S/N=3)為0.04 nmol/L,與DNA雜交的動力學一致[24]。

圖4 不同濃度miRNA-21檢測的熒光光譜Fig.4 Fluorescence spectra of miRNA-21 detected at different concentrations
2.5 靶標特異性驗證
由于高滲透長滯留效應(EPR)的存在,使得納米材料在進入細胞時更容易滯留在腫瘤部位。為進一步提高腫瘤靶向性,本研究在納米材料上修飾靶向腫瘤的適配體,以使納米材料有更好的靶向效果。為了評估該循環擴增的納米傳感器的選擇性,考察了在反應體系中不加入靶標、加入靶標miRNA-21、加入非靶標miRNA-29、miRNA-155、miRNA-199 及靶標單堿基錯配和三堿基錯配后的熒光強度,結果如圖5A 所示。添加各種分析物后,Cy5 與Cy3 的熒光強度之比如圖5B 所示。由圖可見,加入靶標miRNA-21 后顯示出較強的熒光共振轉移,Cy5 染料的峰明顯增強,而加入其他非靶標物質,Cy5 與Cy3 的熒光強度之比較低,表明該熒光策略對靶標miRNA-21的檢測具有良好的特異性。
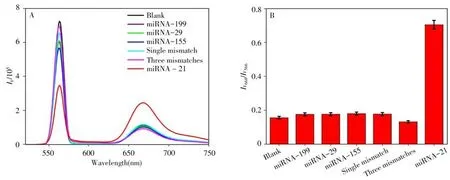
圖5 Dox@MSNs-DNA對不同靶標的響應熒光光譜圖(A)及柱狀對比圖(B)Fig.5 Fluorescence spectra of Dox@MSNs-DNA sensor for different targets(A)and histogram comparison(B)
2.6 Dox@MSNs- DNA的藥物釋放
考察了Dox@MSNs-DNA 作為體外藥物控釋系統的能力。向1 mL Dox@MSNs-DNA 復合材料體系中加入5 μL的1 μmol/L 靶標miRNA-21溶液,使miRNA-21的終濃度為5 nmol/L。以熒光光譜儀檢測實時釋放行為(圖6A)。發現在480 nm激發波長下,藥物Dox于596 nm處發射出熒光,熒光強度與時間的關系如圖6B 所示。可觀察到未加入靶標的前兩小時上清液中Dox 的熒光強度幾乎不變,加入靶標后,熒光逐漸增強,表明藥物被逐漸釋放。實驗現象表明,隨著靶標與介孔硅納米外層封裝DNA的不斷雜交,封裝的藥物可進行有效地控制釋放。一段時間后,藥物釋放的熒光減弱,可能是從介孔中釋放的藥物進入了雜交DNA 的四鏈體部位,從而使得上清液中檢測到的Dox 的濃度下降。結果表明,miRNA在孔打開和誘導藥物可控釋放中起關鍵作用。
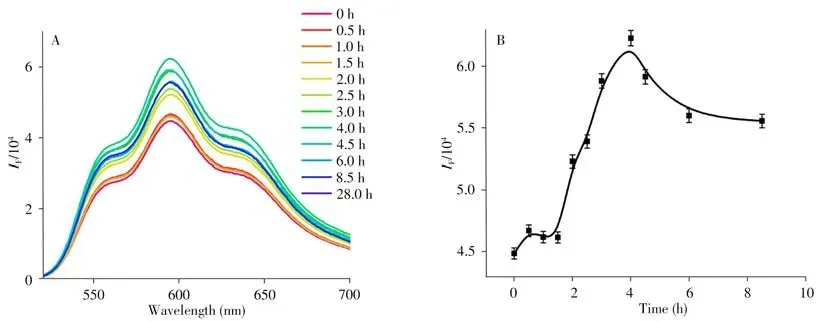
圖6 Dox@MSNs-DNA在不同時間釋藥的熒光光譜(A)及隨時間的釋藥曲線(B)Fig.6 Fluorescence spectra of Dox@MSNs-DNA at different drug release times(A)and drug release curve over time(B)
3 結 論
本研究設計并制備了一種新型的單分散Dox@MSNs-DNA,用于腫瘤標志物的高靈敏檢測及其觸發的藥物按需釋放。該載藥系統以介孔二氧化硅納米顆粒為生物活性分子的載體,在介孔中裝載藥物的同時對材料表面進行DNA 功能化。在腫瘤標記物miRNA-21 的刺激下,兩條鏈上的熒光團由于距離的拉近激活FRET 信號,產生熒光信號放大,從而實現了對miRNA-21的超靈敏熒光激活成像。材料表面功能化的DNA 作為防止Dox 釋放的DNA 門,使該藥物傳遞系統具有更準確的釋放性能。此外,基于對材料的改性和修飾,該硅基納米材料還可以對其他藥物進行輸送和生物靶向可控釋放,為隨需應變給藥系統的發展開辟了新的前景,在癌癥治療方面具有巨大的潛力。

