幽門螺桿菌Tipα對胃癌細胞順鉑敏感性的影響*
唐軍梅,張啟芳,何思明,陳勇昌,蔡 莉
(廣西壯族自治區南溪山醫院消化內科,廣西桂林 541002)
幽門螺桿菌是一種革蘭陰性螺旋形細菌,定植于人胃中,被認為是慢性胃炎、潰瘍和胃癌的病原體,全世界有一半以上的人感染幽門螺桿菌[1-2]。腫瘤壞死因子-α誘導蛋白(tumor necrosis factor-α-inducing protein,Tipα)是幽門螺桿菌的一種致病蛋白,已發現該蛋白是促炎性細胞因子和趨化因子基因表達的有效誘導劑,與胃癌發生、發展相關[3]。胃癌是全球最常見的癌癥之一,發生率在東亞,東歐和南美最高[4]。胃癌的主要治療方式為手術,但在晚期轉移胃癌或因瘤徑過大而不可切除階段以順鉑為主的化療是轉移性癌癥患者最有效的治療方法[5]。然而,化療抵抗仍是部分胃癌患者治療的重要問題,相關機制尚未完全闡明。磷酸肌醇-3激酶(phosphoinositide 3-kinase,PI3K)是一種脂質激酶,可傳遞細胞內信號級聯并調節多種細胞過程,蛋白激酶B(protein kinase B,Akt)是PI3K信號的重要下游效應物,可調節多種途徑,包括抑制細胞凋亡、刺激細胞生長和調節細胞代謝等[6]。PI3K/Akt途徑是人類癌癥中異常激活頻率最高的信號通路[7]。此外,該通路還與癌癥耐藥性相關,已被證明在順鉑耐藥性胃癌細胞中發揮著積極作用,是治療胃癌順鉑耐藥性的關鍵靶點[8]。本研究通過原核表達及純化獲得重組Tipα,觀察Tipα對胃癌細胞順鉑耐藥性的影響,并基于PI3K/Akt信號通路探究其作用機制,現報道如下。
1 材料與方法
1.1 材料
根據美國國家生物信息中心幽門螺桿菌Tipα編碼序列(登錄號:NZ_LMXS01000175.1)由成都擎科梓熙生物科技有限公司合成片段并構成重組質粒pET-30a(+)-Tipα,BL21(DE3)pLysS大腸桿菌感受態細胞(貨號:CB106)購自北京天根生化科技有限公司;胃癌SGC-7901細胞系(貨號:CL-0206)購自武漢普諾賽生命科技有限公司;杜氏改良Eagle培養基(Dulbecco′s modified Eagle medium,DMEM)高糖培養基(貨號:SH30022)、胎牛血清(貨號:SH30084.03)均購自美國Hyclone公司;青鏈霉素雙抗(貨號:15240062)購自美國Gibico公司;LY294002購自美國Medchemexpress公司,CCK8檢測試劑盒(貨號:CK04)購自日本東仁公司,Annexin V-APC/PI凋亡檢測試劑盒(貨號:70-AP107-60)購自杭州聯科生物技術股份有限公司;Transwell小室購自美國Corning Costar公司,異丙基-β-D-硫代半乳糖苷(貨號:I8070)、RIPA裂解液(貨號:R0010)、化學發光顯影試劑盒(貨號:PE0010)、蛋白定量試劑盒(貨號:PC0020)均購自北京索萊寶科技有限公司;NI-NTA Superflow(貨號:30410)購自德國QIAGEN公司,內毒素高效去除純化樹脂(貨號:20518ES10)購自上海翊圣生物科技有限公;抗PI3K(貨號:ab191606)一抗、p-PI3K(貨號:ab182651)一抗、Akt(貨號:ab8805)一抗、p-Akt(貨號:81283)一抗、β-actin(貨號:ab8227)一抗、6×His Tag單克隆抗體(ab18184)、辣根過氧化物酶標記的二抗(ab205718)均購自英國Abcam公司。
1.2 方法
1.2.1Tipα表達與純化
取100 μL BL21 (DE3)pLysS感受態細胞與1 ng pET-30a(+)-Tipα重組質粒混合,在冰上靜置30 min,42 ℃熱激60 s,插入冰上靜置2 min,加入不含卡那霉素 LB液體培養基900 μL,37 ℃、150 r/min搖菌60 min,隨后將菌液均勻涂布至含有卡那霉素LB固體培養基上,倒置放入37 ℃恒溫培養箱培養12 h。隨后挑取陽性菌落接種于2 mL含卡那霉素LB液體培養基內,37 ℃、150 r/min搖菌12 h,隨后加入1 mmol/L異丙基-β-D-硫代半乳糖苷,30 ℃培養4 h誘導蛋白表達,然后4 ℃、8 000 r/ min離心5 min收集沉淀,用磷酸鹽緩沖液(phosphate buffer solution,PBS)洗滌后通過超聲破碎菌體獲得蛋白。4 ℃、12 000 r/ min離心10 min,取上清液,過NI-NTA柱純化蛋白并去除內毒素,采用十二烷基硫酸鈉-聚丙稀酰胺(twelve alkyl sodium sulfate-polyacrylamide,SDS-PAGE)法鑒定重組Tipα蛋白。
1.2.2細胞培養
將胃癌SGC-7901細胞培養于含10%胎牛血清、1%青鏈霉素雙抗DMEM高糖培養基中,并放置于37 ℃、5%二氧化碳、95%空氣的細胞培養箱中,2~3 d換液,細胞長至90%融合時進行傳代。空白對照組為正常培養細胞,順鉑組在培養基中添加0.8 ng/L順鉑,Tipα聯合順鉑組在培養基中加入0.8 ng/L順鉑和100 ng/L Tipα,LY294002聯合Tipα和順鉑組則先用30 μmol/L LY294002預處理2 h再加入0.8 ng/L順鉑和100 ng/L Tipα。各組均培養48 h后收集細胞待測。
1.2.3CCK8試驗
將細胞以5×103個/孔接種于96孔板中,按上述分組策略分別培養48 h后每個孔中分別加入10 μL CCK-8溶液,輕輕混勻,再在37 ℃、5%二氧化碳、95%空氣的細胞培養箱中培養3 h。采用MK3酶標儀(美國Fisher Thermo公司)檢測450 nm處的光密度(A)值。
1.2.4流式細胞術
胰酶消化各組細胞得到細胞懸浮液,調整為1×105/mL,用PBS洗滌后添加500 μL膜聯蛋白結合緩沖液重懸細胞,再分別加入5 μL Annexin V-APC和5 μL PI染液,4 ℃、避光孵育20 min。采用FACSCalibur流式細胞儀(美國Becton公司)檢測細胞凋亡率。
1.2.5Transwell試驗
用Matrigel基質膠包被Transwell小室,置于37 ℃孵育4 h,放入24孔板中。胰酶消化各組細胞得到細胞懸浮液,調整為1×106/mL,在Transwell小室中在按200 μL/孔接種細胞,在24孔板中加入500 μL含10%胎牛血清的DMEM培養基,然后37 ℃、5%二氧化碳培養15 h。培養完成后用棉簽輕輕將小室底部膜表面的細胞和基底膜擦除,取出Transwell小室,用PBS洗滌細胞,甲醇固定30 min,采用0.1%結晶紫800 μL染色20 min,用PBS洗滌,晾干后于顯微鏡下進行觀察并拍照統計。
1.2.6Western blot
采用RIPA裂解液提取細胞總蛋白并進行蛋白定量檢測。采用10%SDS-PAGE分離蛋白,轉移至聚偏二氟乙烯膜上。聚偏二氟乙烯膜用5%脫脂牛奶封閉1 h,然后與抗PI3K、p-PI3K、Akt、p-Akt、β-actin一抗在4 ℃下孵育過夜,再同二抗于室溫下孵育1 h。采用化學發光試劑盒時條帶顯影并在5200化學發光凝膠成像儀(上海天能科技有限公司)觀察條帶,利用ImageJ軟件(美國NIH公司)統計條帶灰度,根據β-actin灰度作均一化處理。
1.3 統計學處理
2 結 果
2.1 Tipα的純化鑒定
在相對分子質量26×103(標簽蛋白部分為3×103,Tipα為23×103)處有一明顯蛋白條帶。見圖1。

M:蛋白Marker;1:BL21/pET30a-Tipα總蛋白;2:純化后的重組Tipα。圖1 重組Tipα蛋白的純化電泳圖
2.2 Tipα抑制順鉑對胃癌細胞的細胞毒性
與空白對照組比較,順鉑組胃癌細胞活性明顯降低,細胞凋亡率明顯升高,Tipα干預逆轉順鉑對胃癌細胞活性的抑制作用,明顯降低了順鉑誘導的細胞凋亡,差異均有統計學意義(P<0.05)。見圖2。

A:Tipα對順鉑處理的胃癌細胞活性的影響;B:Tipα對順鉑處理的胃癌細胞凋亡的影響;a:P<0.05;b:P<0.05。圖2 Tipα抑制順鉑對胃癌細胞的細胞毒性
2.3 Tipα逆轉順鉑對胃癌細胞侵襲的抑制作用
與空白對照組比較,順鉑組侵襲細胞個數明顯降低,Tipα干預明顯降低了順鉑對胃癌細胞侵襲能力的抑制作用,差異均有統計學意義(P<0.05)。見圖3。

a:P<0.05,b:P<0.05。圖3 Tipα逆轉順鉑對胃癌細胞侵襲的抑制作用
2.4 Tipα處理激活胃癌細胞PI3K/Akt通路
順鉑組胃癌細胞PI3K、Akt總蛋白表達水平與空白對照組比較,差異均無統計學意義(P>0.05);p-PI3K/PI3K、p-Akt/Akt比值均明顯低于空白對照組,差異均有統計學意義(P<0.05)。Tipα聯合順鉑組胃癌細胞PI3K、Akt總蛋白表達水平與順鉑組比較,差異均無統計學意義(P>0.05);p-PI3K/PI3K、p-Akt/Akt比值明顯高于順鉑組,差異均有統計學意義(P<0.05)。見圖4。
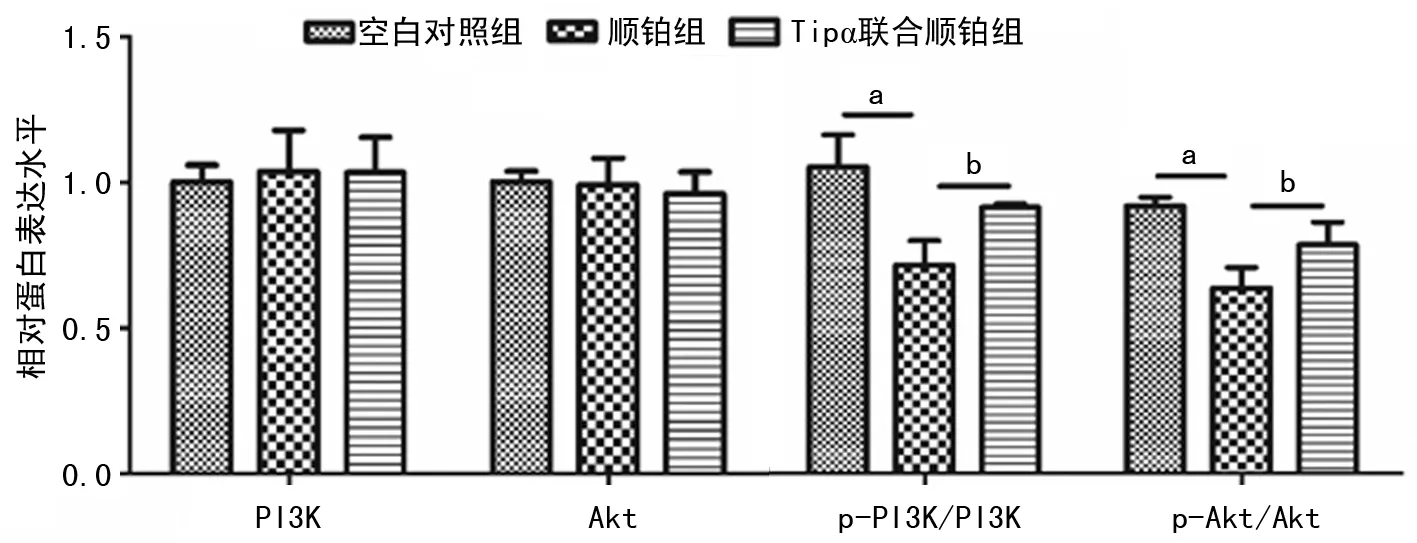
a:P<0.05,b:P<0.05。圖4 Tipα處理激活胃癌細胞PI3K/Akt通路
2.5 LY294002部分抵消Tipα對胃癌細胞順鉑毒性的抑制作用
與Tipα和順鉑組比較,LY294002聯合Tipα和順鉑組胃癌細胞活性明顯降低,細胞凋亡率明顯升高,差異均有統計學意義(P<0.05)。見圖5。

A:LY294002干預對Tipα促進順鉑處理的胃癌細胞存活的影響;B:LY294002干預對Tipα抑制順鉑處理胃癌細胞凋亡的影響。a:P<0.05,b:P<0.05。圖5 LY294002部分抵消Tipα對胃癌細胞順鉑毒性的抑制作用
2.6 LY294002部分抵消了Tipα促進順鉑誘導的胃癌細胞侵襲作用
與Tipα聯合順鉑組比較,LY294002聯合Tipα和順鉑組胃癌細胞侵襲能力明顯降低,差異有統計學意義(P<0.05)。見圖6。
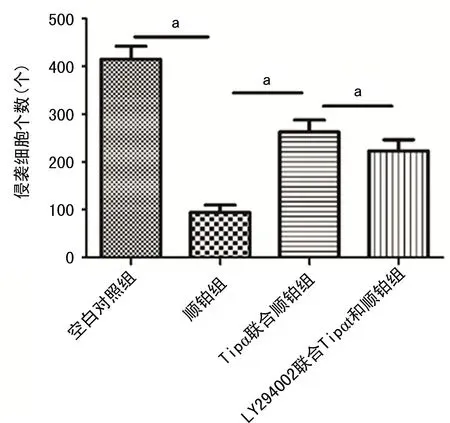
a:P<0.05。圖6 LY294002部分抵消Tipα促進順鉑誘導的胃癌細胞侵襲作用
3 討 論
以順鉑為基礎的化療是晚期轉移性癌癥患者輔助治療及手術切除后抑制復發最有效的方法之一,然而,耐藥性是阻礙化療療效的主要因素,嚴重威脅癌癥患者的預后。目前,順鉑耐藥的機制尚未完全闡明,本研究探討了幽門螺桿菌Tipα對胃癌細胞順鉑敏感性的影響,結果顯示,Tipα處理后胃癌細胞對順鉑的敏感性降低,PI3K/Akt信號通路被活化。
Tipα是一種幽門螺桿菌毒力蛋白,多以二聚體形式發揮功能,通過與細胞表面核仁蛋白直接結合而進入細胞中,誘導腫瘤壞死因子-α和趨化因子基因的表達,并激活核因子κB介導的炎癥信號通路,發揮促炎作用[9-10]。 肖玲巧等[11]通過體外表達Tipα并處理巨噬細胞發現,Tipα通過激活人NOD樣受體家族蛋白3(NLPR3)炎性小體促進巨噬細胞凋亡。CHEN等[12]發現,Tipα通過激活白細胞介素-6/轉錄激活子3信號通路促進胃癌細胞上皮-間質轉化。DEVANAND等[1]發現,B淋巴細胞易位基因2能抑制胃癌細胞膜表面核仁蛋白表達,從而抑制Tipα對腫瘤壞死因子-α等的誘導作用而發揮抑癌作用。本研究結果顯示,Tipα能逆轉順鉑對胃癌細胞活性和侵襲能力的抑制作用,以及對胃癌細胞凋亡的促進作用。提示Tipα不僅能促進胃癌細胞上皮-間質轉化,還能降低胃癌細胞對順鉑的敏感性,對胃癌患者的治療產生不利影響。
PI3K/Akt信號通路是重要的信號傳導途徑,具有多種生物學功能,包括調控細胞生長、存活、分化及葡萄糖轉運和代謝[13]。近年來,PI3K/Akt信號通路對促進腫瘤發生、發展及化療抗性的作用被廣泛報道[14-15]。DU等[16]發現,芒果苷能通過阻斷PI3K/Akt信號通路的活化抑制胃癌細胞活性并促進細胞凋亡。LU等[17]通過抑制PI3K/Akt信號通路糾正了胃癌細胞的順鉑耐藥性。本研究發現,Tipα促進了PI3K/Akt信號通路的激活,而利用PI3K/Akt信號通路抑制劑——LY294002處理后能部分消除Tipα對胃癌細胞順鉑敏感性的抑制作用,說明PI3K/Akt信號通路的活化參與了Tipα對胃癌細胞順鉑敏感性的抑制過程,阻斷PI3K/Akt信號通路的活化可能是治療Tipα相關胃癌耐藥的潛在手段。
綜上所述,本研究通過原核表達方式在體外表達重組Tipα發現,其能通過增加順鉑處理的胃癌細胞活性,抑制順鉑處理的胃癌細胞凋亡,并促進順鉑處理的胃癌細胞侵襲,其機制可能與PI3K/Akt信號通路活化有關。

