降鈣素基因相關肽對高氧肺損傷的Notch通路調控*
鄧 健,王少華
(廣東省深圳市福田區婦幼保健院兒科 518045)
氧療是臨床常用手段,但當早產兒肺組織長時間接受高氧時反而會引起高氧肺損傷,對其預后造成不同程度的影響[1]。降鈣素基因相關肽(calcitonin gene-related peptide,CGRP) 為一類主要由感覺神經釋放的生物活性神經肽類物質[2]。Notch通路是一條參與體內多種器官和組織調控的信號通路[3]。近年來,相關研究表明,CGRP和Notch通路均參與了肺損傷修復重建過程[4-5]。然而,對CGRP是否通過Notch通路調控高氧肺損傷的修復,目前國內相關研究仍較匱乏。本研究以SD早產鼠及其肺組織作為研究對象,通過比較在高氧暴露的不同時間點使用CGRP及其拮抗劑、Notch信號通路阻斷劑干預后肺組織的病理改變,以及其中Notch信號的Notch l、Hes、heRP mRNA表達情況,以探討CGRP是否通過調控Notch通路對肺組織發揮效應,從而為高氧肺損傷的防治提供參考。
1 材料與方法
1.1 材料
1.1.1實驗動物及分組
每天下午將健康SD成年雄鼠和雌鼠(由深圳市拓普生物科技有限公司實驗室購置)按1∶1比例合籠交配,次日清晨檢查到雌鼠陰道涂片顯示精子者定義為妊娠第0天。雌鼠妊娠第19天用乙醚麻醉后剖宮產取出胎仔作為研究對象。將胎齡19 d的SD早產鼠分為空氣組(A組)、高氧組(B組)、高氧聯合CGRP組(C組)、高氧和CGRP聯合CGRP8-37組(D組)及高氧和CGRP聯合MW167組(E組),每組至少18只,依次編為A~E組。CGRP8-37為CGRP拮抗劑,MW167為Notch信號通路阻斷劑。
1.1.2主要試劑與儀器
主要試劑與儀器為CGRP(ANASPEC)、CGRP8-37 (Wurogentec)、MW167(millipore)、Notch-1 (ABclonal)、heRP(Biobyt)、Hes(Santa)、反轉錄試劑盒(全式金)、蘇木精-伊紅染色(hematoxylin eosin,HE)染色液(Servicebio)、熒光倒置顯微鏡(Mshot)等。
1.2 方法
1.2.1制備動物模型
參照梁木林等[6]介紹的方法制備高氧動物模型。同時對各組早產鼠腹腔注射干預試劑,A、B組均為生理鹽水,C~E組分別為CGRP、CGRP聯合CGRP8-37、CGRP聯合MW167。注射完畢后約1 h將早產鼠給近期正常分娩的母鼠哺乳。除A組外,B~E組代乳鼠和未成熟鼠均放置在95%高氧容器中,定時添增水和飼料,持續14 d 。
1.2.2肺組織標本制備及病理檢查
哺乳期第3、7、14 天每組處死6只早產鼠并取出肺組織保存于-80 ℃液氮快速冷凍。常規切片、HE染色,光鏡下觀察肺組織病理改變。采用BAUMAN等[7]介紹的肺組織損傷評分法評估其病理改變。
1.2.3定量實時聚合酶鏈反應(Q-PCR)法檢測肺組織 Notch 1、Hes、heRP mRNA表達水平
提取總RNA逆轉錄合成cDNA進行擴增。反應條件:95 ℃預變性3 min,95 ℃變性10 s,60 ℃退火延伸34 s,共40個循環。
1.3 統計學處理
2 結 果
2.1 肺組織病理改變
A組早產鼠肺組織氣管、血管正常。B、D、E組早產鼠第3天可見炎癥細胞浸潤;第7天可見肺泡上皮細胞腫脹,間質水腫;第14天氣管、血管廣泛破壞,管壁增厚。C組早產鼠第3天大致正常,第7天肺泡間隔少許斷裂,第14天肺泡融合,肺泡內充滿滲出液,見圖1。
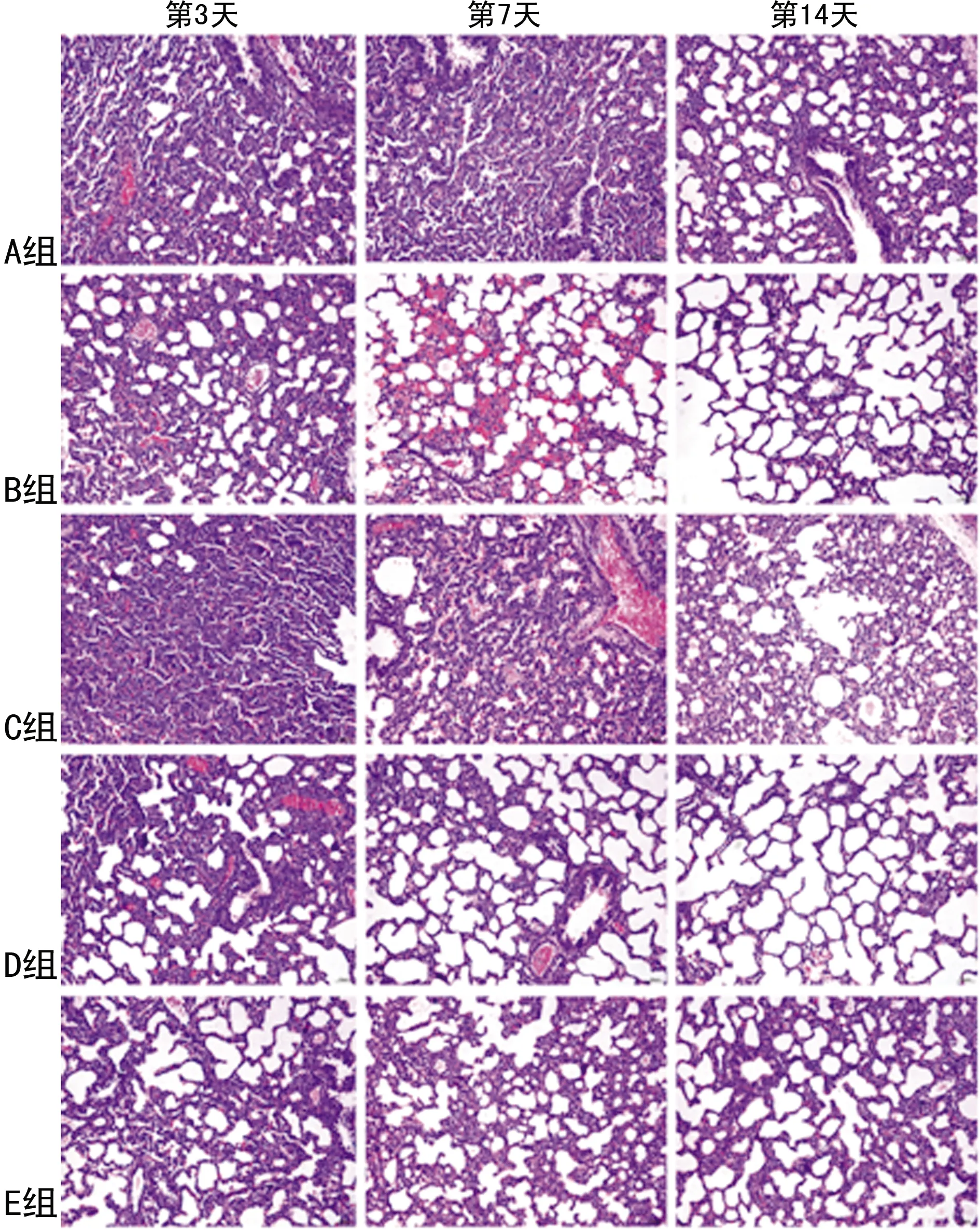
圖1 各組早產鼠不同時間點肺組織病理改變比較(HE染色,200×)
2.2 肺損傷病理評分
C組早產鼠第3、7、14天肺損傷病理評分均低于B、D、E組,差異均有統計學意義(P<0.05),見表1。

表1 各組早產鼠不同時間點肺損傷病理評分比較分)
2.3 肺組織Notch 1、Hes、heRP mRNA表達水平
C組早產鼠第3、7、14天Notch 1、Hes、heRP mRNA表達水平均明顯高于B、D、E組,差異均有統計學意義(P<0.05),見表2。

表2 各組早產鼠不同時間點肺組織Notch 1、Hes、heRP mRNA表達水平比較
3 討 論
CGRP由37 個氨基酸組成,是人類用分子生物學方法發現的第1個活性多肽,廣泛分布于神經系統、呼吸系統、循環系統等,生物半衰期約為18 min[8]。近年來,有研究表明,人和鼠肺泡Ⅱ型上皮細胞(typealⅡ veolarepithelial cell,AECⅡ)膜上也發現了CGRP特異性受體及結合位點,并在胚胎肺的發育和肺生理、病理過程均發揮了重要作用[9]。當不成熟肺受到氧化應激后CGRP通過免疫調節加快清除自由基,減少合成及釋放炎癥因子,并促進水通道蛋白過表達而減輕肺水腫,從而對機體起到抗炎、抗氧化損傷等作用。此外,在氧化應激的條件下AECⅡ增殖受到抑制,而CGRP可減弱該抑制作用,促進細胞轉化為AECⅡ,減少功能細胞凋亡并改善其存活,可能是CGRP促進高氧肺損傷修復的關鍵[10]。
Notch通路是一條進化上高度保守的信號通路[11]。Notch信號可介導轉錄因子的表達,由此實現調控肺泡上皮細胞和血管內皮細胞的生物學活動,如分化、增殖、凋亡等[12-13]。因此,Notch信號通路在肺的發育、損傷及修復過程中發揮著十分重要的作用。Notch信號包括Notch受體、配體、細胞內效應分子蛋白和調節分子等[14]。目前,在哺乳動物中發現的Notch受體有4種(Notch 1~4) ,均廣泛分布于肺組織中。氣道上皮細胞主要表達Notch 1、4,肺泡上皮、肺間質、血管內皮及成纖維細胞主要表達Notch 2、3。Notch 1與配體結合可啟動靶基因Hes、Su(H)轉錄,促進AECⅡ增殖。在氧化應激條件下血管內皮細胞、氣道和肺泡上皮細胞Notch 1活性下降,表達減少,AECⅡ轉化為AECⅠ,最終影響肺發育和肺損傷修復[15]。
本研究結果顯示,早產鼠在高氧暴露后肺組織結構破壞,炎性滲出,間質水腫,成纖維細胞增生,與此同時,Notch l及其下游靶基因Hes、heRP mRNA表達均下降。給予外源性CGRP干預后早產鼠肺組織病理損傷程度明顯減輕,Notch信號上升。當分別加入CGRP受體拮抗劑——CGRP8-37和Notch信號通路抑制劑——MW167時肺損傷程度加重,Notch信號下降。由此可見,CGRP可能通過促進Notch通路中Notch 1、Hes、heRP等生物信號的表達,從而對氧化應激性損傷的肺發揮保護效應。今后應從信號傳導通路方面闡釋CGRP如何實現Notch信號下游靶分子的調控,可能對高氧肺損傷的預防和治療產生深遠意義。

