高寒草地灌叢化對土壤團聚體生態化學計量學及酶活性的影響
馬文明,劉超文,周青平,鄧增卓瑪,唐思洪,迪力亞爾·莫合塔爾,侯晨
(西南民族大學青藏高原研究院,四川 成都 610041)
灌叢化(shrub encroachment)是全球草地生態系統重要的生態現象之一,是影響草地碳庫的重要過程[1],近十年間我國青藏高原已有39%的高寒草地發生灌叢化[2]。青藏高原高寒草地是我國重要的碳匯區,據估算表層土壤(0~0.75 m)中儲存有33.5 Pg(1 Pg=1015g)的有機碳[3]。而表層土壤中約90%的有機碳儲存于團聚體內[4],其對底物有機碳和微生物的保護與阻隔作用可減少有機碳、氮的分解,從而在碳、氮循環和減緩土壤溫室氣體排放中發揮重要作用[4]。植物凋落物、根系及根系分泌物等有機質的輸入是影響團聚體形成、穩定及生源物質分布的重要因素。研究表明,草本植物和灌木的根系活力、分泌物成分以及有機質的輸入差異可影響土壤微生物活性和有機質的分解,導致土壤團聚體組成及各粒徑團聚體內養分含量發生變化,進而改變生物地球化學循環進程[5—6]。
土壤生態化學計量比是研究生物系統能量平衡和土壤元素(碳、氮、磷)平衡的重要指標,植被生物體中的養分含量取決于土壤養分供應和植被養分需求間的動態平衡,該指標可反映植被受養分需求量和土壤養分供應的約束,對揭示元素相互作用與制約變化規律具有重要意義[7]。土壤生態化學計量比易受植被類型和土地利用方式的影響,李丹維等[7]對太白山不同海拔土壤碳、氮、磷含量及生態化學計量特征的研究結果表明,秦嶺太白山闊葉林土壤C/N和C/P高于針葉林,N/P則相反。天山北坡不同植被類型下土壤生態化學計量特征表現為N含量、C/P、N/P山地針葉林和亞高山灌叢草甸顯著高于山地荒漠草原、山地草原、高山點狀植被(P<0.05),P含量、C/N則是高山點狀植被顯著高于其他植被類型[8—9]。酶是土壤養分活化、周轉及供應的催化劑,土壤酶主要來源于植物根系和微生物活動,是土壤生源物質遷移轉換的驅動者[9],如水解酶可水解土壤中的蛋白質和多糖使養分更易被植物吸收,氧化還原酶的催化反應與能量的釋放有關。土壤酶活性受團聚體的形成環境、團聚體內通氣狀況及養分和水分差異的影響,同時粒徑大小也影響著團聚體微環境內微生物和土壤酶參與養分轉化的強度[10]。前人研究發現微團聚體內黏粒和粉粒的含量增加可使酶活性增強,如李鑫等[11]研究認為微團聚體內蔗糖酶、脲酶和β-D葡萄糖苷酶活性顯著高于大團聚體,也有部分學者認為大團聚體內氧氣和水分充足更有利于土壤酶活性的增強,如宮雪等[12]和姬秀云等[13]均認為蔗糖酶和磷酸酶活性隨著團聚體粒徑的增大而增加,可見團聚體內酶活性的分異規律差異較大。因此,研究不同區域灌叢化后團聚體內生態化學計量特征和酶活性分異規律對于揭示土壤生源物質循環至關重要。然而,草地灌叢化后土壤團聚體內生源物質含量如何變化?團聚體內酶活性是否發生變化進而影響草地土壤有機碳的固存?基于此,本研究擬圍繞青藏高原高寒灌叢化草地土壤團聚體內生源物質(C、N、P、K)富集特征、生態化學計量比和酶活性變化開展試驗,以期為科學認識青藏高原高寒草地生態系統碳循環機制提供理論支撐。
1 材料與方法
1.1 研究區概況
研究區地處青藏高原東緣,位于四川省阿壩藏族羌族自治州紅原縣邛溪鎮,西南民族大學青藏高原生態研究基地旁(32°49′38″N,102°34′21″E)(圖1),平均海拔3485 m,淺丘山地,大陸性高原寒溫帶半濕潤季風氣候,春、秋季節短暫,冬季漫長,霜凍期較長,年平均氣溫為1.4°C,最低溫度—36°C,最高溫度26°C。年相對濕度60%~70%,年均降水量650~800 mm,年均蒸發量648.2 mm。土壤成土母質由坡積物構成。采樣區灌叢化現象已形成約20年,草地植被類型為高寒草地,由草本和灌木構成,復合群落的總蓋度約70%。樣地灌木分蓋度約50%,草本層植物種類和生物量較少,分蓋度約30%。灌叢化草地植被主要建群種為高山繡線菊(Spiraea alpina)。未灌叢化草地植被主要以禾本科(Gramineae)和莎草科(Cyperaceae)為主,伴生種有菊科(Compositae)、豆科(Leguminosae)和毛茛科(Ranunculaceae)等,禾本科和莎草科中以發草(Deschampsia caespitosa)、垂穗披堿草(Elymusnutans)、垂穗鵝觀草(Roegneria nutans)、剪股穎(Agrostismatsumurae)、溚草(Koeleria macrantha)、早熟禾(Poa annua)等植物為主。

圖1 研究區位置Fig.1 Location of study ar ea
1.2 樣地選擇與樣品采集
本試驗野外取樣工作于2017年9月開展。按圖2樣方設計示意圖,隨機選取兩塊50 m×50 m無灌木生長的草地群落,在其周邊(直線距離10 m)隨機選取3塊已灌叢化樣地(50 m×50 m)。每塊灌叢化樣地按對角線采樣法設置3個1 m×1 m的樣方,在每個灌木叢樣方邊設置30 cm×30 cm的小樣方。用剪刀收集樣方內地上植被生物量,用土壤鏟挖取樣方內表層0~10 cm的原狀土,削去邊緣受擠壓的土壤后采集2 kg團聚體土樣,裝于硬質塑料盒,同時用環刀采集土壤容重樣品。未灌叢化生長的樣地取樣方式同上。植被地上生物量樣品裝于紙質信封袋帶回實驗室立即歸類。采集的土壤樣品自然風干,期間輕輕地將大塊土沿紋理分成10~12 mm的小塊,分別用于理化性質的測定和土壤團聚體的分級。

圖2 樣方設置示意圖Fig.2 Picture of plots design
1.3 土壤團聚體分離
土壤團聚體(本研究中團聚體指水穩性團聚體)的分級方法采用Cambardella等[14]的濕篩法和沉降虹吸法,將土壤團聚體分為>2 mm、0.25~2 mm、0.053~0.25 mm、0.002~0.053 mm和<0.002 mm 5個層級。具體方法為:將孔徑為2 mm、0.25 mm和0.053 mm的套篩,按照孔徑大小自上而下組合好,并將套篩放置于裝有蒸餾水的篩分桶內,稱取采集風干好的土樣100 g,均勻平鋪到孔徑為2 mm的套篩中,調整桶內水面高度剛好淹沒土樣,在室溫條件下放置浸潤5 min后,以振幅為3 cm,速度為30次·min—1震蕩2 min。篩分結束后收集各篩層上的團聚體并分別轉移至鋁盒中,50°C烘干稱重,即獲得>2 mm、0.25~2 mm和0.053~0.25 mm三級土壤團聚體。之后將分離桶內的土壤懸液用沉降虹吸法分離,得到0.002~0.053 mm和<0.002 mm的土壤微團聚體。
1.4 測定方法和計算
將用于土壤理化性質測定的土樣研磨,過2 mm和0.125 mm篩。過孔徑2 mm篩的土樣用于土壤顆粒組成、土壤pH的測定。過孔徑0.125 mm篩的土樣用于測定土壤有機碳(soil organic carbon,SOC)、全氮(total nitrogen,TN)、全磷(total phosphorus,TP)和全鉀(total potassium,TK)含量。采用元素分析儀(Elementar variomax CNS analyser,德國)測定SOC和TN含量;采用NaOH堿熔—鉬銻抗比色法測定TP含量;采用火焰光度法測定TK含量;采用環刀法測定土壤容重;采用酸度計測定土壤pH,水土比為2.5∶1.0;土壤機械組成采用激光粒度儀分析(Mastersizer 2000,Malvern Corp,英國),分為砂粒(0.05~2 mm)、粉粒(0.002~0.05 mm)和黏粒(<0.002 mm)3個粒級。
按照《土壤酶及其研究法》[15]中的標準方法測定土壤酶活性。采用靛酚比色法測定土壤脲酶活性;采用3-5二硝基水楊酸比色法測定土壤蔗糖酶活性;采用茚三銅比色法測定蛋白酶活性;采用磷酸苯二鈉比色法測定酸性磷酸酶活性;采用高錳酸鉀滴定法測定過氧化氫酶活性;采用對硝基酚比色法測定β-D葡萄糖苷酶活性。
1.5 數據分析
將所測得的數據進行正態分布和方差整齊性檢驗。灌叢化和未灌叢化草地土壤各級粒徑團聚體內生源物質和酶活性變化在SPSS 22.0中采用單因素方差分析(One-way ANOVA),并用Least Significant Difference(LSD)法進行多重比較,OriginPro 8.0進行圖表制作。為探討不同草地模式下土壤各粒徑團聚體內生源物質和酶活性的相關性,利用Canoco 5.0對土壤酶活性和土壤環境因子(pH、有機碳、全氮、全磷和全鉀)進行去趨勢分析(detrended correspondence analysis,DCA),后進行冗余分析(redundancy analysis,RDA)。
2 結果與分析
2.1 灌叢化草地土壤團聚體內生源物質含量分布
本研究中將土壤團聚體分為>2 mm和0.25~2 mm的大團聚體及0.053~0.25 mm、0.002~0.053 mm和<0.002 mm的微團聚體。由表1可見,SOC和TN含量在灌叢化與未灌叢化各粒徑團聚體內變化一致,都呈現出先增加后降低趨勢。均以0.053~0.25 mm團聚體中含量最高(有機碳的變化范圍為7.02~8.04 g·kg—1和7.29~11.47 g·kg—1,全氮為0.64~0.83 g·kg—1和0.65~0.94 g·kg—1),<0.002 mm粒徑最低(有機碳的變化范圍為6.42—8.10 g·kg—1和5.90~7.50 g·kg—1,全 氮 為0.57~0.73 g·kg—1和0.53~0.45 g·kg—1)。從大 到 小 依 次 為0.053~0.25 mm>0.25~2 mm>(>2 mm)>(<0.002 mm)>0.002~0.053 mm,其中>0.053 mm團聚體有機碳、全氮含量高于<0.053 mm團聚體。TP在灌叢化和未灌叢化土壤中,最大值出現在0.053~0.25 mm團聚體內(變化范圍為1.83~2.37 g·kg—1和1.56~1.87 g·kg—1),最小值出現在0.002~0.053 mm土壤團聚體內(變化范圍為1.57~2.37 g·kg—1和1.43~1.7 g·kg—1),從小到大依次排列為0.002~0.053 mm<(<0.002 mm)<(>2mm)<0.25~2 mm<0.053~0.25 mm,大團聚體(>0.25 mm)與微團聚體(<0.25 mm)之間差異顯著(P<0.05)。TK在灌叢化和未灌叢化草地團聚體內均無顯著變化,但仍以0.002~0.053 mm團聚體內含量最低(變化范圍16.51~20.99 g·kg—1和18.04~20.54 g·kg—1),而灌叢化后土壤全磷在各粒徑團聚體內均呈下降趨勢。
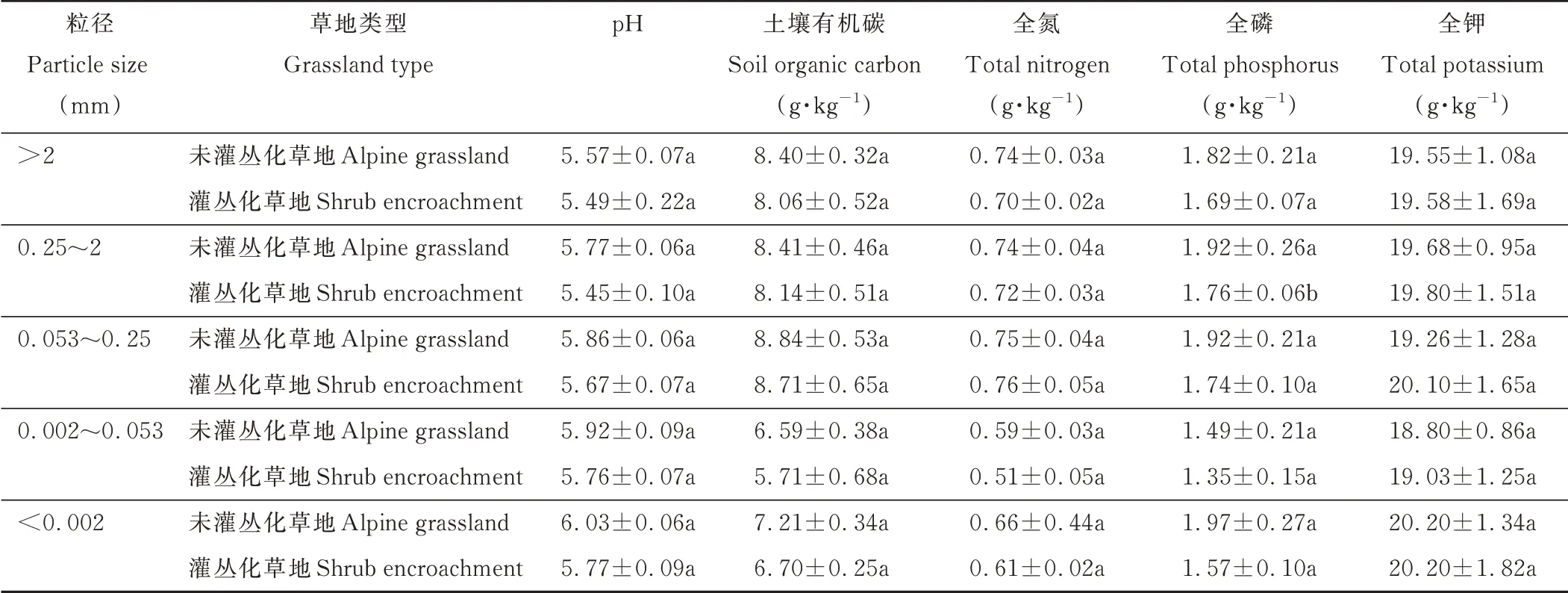
表1 灌叢化和未灌叢化草地土壤不同粒徑團聚體理化性質Table 1 Proper ties of the various aggr egates in shr ub encroachment and alpine gr assland
2.2 灌叢化草地土壤團聚體內生態化學計量比
灌叢化草地土壤團聚體C/N最大值出現在>2 mm團聚體內(變化范圍為11.00~12.02),而最小值出現在<0.002 mm團聚體內(變化范圍為10.76~11.40),兩者之間差異顯著(P<0.05),其他各粒徑之間均無顯著差異。灌叢化草地土壤團聚體內C/P和N/P變化相似,均以0.053~0.25 mm團聚體內最大(變化范圍為3.94~5.95和0.35~0.49),而0.002~0.053 mm團聚體內最小(變化范圍為3.32~6.13和0.30~0.49),土壤N/P在0.053~0.25 mm粒徑團聚體顯著高于0.002~0.053 mm粒徑(P<0.05),而土壤團聚體內C/P在各粒徑間均無顯著變化(表2)。
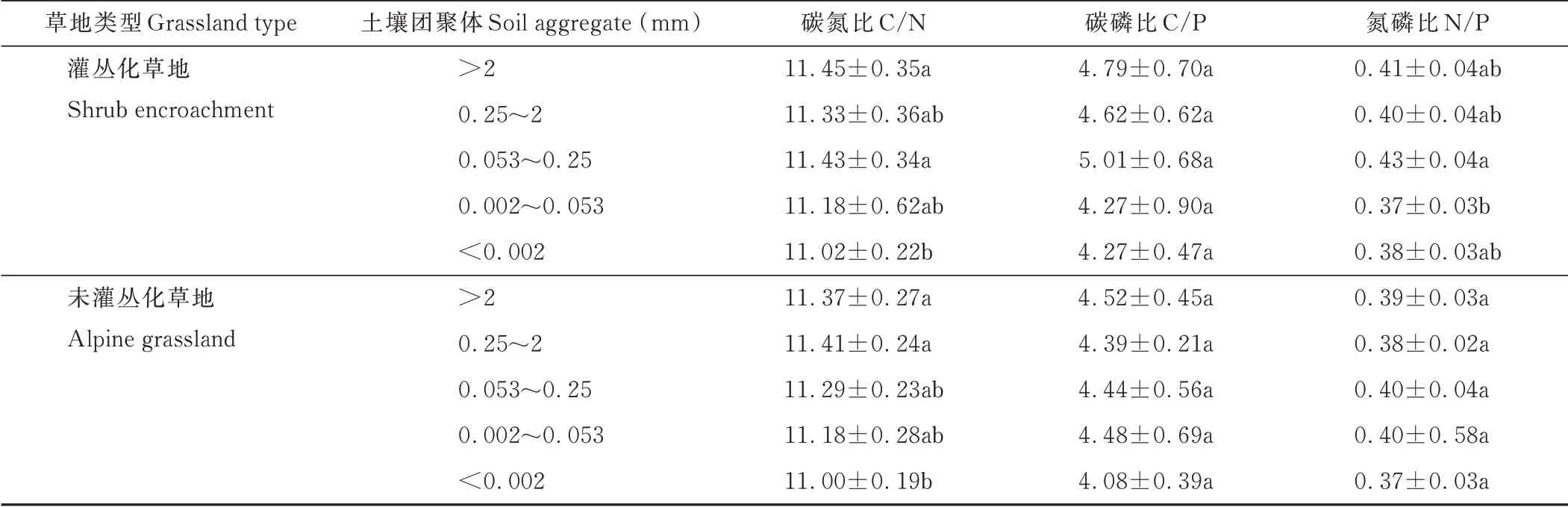
表2 灌叢化和未灌叢化草地土壤各粒徑團聚體內碳氮比、碳磷比和氮磷比Table 2 The C/N,C/P,N/P in various aggr egates under shrub encr oachment and alpine grassland
未灌叢化草地內土壤C/N的最大值出現在0.25~2 mm團聚體內(變化范圍為11.05~11.56),最小值出現在<0.002 mm團聚體內(變化范圍為10.69~11.16),>2 mm和0.25~2 mm團聚體內C/N顯著高于<0.002 mm(P<0.05)。土壤C/P和N/P的最大值出現在>2 mm和0.002~0.053 mm團聚體內(變化范圍為3.98~4.91和0.34~0.45),最小值出現在<0.002 mm土壤團聚體內(變化范圍為3.40~4.53和0.34~0.40),但土壤C/P和N/P在未灌叢化草地土壤各粒徑團聚體內均無顯著差異。
2.3 灌叢化草地土壤團聚體內酶活性變化
土壤酶活性的高低可影響生源物質的周轉與累積,對深度參與SOC、TN、TP和TK循環與轉化的酶研究發現(圖3),未灌叢化草地土壤中蔗糖酶活性在0.053~0.25 mm團聚體內最高(變化范圍225.29~262.70 mg·g—1·d—1),0.002~0.053 mm團聚體內活性最低(變化范圍141.7~260.8 mg·g—1·d—1),>0.053 mm高于<0.053 mm團聚體內蔗糖酶活性,在灌叢化草地中各粒徑團聚體內蔗糖酶活性以>2 mm團聚體內活性最高(變化范圍293.59~565.34 mg·g—1·d—1),0.002~0.053 mm團聚體內活性最低(變化范圍150.63~414.43 mg·g—1·d—1)。未灌叢化草地和灌叢化草地中土壤脲酶活性變化相一致,在>2 mm團聚體內最高(變化范圍855.5~2847.2 mg·g—1·d—1和798.3~2593.3 mg·g—1·d—1),0.002~0.053 mm團聚體內最低(變化范圍560.6~835.9 mg·g—1·d—1和619.1~754.3 mg·g—1·d—1),其中>0.053 mm團聚體高于<0.053 mm團聚體內脲酶活性。土壤蛋白酶在灌叢化草地中表現出<0.002 mm團聚體內活性最高(變化范圍190.55~505.31 mg·g—1·d—1),并隨團聚體粒徑的減小而增加(>2 mm團聚體除外),在未灌叢化草地中表現為0.002~0.053 mm團聚體內活性最高;以0.25~2 mm團聚體內酶活性最低(變化范圍為119.93~352.62 mg·g—1·d—1和42.95~380.30 mg·g—1·d—1)。土壤β-D葡萄糖苷酶活性在未灌叢化草地團聚體內最大值出現在>2 mm團聚體中(變化范圍0.017~0.034 mg·g—1·d—1),顯著高于0.002~0.053 mm團聚體內酶活性(變化范圍0.016~0.017 mg·g—1·d—1),而灌叢化草地β-D葡萄糖苷酶活性以<0.002 mm團聚體內活性最高(變化范圍0.016~0.034 mg·g—1·d—1),以0.002~0.053 mm團聚體內活性最低(變化范圍0.033~0.150 mg·g—1·d—1)。
土壤磷酸酶在灌叢化草地和未灌叢化草地各粒徑團聚體內變化相同,都表現為在0.053~0.25 mm團聚體內酶活性最高(變化范圍為0.43~0.87 mg·g—1·d—1),0.002~0.053 mm團聚體內最低(變化范圍為0.39~0.75 mg·g—1·d—1)。灌叢化后土壤蔗糖酶活性在各粒徑團聚體內均被提高,以>2 mm團聚體內酶活性變化最為顯著(P>0.05)。土壤脲酶和β-D葡萄糖苷酶活性在各粒徑團聚體內呈波浪狀變化,而灌叢化后土壤磷酸酶和蛋白酶則被降低。過氧化氫酶在灌叢化和未灌叢化草地土壤不同粒徑團聚體中無顯著性差異(圖3~4)。
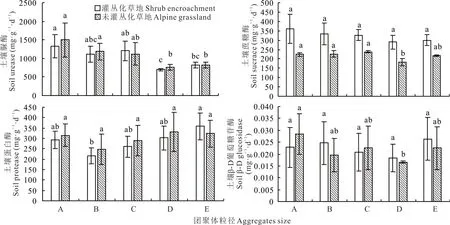
圖3 各粒徑團聚體內土壤蔗糖酶、脲酶、蛋白酶和β-D葡萄糖苷酶活性變化Fig.3 Changes of soil sucrace,urease,protease andβ-D glucosidase activities in aggregates of different particle sizes
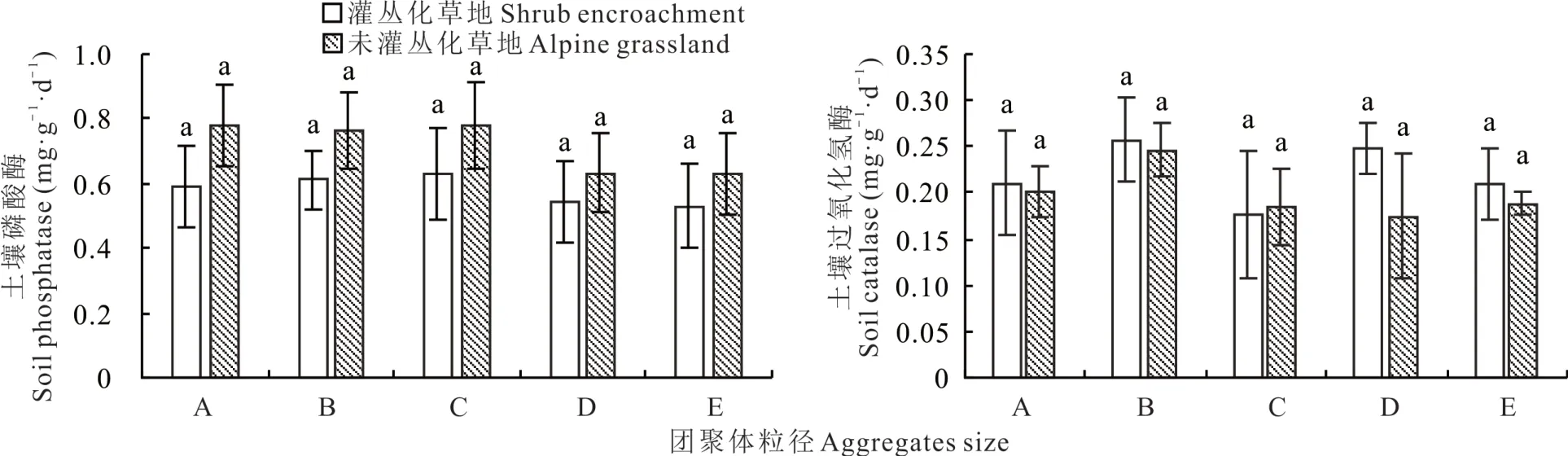
圖4 各粒徑團聚體內土壤磷酸酶和過氧化氫酶活性變化Fig.4 Changes of phosphatase and catalase activities in various soil aggr egates
2.4 灌叢化草地土壤團聚體內生源物質與酶活性冗余分析
利用酶數據進行DCA分析,結果中Axis Lengths的第一軸為0.29,遂用RDA排序模型。依據I型標尺縮放RDA排序圖。從排序圖可知(圖5),土壤生源物質有機碳、全氮、全磷和全鉀都主要分布在大團聚體中;土壤酶主要分布于大粒徑團聚體中(如>2 mm)。磷酸酶和蛋白酶主要存在于未灌叢化土壤團聚體內;蔗糖酶、過氧化氫酶和β-D葡萄糖苷酶主要分布在灌叢化草地土壤團聚體內,而脲酶表現為未受灌叢化影響。從不同粒徑團聚體內酶的分布看,草地土壤團聚體中>2 mm粒徑中磷酸酶和蛋白酶含量最高,0.25~2 mm和0.053~0.25 mm粒徑中酶的含量相近,<0.002 mm粒徑中最低。灌叢化草地土壤團聚體中蔗糖酶和過氧化氫酶分布相似,主要都分布在>2 mm和0.25~2 mm粒徑中。脲酶和β-D葡萄糖苷酶與土壤有機碳和全氮呈正相關,蔗糖酶和過氧化氫酶與全鉀呈正相關,蛋白酶和磷酸酶與全磷呈正相關。脲酶、磷酸酶和蛋白酶與p H呈負相關。

圖5 灌叢化草地土壤團聚體內生源物質與酶活性RDA分析Fig.5 Analysis of biogenic substances and enzyme activity RDA in soil aggregates of shrub grassland
3 討論
3.1 灌叢化對草地土壤有機碳、氮含量的影響
植被主要通過改變土壤溫度、水分和有機質輸入量影響土壤有機碳、氮的積累,從而改變團聚體內有機碳、氮富集[16]。本研究中灌叢化草地與未灌叢化草地土壤有機碳和全氮含量在不同粒徑團聚體內的變化為0.053~0.25 mm>0.25~2 mm>(>2 mm)>(<0.002 mm)>0.002~0.053 mm,>0.053 mm團聚體內有機碳、氮顯著高于<0.053 mm的微團聚體。這可能是由于團聚體形成和組成對有機質的固存能力和土壤含水量影響不同所導致。大團聚體由微團聚體通過膠結物質膠結而成,而微團聚體中的黏粒和粉粒是土壤生源物質富集的主要貢獻者[16—17]。土壤含水量較高易減弱獨立存在的微團聚體對有機碳、氮的吸附作用,可在一定程度上導致微團聚體(<0.25 mm)有機碳含量在水分的剝蝕作用下減少。Elliott[1]發現在濕潤土壤中(土壤含水量為42%~44%),由于水分對微團聚體(粒徑為0.053~0.090 mm)的剝蝕作用,其內有機碳的含量顯著低于其他土壤。灌叢化草地和未灌叢化草地各粒徑團聚體內土壤全磷明顯高于全國標準(0.65 g·kg—1)[18],可能是由于該區域的低溫環境不利于微生物分解和磷酸酶的轉化[19—20]。灌叢化后各粒徑團聚體內全鉀含量均無明顯差異,土壤全鉀主要受土壤母質和各類礦物的影響,可見灌叢化對該區域土壤母質和各類礦物的影響較小,且土壤全鉀被植物吸收處于平衡狀態[21]。灌叢化后各粒徑團聚體內全氮和全磷含量降低,淺層土壤中有機質來源于凋落物和植物細根,易受到淺根草本植物的影響,而灌木深根性可使根系分泌物輸入到深層土壤中,從而降低了對表層土壤有機碳氮的富集[21],致使淺層灌叢化草地各粒徑團聚體低于未灌叢化草地。
3.2 灌叢化對草地土壤團聚體內生態化學計量比的影響
團聚體內生態化學計量比可揭示灌叢化與未灌叢化土壤中養分限制和固存狀況[23]。C/N可反映土壤有機質分解速率,比值大于25時,有機質的分解速率降低,引起微生物與植物爭氮現象;小于25時有機質分解速率增大[24]。本研究中灌叢化草地和未灌叢化草地各粒徑土壤團聚體內C/N平均值為11.32,與全國土壤C/N標準12.30相近[19],C/N最大值出現在>2 mm灌叢化草地土壤團聚體內(11.45±0.35),小于25,并以微團聚體內比值最小,可能是由于團聚體內包含大量易于分解的有機質的緣故[25],有研究認為微生物被吸附在土壤微團聚體內,微生物量氮主要由土壤黏粒和有機質含量決定,從而導致微團聚體內C/N較低[26]。土壤C/N可通過影響微生物活性來影響土壤碳氮循環,微生物同化1份氮,需要24份碳作為底物[25—26]。大團聚體內C/N高于微團聚體,說明該區域>0.25 mm的大粒徑團聚體內氮的含量及微生物活性高于微團聚體,也佐證了團聚體對氮的富集特征。
氮磷作為植物生長的必需營養元素和生態系統常見的限制性元素,可作為土壤養分在生態系統中養分限制的預測性指標[27]。研究認為土壤N/P的最適值為14~16,當比值大于16時植物生長則受磷限制,而小于14時植物生長將受到氮限制[28]。本研究中在灌叢化草地和未灌叢化草地各粒徑團聚體內N/P平均值為0.39和0.38,小于全國土壤N/P平均值3.9,且顯著低于臨界值14,說明該區域植物生長可能受氮元素的限制,而磷元素過剩。在灌叢化草地土壤中0.053~0.25 mm團聚體內N/P值高于0.002~0.053 mm團聚體,總體呈現出大團聚體內N/P高于微團聚體的趨勢,而在未灌叢化草地土壤內N/P在各粒徑土壤團聚體內均無明顯變化,可見該地灌叢化現象有利于大團聚體內氮元素的積累。灌叢化后土壤團聚體內氮的富集和循環規律被改變,大粒徑土壤團聚體有利于氮元素的富集,而微團聚體內氮元素則以參與養分循環為主。
土壤C/P可作為衡量磷元素有效性和礦化的標志,可用來衡量土壤微生物釋放磷和固持磷的潛力,其變化大小受土壤水熱狀況和植被類型的影響。有研究認為C/P越低則代表磷的有效性越高[29],當C/P低于200時,將會導致有機磷的凈礦化和微生物碳的增加,而本研究中灌叢化和未灌叢化草地團聚體內C/P均低于200,甚至不足100,再次表明該地區磷元素可能過剩且有效性較高。有研究認為過高的磷元素有效性可抑制植物DNA、RNA、NADPH和ATP的形成,最終影響植物生長[30],而該地區過高的磷元素可能對部分植物的生長產生抑制效果。C/P在灌叢化草地和未灌叢化草地土壤各粒徑團聚體內均無顯著差異,這可能是由于兩種草地立地條件相似所致。團聚體內全磷含量過剩(平均值為1.72)是導致N/P和C/P低的主要原因,這與王華靜等[31]在黃土高原地區的研究結果相近,說明此區域磷元素含量巨大,土壤中固定1 Mt(1 Mt=106t)的碳需要0.02 Mt的磷,可見青藏高原地區大量的磷盈余有利于土壤固碳。本研究中灌叢化后各粒徑團聚體內C/N、C/P和N/P雖整體上呈增加趨勢,但與未灌叢化相比無顯著差異,可見灌叢化現象對土壤養分元素轉化和循環規律的影響較弱。可能是因為有機碳、氮和磷是土壤必需的組成成分,因此其積累、轉化和消耗過程具有相對固定的比值,受外界環境和植被類型的影響較小,從而變化不顯著。
3.3 灌叢化對土壤團聚體內酶活性的影響
土壤酶主要來源于動植物殘體、根系分泌物和微生物活動等,酶活性的高低可指示土壤各養分元素的循環快慢。齊思明等[32]認為團聚體對土壤酶具有明顯的保護作用,土壤團聚體內各種有機、無機物質的轉化都取決于相應的土壤酶。本研究中,灌叢化和未灌叢化草地土壤團聚體內蔗糖酶、脲酶和磷酸酶活性在>0.053 mm團聚體中均高于<0.053 mm的微團聚體,這與馬瑞萍等[33]研究結果相似,土壤酶活性隨著團聚體粒徑的增大而增大。有研究指出氣候和植被是導致有機質和微生物活動改變的重要因素,部分土壤酶來自微生物的分泌,而不同團聚體內有機質的輸入量和微生物活動差異可決定土壤酶在各粒徑團聚體內的分布規律[12,33],本研究區域地處高原氣候常年低溫寒冷,因此形成了獨特的微生物群落,地上植被生物量和群落豐富度較高,可將大量的有機質返還到表層土壤中,而各粒徑團聚體內新鮮有機質的輸入可使微生物對養分的利用和代謝能力增強,從而導致不同環境中酶活性變化規律具有差異。同時,各粒徑團聚體內蔗糖酶、脲酶、磷酸酶和β-D葡萄糖苷酶活性與有機碳、氮分布變化相似,酶活性大小與底物效應有關,Six等[17]認為大團聚體由多個小團聚體和膠結劑結合而形成,因此包裹著更多的顆粒有機碳和有機質,本研究中微團聚體內C/N低于大團聚體,可見微團聚體內有機質較高的分解速率不利于土壤養分的積累,而大團聚體充足的底物可促進酶活性的增加。另外,大團聚體內底物有機碳屬于易分解的活性有機碳,而微團聚體中底物有機碳則為惰性難分解[34],從而又進一步提高大團聚體內酶活性[17]。土壤蛋白酶主要來源于土壤微生物和植物根系的分泌,其活性可作為全氮礦化速率的指示劑,在灌叢化與未灌叢化土壤中蛋白酶活性隨團聚體粒徑的增長呈現出先降低后升高的趨勢,微團聚體內細菌數量和種類較為豐富,可在一定程度上增加土壤蛋白酶活性[35],本研究中蛋白酶在微團聚體中活性最強,可見該區域大團聚體內土壤全氮的礦化速率較低。土壤過氧化氫酶活性可表示土壤腐殖質化強度[36—37],本研究中過氧化氫酶含量極低,王理德等[38]認為土壤p H<5將導致過氧化氫酶失去活性,而本試驗區灌叢化和未灌叢化草地土壤團聚體內p H均值為5.7,接近臨界值5,因此過氧化氫酶在本區域兩種草地土壤團聚體內變化較小。
3.4 灌叢化草地生源物質循環與土壤酶
RDA冗余分析結果表明,土壤磷酸酶和蛋白酶主要分布在未灌叢化草地土壤團聚體內。土壤磷酸酶可催化無機磷降解,釋放出可被植物吸收利用的水解磷,是植物體內磷元素的重要來源[19]。本研究中未灌叢化草地土壤磷酸酶活性較高,可見未灌叢化草地土壤中無機磷向有機磷的轉化速度較快,這也間接反映了N/P較低的原因。灌叢化后磷酸酶活性降低可能會導致磷元素的循環和轉化速率降低,減少土壤中磷元素有效性,這與兩種不同草地土壤環境差異有關。蔗糖酶、過氧化氫酶和β-D葡萄糖苷酶主要分布在灌叢化草地土壤團聚體內,而脲酶則未受灌叢化影響。蔗糖酶和β-D葡萄糖苷酶都參與土壤有機質的代謝過程,對土壤碳元素的轉化起著重要的作用,其活性受到土壤微生物、有機質和呼吸速率的影響[32]。灌叢化草地中土壤蔗糖酶活性均增加,灌叢化增加了地表枯落物量、分解腐殖質的微生物生物量和種類,促進了微生物對土壤酶的分泌,進而使分解有機質酶的活性增加[11]。另外,灌木根系對土壤碳的利用率高于草本類植物根系[39],灌木可將生物量中的碳經凋落物和根系返還到土壤中,增加了灌叢土壤團聚體內碳的含量,充足的可利用底物也可作為灌叢化后蔗糖酶和β-D葡萄糖苷酶活性增加的重要原因。可見灌叢化后土壤碳的周轉速率增加,在一定尺度上加速了該區域碳循環過程,而酶活性增強加速了碳釋放速率,也可能是該區域灌叢化后各粒徑團聚體內有機碳降低的原因之一。灌叢化后團聚體內過氧化氫酶活性的增加可加速有機質轉化,灌叢化后枯枝落葉增多導致土壤營養物質豐富,進而在促進土壤生化代謝能力的同時也使有毒物質增加,而灌叢化后過氧化氫酶活性的提高可以緩解生物氧化作用對土壤的破壞[40],但由于本試驗區域過氧化氫酶受pH影響較大,導致對有機質轉化的推動可忽略不計。
在灌叢化和未灌叢化草地土壤團聚體內全氮與土壤脲酶和β-D葡萄糖苷酶呈正相關,全磷與蛋白酶和磷酸酶呈正相關,全鉀與蔗糖酶和過氧化氫酶呈正相關,可見土壤脲酶、蔗糖酶、磷酸酶、β-D葡萄糖苷酶和蛋白酶是推動該地區團聚體內有機碳、氮、磷積累和循環的主要酶類。本研究中灌叢化后部分酶活性增強,部分表現為不明顯和降低,此變化與團聚體中有機碳、氮和磷的富集規律相同。通常認為大團聚體內有機碳易受微生物降解,微團聚體內有機碳則多為腐殖質化程度較高的惰性碳,表現為難降解[35],而酶活性在大團聚體內的富集可能會使土壤中原來固存的有機碳被分解和釋放,在一定程度上可能會影響到該區域碳、氮和磷的循環和富集規律,并可能在土壤質量和溫室氣體排放中起到消極作用。從土壤團聚體的形成來看,微團聚體內粘粒對土壤酶具有吸附作用,抑制了土壤酶的催化能力,而大粒徑團聚體內酶活性有較高的催化能力,能有效地降解有機質并釋放養分,可見不同粒徑團聚體內酶活性與養分循環存在差異[40]。但由于土壤酶活性的變化并未得出明顯差異和統一的規律,因此該區域灌叢化對土壤團聚體內生源物質的富集和碳氮循環還需更深入和長期的研究。
4 結論
在青藏高原東緣灌叢化與未灌叢化草地土壤中,SOC、TN和TP主要富集在0.053~0.25 mm團聚體內;與未灌叢化草地相比,灌叢化后各粒徑團聚體內TN和TP含量均呈降低趨勢。灌叢化后團聚體內C/N、C/P和N/P呈增加趨勢,但均小于全國標準,可見該地區土壤團聚體內有機碳易于被分解,土壤磷的有效性較高;磷酸酶和蛋白酶主要分布于草地土壤團聚體內,而蔗糖酶、過氧化氫酶和葡萄糖苷酶主要分布在灌叢化草地土壤團聚體內;灌叢化后土壤各粒徑團聚體中蔗糖酶活性增加,而蛋白酶和磷酸酶活性降低。脲酶和β-D葡萄糖苷酶與土壤SOC和TN呈正相關,蔗糖酶和過氧化氫酶與TK呈正相關,蛋白酶和磷酸酶與TP呈正相關;土壤蔗糖酶、磷酸酶、過氧化氫酶和β-D葡萄糖苷酶主要富集在>0.25 mm的大團聚體內,可見該區域土壤碳和磷循環主要以大團聚體為主。盡管磷元素有利于土壤有機碳的積累,但該研究區土壤生源物質主要富集于大團聚體內,而大團聚體易于被外界干擾破碎,可見灌叢化現象可能不利于該研究區有機碳的長期固存。

