基于SERS技術的基底增強效應對比及食源性芽孢快速檢測
田家齊,李苗云,2,朱瑤迪,2,趙莉君,2,劉世杰,2,劉惟佳,蔣 培,趙改名,2,徐麗娜,2,孫靈霞,2,馬陽陽,2,梁 棟,2
基于SERS技術的基底增強效應對比及食源性芽孢快速檢測
田家齊1,李苗云1,2,朱瑤迪1,2※,趙莉君1,2,劉世杰1,2,劉惟佳1,蔣 培3,趙改名1,2,徐麗娜1,2,孫靈霞1,2,馬陽陽1,2,梁 棟1,2
(1. 河南農業大學食品科學技術學院,鄭州 450002;2. 河南省肉品加工與安全國際聯合實驗室,鄭州 450002;3. 河南省市場監督管理局質檢中心,鄭州 450006)
為了實現食源性芽孢的快速識別,該研究利用表面增強拉曼光譜技術,以產氣莢膜梭菌芽孢(.spores)、艱難梭菌芽孢(.spores)和生孢梭菌芽孢(.spores)為研究對象,將3種不同納米溶膠材料AuNPs、AgNPs和Au@AgNPs作為表面增強拉曼散射(Surface-enhanced Raman scattering,SERS)基底對食源性芽孢的增強效應進行對比,確定較佳增強效果的納米材料,進一步開展基于較優納米溶膠材料為基底的SERS技術對不同種屬食源性芽孢的光譜解析及快速識別研究。結果表明,Au@AgNPs對食源性芽孢的SERS增強效果最較好,其增強因子達3.49×104,且光譜特異性和重現性良好。經拉曼光譜解析,Ca2+-DPA的拉曼峰是三種食源性芽孢的共有標志特征峰,拉曼振動峰在1 017、1 440和1 570 cm-1波段顯示且峰強度不同。.芽孢在740、787、821、1 203、1 308和1 627 cm-1有獨特的拉曼峰,.芽孢在852 cm-1有獨特的拉曼峰,在1 017 cm-1(Ca2+-DPA)、1 081 cm-1(DNA、O-P-O)處峰位強度.芽孢>.芽孢>.芽孢,在1 332 cm-1(核酸中腺嘌呤核酸)、1 440 cm-1(Ca2+-DPA)處峰位強度.芽孢>.芽孢>.芽孢,3種食源性芽孢的SERS圖譜出峰位置和峰強度差異明顯。結合主成分分析(Principal Component Analysis,PCA)和線性判別分析(Linear Discriminant Analysis,LDA)構建定性識別模型,經 PCA分析,其前三個主成分的累計貢獻率達92.90%,然后利用LDA進行分析,其識別率可達到100%。結果表明,以Au@AgNPs為基底的SERS技術檢測方法可以實現對食源性芽孢的快速識別,為食源性芽孢檢測和食品安全檢測提供了有效手段。
光譜分析;模型;表面增強拉曼光譜(SERS);溶膠納米材料;食源性芽孢;快速識別
0 引 言
食源性芽孢是部分食源性致病菌在不利條件下為了存活產生的休眠體,由于其特有的結構特點,賦予其極強的抗逆性。食源性芽孢經高溫高壓滅菌后仍能存活,當外界環境適宜時芽孢再次萌發形成菌體,生長繁殖過程中產生毒素,引起食品腐爛變質甚至食源性疾病[1]。每年由于食源性致病菌導致的食源性疾病造成全球約2 000萬人死亡,對食品質量安全存在極大的威脅[2]。因此,開發快速靈敏、重現性高且及時有效的檢測技術是預防和控制食源性芽孢的關鍵,也是世界公共衛生安全亟待解決的難題,對提高食品質量安全、減少食物中毒和食源性疾病的發生具有重要意義。
目前,芽孢的主要檢測手段是平板培養法,結合營養萌發因子或非營養萌發因子各種誘導手段促使芽孢萌發為營養細胞,進而通過平板計數和16S rDNA鑒定來間接檢測樣本中芽孢污染情況[3]。雖然結果較為準確,但是培養、分離和鑒定過程費時耗力,檢測時效性差。近年來,隨著光譜檢測技術的發展,方便快捷的光譜檢測技術越來越多的應用于食品微生物檢測。例如,熒光光譜技術,通過檢測樣本所發出的熒光光譜或強度來測定樣品中的熒光物質和含量,具有簡便快捷,重現性好,選擇性高等優點,但缺乏化學結構信息的特異性,易受元素相互干擾和重疊峰的影響,難于分析[4];近紅外光譜技術主要是通過使用含氫基團,有效獲取樣本光譜中所包含的物理信息、化學信息或生物信息,具有快捷無損,易操作和成本低等優點,但不適用于水分含量大的樣本檢測,靈敏度低[5]。這些方法對食源性芽孢的檢測都存在難以避免的局限性。拉曼光譜作為分子的振動光譜,受水分干擾小,適用于生物樣本的檢測,但存在檢測信號弱的缺點[6]。表面增強拉曼光譜(Surface-Enhanced Raman Spectroscopy,SERS)技術通過貴金屬納米材料與待測物偶聯吸附,通過電磁增強效應使待測物的拉曼散射信號強度放大,以增強拉曼信號[7]。SERS作為一種生物指紋識別技術,不需對樣品過多前處理,具有簡單、高效、靈敏等優勢,可滿足對食源性芽孢快速檢測的需求[8]。
國內外許多研究表明,SERS技術在食源性致病菌快速檢測領域具有巨大的優勢和發展潛力。Xu等[9]設計了一種通過將金屬摻雜的沸石咪唑酯骨架(ZIF-67)及其衍生物錨定到棉織物為SERS基底,對金黃色葡萄球菌和大腸桿菌進行SERS光譜解析及定性定量識別,該基底表現出6.07×106的高增強因子和10-8mol/L的低檢測限。Bozkurt等[10]通過開發ALP酶固定化納米顆粒SERS生物傳感器,用于大腸桿菌的特異性識別和快速檢測,大腸桿菌濃度為1.7×101~1.7×106cfu/mL時建立了良好的線性關系(2= 0.992)。Chen等[11]采用無標記表面增強拉曼光譜(Surface-Enhanced Raman Spectroscopy,SERS)檢測飲用水中致病菌的方法,在細菌懸浮液中合成銀納米溶膠,該方法可以選擇性地區分不同的細菌種類,鑒別出大腸桿菌、金黃色葡萄球菌、綠膿桿菌和李斯特菌等幾種常見病原菌,區分了兩種李斯特菌,整個分析在5 min內完成,試驗的檢測限為103cfu/mL。Hayleigh Kearns等[12]將具有細菌特異性識別分子的SERS活性銀納米顆粒與凝集素功能化的磁性納米顆粒相結合,從而能夠通過磁分離捕獲和分離實現對大腸桿菌、傷寒桿菌和耐甲氧西林金黃色葡萄球菌的單一病原體的快速檢測,每種菌株的最低檢測濃度僅為10 cfu/mL。然而,基于SERS技術對不同食源性芽孢的光譜解析和快速識別鮮見報道。
基于此,本研究通過制備三種不同溶膠納米材料,納米金溶膠AuNPs、納米銀溶膠AgNPs以及金屬復合納米粒子Au@AgNPs作為SERS基底材料,以產氣莢膜梭菌芽孢(.spores)、艱難梭菌芽孢(.spores)和生孢梭菌芽孢(.spores)為研究對象,通過對比3種不同溶膠納米與.spores的增強效應對比,確定食源性芽孢SERS檢測最佳基底材料。進一步,以增強效應最佳的溶膠材料作為SERS基底,采集3種不同食源性芽孢的SERS圖譜并進行解析,結合主成分分析(Principal Component Analysis,PCA)和線性判別分析(Linear Discriminant Analysis,LDA)實現食源性致病菌芽孢的快速識別,為快速、便捷地檢測食源性致病菌芽孢提供有效手段。
1 材料與方法
1.1 試劑與材料
菌株.ATCC 13124、.ATCC 43593、.BNCC 185933,來自中國菌種保藏中心和廣東環凱微生物技術有限公司,-80 ℃保存于瓷珠法菌種保存管中。胰胨-亞硫酸鹽-環絲氨酸瓊脂培養基(Tryptose Sulfite Cycloserine Agar Base,TSC),產芽孢肉湯,購于北京陸橋有限公司;強化梭菌培養基(Reinforced Clostridium Medium,RCM),硫乙醇酸鹽流體培養基(Fluid Thioglycollate Medium,FTG),腦心浸液肉湯(Brain Heart Infusion Broth,BHI),營養瓊脂(Nutrient Agar,NA),購于青島海博有限公司;酵母提取物,L-半胱氨酸,牛磺膽酸鈉,檸檬酸鈉溶液,氯化鈉(NaCl),抗壞血酸,等購于國藥集團化學試劑有限公司,均為分析純。
1.2 主要試驗儀器
超純水機OSJ-UP-30L,濟南歐萊博科學儀器有限公司;低溫培養箱MIR-254,日本SANYO公司;生物安全柜OSJ-UP-30L,上海川一實驗儀器有限公司;高速冷凍離心機ALLEGRA-64A,美國Beckman Coulter公司;蒸汽壓力滅菌鍋HVE-50,日本HIRAYAMA公司;生物顯微鏡ECLIPSE 80i,日本NIKON公司;紫外分光光度計UV-2600,島津企業管理(中國)有限公司;納米激光粒度儀Winner 802,濟南微納顆粒儀器股份有限公司;激光共聚焦拉曼儀LabRAM HR Evolution,HORIBA上海茂培科技有限公司。
1.3 食源性致病菌芽孢的培養方法
1)產氣莢膜梭菌芽孢的制備。將-80℃瓷珠法菌種保存管中的.s瓷珠取出,分區劃線接種于TSC培養基,37 ℃恒溫培養箱中厭氧培養24 h。用接種環挑取培養基中的單菌落轉移到FTG中,37℃厭氧培養12 h。將增菌液轉移到產芽孢肉湯中,37℃恒溫厭氧培養48 h。取培養液于離心管中,離心(8 000 r/min、10 min、4 ℃)取沉淀物,加入滅菌的去離子水離心洗滌3~7次。將離心后的芽孢沉淀重懸去離子水中,將濃度調整為107cfu/mL后保存至-20 ℃直至使用。
2)艱難梭菌芽孢的制備。將-80℃瓷珠法菌種保存管中的.瓷珠取出,分區劃線接種于FTG培養基,37 ℃厭氧培養24~48 h。挑取單菌落接種到已加入促芽孢生長因子(1%酵母提取物、0.1% L-半胱氨酸和0.05%牛磺膽酸鈉)的BHI肉湯中,37 ℃厭氧培養5~7 d。離心、鏡檢與保存方法同上。
3)生孢梭菌芽孢的制備。將-80 ℃瓷珠法菌種保存管中的.瓷珠取出,分區劃線接種于RCM培養基,37 ℃培養12~24 h。挑取單菌落接種到RCM液體培養基中增菌,37 ℃培養24 h。將增菌液轉移到RCM固體培養基中,37 ℃恒溫培養6~7 d。用經過滅菌的載玻片將芽孢從RCM培養基中刮下,離心、鏡檢與保存方法同上。
1.4 不同種類納米材料的制備
1)AuNPs溶膠的制備。以檸檬酸鈉還原法制備AuNPs溶膠的方法為基礎稍作修改[13]。向100 mL超純水中加入0.01 g HAuCl4攪勻,加熱沸騰后,在磁力攪拌下,滴加1.5 mL、1%的檸檬酸鈉溶液,待顏色變為酒紅色后繼續加熱15 min。制得AuNPs溶膠,在4 ℃避光保存備用。
2)AgNPs溶膠的制備。按照抗壞血酸氧化還原法制備AgNPs溶膠方法稍作修改[14]。向20 mL超純水中加入5 mL聚乙烯吡咯烷酮(Polyvinyl Pyrrolidone,PVP),用磁力攪拌器攪拌的同時加入85 mL AgNO3。在磁力攪拌下,加入200L、5 mol/L NaCl溶液,制得AgCl膠體,避光備用。取0.5 mol/L的NaOH溶液,在快速攪拌下向其中滴加20 mL、50 mmol/L抗壞血酸溶液,并加入2.3 mL的新制AgCl膠體,避光下攪拌2 h,得到呈灰綠色的AgNPs溶膠,4 ℃保存備用。
3)Au@AgNPs溶膠的制備。改進汪崇文[15]的方法來合成Au@AgNPs溶膠。向錐形瓶中加入100 mL超純水和0.01 g的HAuCl4溶液,用電磁加熱攪拌器加熱至沸騰(600 r/min),向其中滴加6 mL、1 %的檸檬酸鈉溶液,繼續加熱10 min,制得AuNPs溶膠溶液,作為銀殼包覆的種子。取150 mL超純水加入上述制備的50 mL AuNPs溶膠溶液和2 mL、1%檸檬酸鈉,用電磁加熱攪拌器加熱至沸騰(600 r/min)。向上述煮沸的溶液中滴加1 mL、0.2% AgNO3溶液,30 min后停止加熱,待溶液冷卻至室溫后用超純水定容至200 mL,所得為Au@AgNPs溶膠溶液。
1.5 納米材料的表征
參考Song等[16]的方法,對制備的3種不同種類納米材料進行紫外可見分光光度計(UV-Visible Spectrophotometer,UV-Vis)、透射電鏡(Transmission Electron Microscope,TEM)和粒度分布進行表征。
1.6 樣品的制備
將培養所得的不同芽孢液和納米溶膠分別離心三次后重懸備用。將濃度均為107cfu/mL離心后的.芽孢、.芽孢、.芽孢溶液分別與AgNPs、AuNPs、Au@AgNPs溶膠按1∶1混合,超聲震蕩5 min,使三種納米溶膠分別與三種芽孢混合吸附,分別將待測樣品于載玻片上,并將AgNPs和3種芽孢分別在載玻片上做空白對照,放置在無菌操作臺中自然晾干備用。試驗中所用的載玻片用王水(VHCl∶VHNO3=3∶1)浸泡清洗,去除其表面的雜質,之后用超純水洗滌三遍,用氮氣吹干載玻片,備用。
1.7 拉曼光譜檢測
開啟LabSpec 6.0軟件,用硅片(Si)做空白,以520.77 cm-1峰作為基準峰校零。表面增強拉曼光譜采集使用532.8 cm-1的激光作為激發光源,設置強度為最大強度(15 mW),物鏡為100倍,積分時間30 s,積分3次。檢測的光譜為400~3 200 cm-1,分辨率為1 cm-1。將處理好的樣品進行上機檢測,之后使用LabSpec 6.0軟件對樣品進行光譜采集,對每個樣品分別隨機采集10次。
為量化納米材料的SERS增強效應,可通過式(1)[17]計算SERS增強因子(Analytical Enhancement Factor,AEF),式中I為芽孢在未使用增強基底條件下的拉曼特征峰峰強度(a.u.);C為芽孢在未使用增強基底條件下的濃度(cfu/mL);I為芽孢在使用增強基底條件下的拉曼特征峰峰強度(a.u.);C為芽孢在使用增強基底條件下的濃度(cfu/mL)。
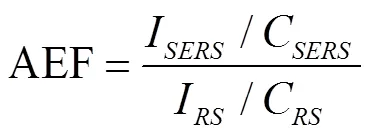
1.8 數據分析
使用EXCEL 2010、SPSS 16.0數據分析軟件、Origin 2021軟件進行數據處理。
2 結果與分析
2.1 材料的表征結果
2.1.1 三種納米材料的UV-Vis表征
由于不同金屬納米材料具有不同的表面等離子體耦合峰,可從紫外-可見吸收光譜中獲得。不同納米材料的紫外吸收峰位置、峰高、半峰寬分別與材料的種類、濃度、粒徑分布有關[18]。用紫外-可見分光光度計對三種不同納米材料表征結果如圖1所示。抗壞血酸還原法制備的AgNPs,最大吸收峰在518 nm,由檸檬酸鈉還原法制備的AuNPs,出峰位置在437 nm處。AgNPs和AuNPs的峰形具有一定的對稱性,峰值相對尖銳、半峰寬相對較窄,說明制備的AgNPs和AuNPs尺寸分布較窄。圖1中Au@AgNPs的紫外-可見吸收光譜相對于AuNPs的吸收光譜,Au@AgNPs的吸收光譜在420 nm處出現新的吸收峰,與純AgNPs的SPR吸收峰接近,表明在Au核上形成了Ag殼[19],成功制得Au@AgNPs溶膠。

圖1 三種不同種類的納米溶膠的UV-Vis表征
2.1.2 三種納米材料的粒度分析和TEM表征
為進一步了解三種不同納米材料的尺寸大小、形貌、分散性,對三種納米材料進行TEM和粒度表征,結果如圖2所示。由圖2中a、d可知,改良檸檬酸鈉還原法制備的AuNPs的粒徑大小主要分布在30~150 nm之間,形貌呈圓球形顆粒,分散較集中;如圖2中b、e所示,改良抗壞血酸還原法制備的AgNPs的粒徑大小主要分布在20~70 nm之間,形貌呈不規則球狀,有少數圓三角形和正方形;由圖2中c、f可知,Au@AgNPs溶膠的粒徑大小主要分布在35~85 nm之間,能明顯觀察到Au@AgNPs呈Au核Ag殼夾層結構,中間的金核呈球形,整體的Au@AgNPs呈不規則球狀,進一步證明了Au@AgNPs的成功合成。AuNPs的粒徑分布范圍較寬,尺寸均勻度相對較差,而AgNPs和Au@AgNPs的粒徑分布相對集中,尺寸均勻度相對較好。這對基底的SERS增強效應和信號重現性至關重要,為進一步SERS檢測食源性芽孢奠定良好基礎。使用Nano Measurer軟件分別統計三種納米材料的200顆納米粒子的粒徑,計算出三種納米材料的平均粒徑,其中AuNPs為82.26 nm,AgNPs為49.83 nm,Au@AgNPs為57.85 nm。
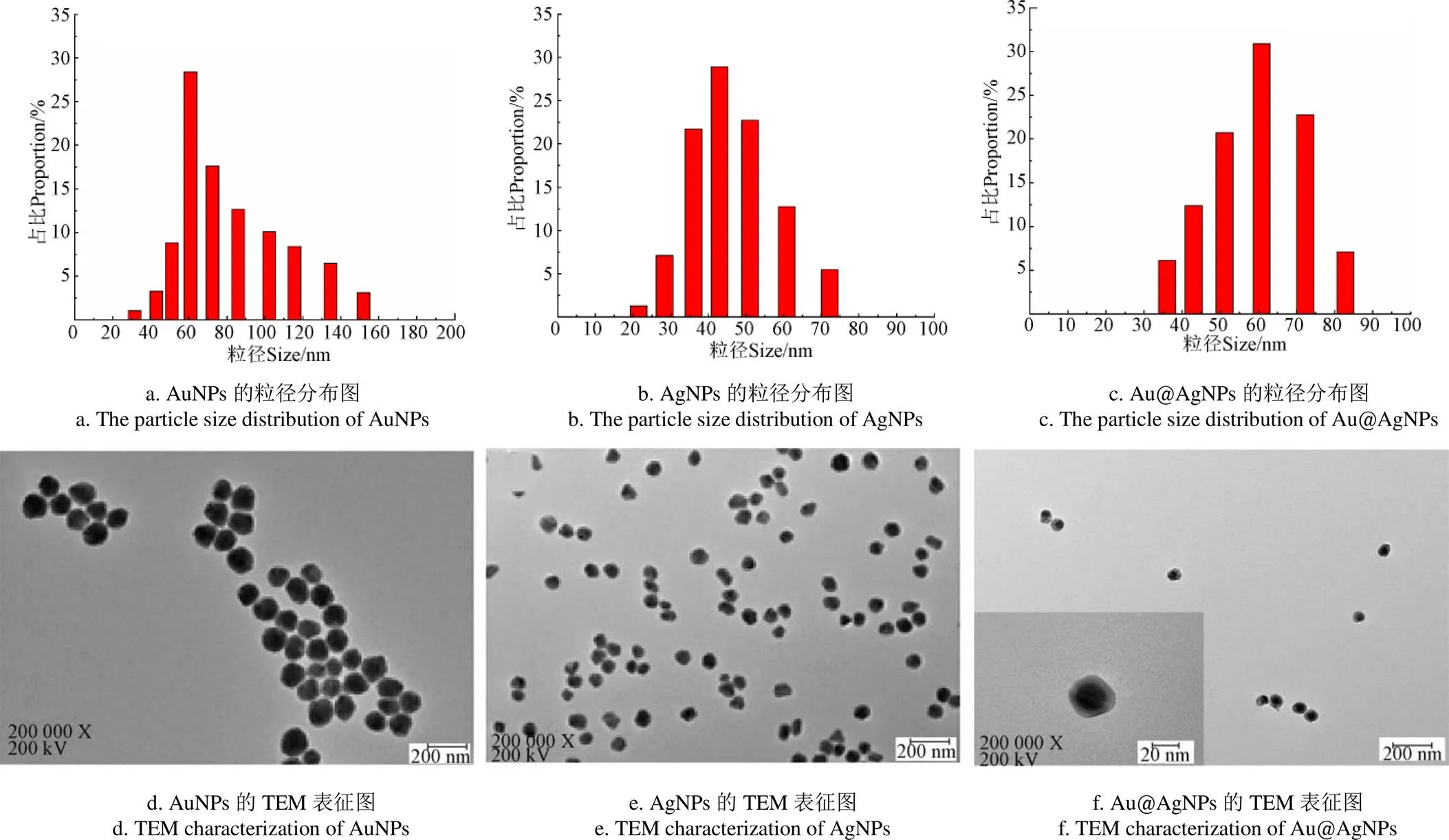
圖2 三種納米材料的粒徑分布圖和TEM表征圖
2.2 不同納米材料對芽孢SERS增強效應對比
為了解AuNPs、AgNPs、Au@AgNPs三種溶膠納米材料(NPs)的增強效果,以.芽孢為檢測對象,使用激光共聚焦拉曼光譜儀分別對.芽孢和“.芽孢+NPs”混合樣品進行光譜采集,.芽孢的拉曼光譜作為空白對照。如圖3所示,為AuNPs、AgNPs、Au@AgNPs對.芽孢增強效果和.芽孢未增強的拉曼光譜圖,當僅有芽孢存在時,拉曼光譜信號弱,芽孢的拉曼光譜圖未出現任何顯著特征峰型,而當芽孢分別與3種納米材料混合時,拉曼信號均有一定的增強,且芽孢的拉曼信號譜峰圖出峰明顯,“.芽孢+NPs”的SERS圖譜在1 017 cm-1、1 084 cm-1、1 570 cm-1的拉曼光譜有顯著增強。以1 570 cm-1處拉曼光譜強度計算增強因子,結果如表1可知,AuNPs增強因子為1.69×104;AgNPs增強因子為3.50×103;Au@AgNPs增強因子為3.49×104;Au@AgNPs增強因子遠高于AuNPs和AgNPs,Au@AgNPs對食源性芽孢的SERS增強效果較佳。這可能與納米材料的種類有關,作為復合納米材料的Au@AgNPs對食源性芽孢的SERS增強效果要優于單一納米材料對食源性芽孢的SERS增強效果[20]。
2.3 Au@AgNPs對三種芽孢的SERS增強效應重復性檢驗
良好的穩定性和重現性為基于SERS基底對食源性芽孢的快速識別結果提供了有力的可信度。為檢驗Au@AgNPs應用于食源性芽孢檢測的穩定性,以濃度均為107cfu/mL的.芽孢、.芽孢、.芽孢為例,通過激光共聚焦拉曼光譜儀隨機掃描10次。由圖4所示,Au@AgNPs的10條平行SERS光譜的一致性較好,且.芽孢在1 570 cm-1的拉曼峰值相對標準偏差(Relative Standard Deviation,RSD)為6.78%,.芽孢在1 570 cm-1的RSD為3.94%,.芽孢在1 570 cm-1的RSD為5.83%。結果表明,以Au@AgNPs為基底的SERS技術檢測食源性芽孢具有較好的重現性。
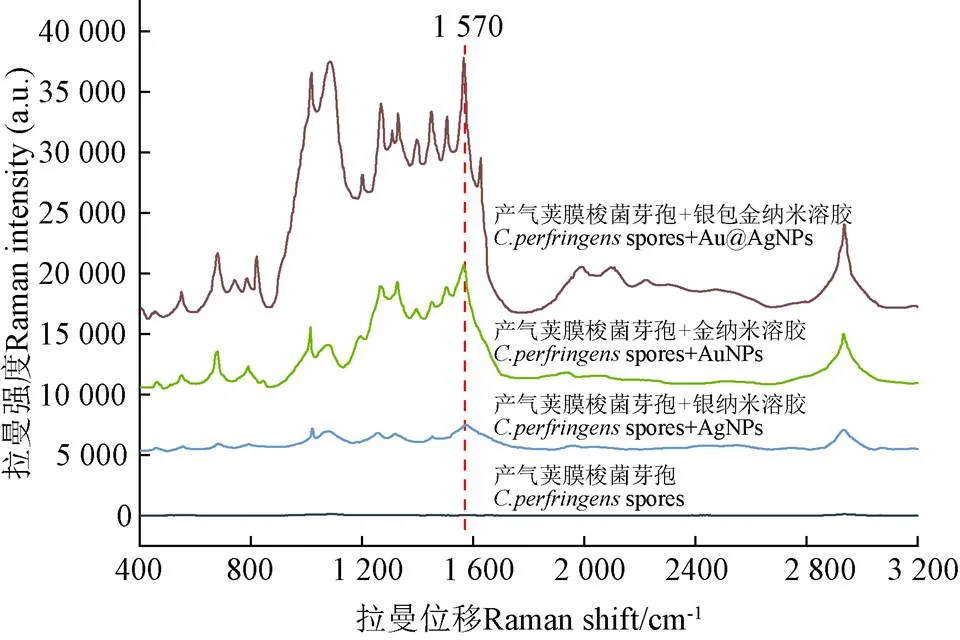
圖3 三種材料對C. perfringens芽孢的增強效果
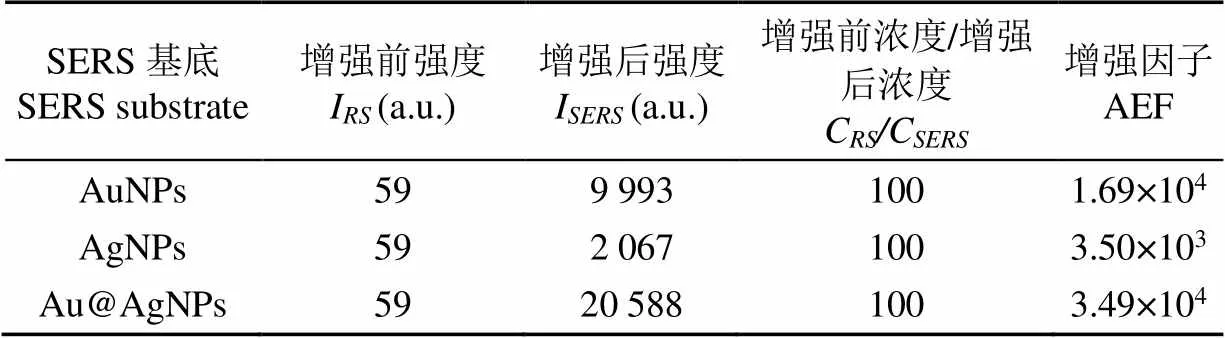
表1 三種納米材料的增強因子
注:I和C為未使用增強基底時1 570 cm-1左右的CaDPA特征峰的拉曼光譜強度和相對應的濃度,I和C為使用3種不同納米溶膠作為增強基底時1 570 cm-1特征峰的拉曼光譜強度和相對應的濃度。由于芽孢未增強時拉曼信號微弱,因此未增強濃度為增強濃度的100倍以獲得芽孢的原始拉曼圖譜。
Note:IandCrefer to the Raman spectral intensity and corresponding concentration of the characteristic peak of CaDPA around 1 570 cm-1without the reinforced substrate, whileIand Crefer to the Raman spectral intensity and corresponding concentration of the characteristic peak of 1 570 cm-1with three different nanosols as the reinforced substrate. Because the Raman signal of spores is weak when they are not enhanced, the unenhanced concentration is 100 times of the enhanced concentration to obtain the original Raman spectrum of spores.
2.4 三種芽孢的光譜解析
通過相差顯微鏡觀察產氣莢膜梭菌芽孢(.spores)、艱難梭菌芽孢(.spores)和生孢梭菌芽孢(.spores),在100倍油鏡下顯示三種芽孢清晰可見且形態相似,均呈現中間發亮的橢圓狀結構,表明三種芽孢的成功制備。利用SERS技術的指紋識別功能對三種芽孢進行拉曼信號放大和光譜信息采集,通過解析食源性芽孢的SERS光譜,探究不同芽孢之間的分子結構和異同之處,實現基于SERS技術對三種食源性芽孢的快速定性識別。
對三種不同食源性芽孢與Au@AgNP的復合物分別進行10次隨機拉曼數據采集,經基線校正、歸一化和平滑處理,對3種食源性致病菌芽孢的SERS平均指紋圖譜和SERS光譜拉曼位移的暫定歸屬如圖5和表2所示。結果如圖5所示,經過Au@AgNP基底對三種食源性芽孢拉曼圖譜的增強,三種芽孢的特征峰清楚且有明顯差異。圖5為.芽孢、.芽孢、.芽孢的SERS平均光譜。表2是對這三種芽孢的典型拉曼光譜峰進行了詳細的暫定歸屬。由圖5和表2可知,.芽孢有16處明顯拉曼振動峰,分別在549、680、740、787、821、1 017、1 084、1 203、1 268、1 308、1 328、1 400、1 447、1 506、1 565和1 627 cm-1;.芽孢有13處明顯拉曼振動峰,分別在555、685、769、1 019、1 094、1 238、1 281、1 331、1 403、1 454、1 509、1 578和1 669 cm-1;.芽孢有13處明顯拉曼振動峰,分別在550、668、760、852、1 015、1 092、1 232、1 277、1 401、1 452、1 509、1 570和1 671 cm-1。這些拉曼特征峰分別歸屬于540 cm-1的蛋白質S-S鍵、661~674 cm-1的半胱氨酸C-S拉伸模式、761 cm-1的胞嘧啶和尿嘧啶、1 017 cm-1處為Ca2+-DPA、1 090 cm-1的DNA和O-P-O、1 235 cm-1的酰胺Ⅲ、1 270~1 280 cm-1范圍內為酰胺Ⅲ和脂質CH2(變形)、1 322~1 339 cm-1為核酸中腺嘌呤核酸、1 395 cm-1和1 440 cm-1的Ca2+-DPA、1 501cm-1的N=H折疊和腺嘌呤、1 570 cm-1的Ca2+-DPA、1 669 cm-1為酰胺Ⅰ的不飽和脂質。
三種不同的芽孢具有自身獨特的SERS峰位,不同的峰位歸屬于自身特有的化學鍵及振動形式。.芽孢在740 cm-1(細胞壁肽聚糖結構單元)、787 cm-1(酪氨酸C-N鍵拉伸振動)、821 cm-1(Ca2+-DPA)、1 203 cm-1(CH2延伸振動)、1 308 cm-1(酰胺Ⅲ)和1 627 cm-1(酰胺Ⅱ)波段顯示特有拉曼峰;.芽孢在852 cm-1(延伸CN酪氨酸;糖苷鍵延伸C-C)位移處出現特有拉曼峰。
除此之外,三種食源性芽孢的SERS圖譜在相同波段位置出峰的光譜峰相對強度顯著不同,結果如圖6所示。在1 017 cm-1(Ca2+-DPA)、1 081 cm-1(DNA、O-P-O)處峰位強度.芽孢>.芽孢>.芽孢,在1 332 cm-1(核酸中腺嘌呤核酸)、1 440 cm-1(Ca2+-DPA)處峰位強度.芽孢>.芽孢>.芽孢,三者兩兩之間峰位強度差距顯著;在1 570 cm-1(Ca2+-DPA)處.芽孢峰位強度遠高于.芽孢和.芽孢兩種芽孢,但.芽孢峰位強度略低于和.芽孢,差異不明顯;.芽孢在1 670 cm-1處峰位強度明顯低于.芽孢和.芽孢,而后兩種芽孢峰位強度沒有明顯差異。因此,拉曼譜峰特征有很大差異,可以明顯區分,進一步結合主成分分析和判別分析法對不同種屬的食源性芽孢進行鑒別分析。

圖5 三種食源性芽孢在400~1 800 cm-1光譜波段的SERS光譜及相差顯微鏡鏡檢圖

表2 三種芽孢SERS譜峰的暫定歸屬[18,21-25]
2.5 三種芽孢的SERS定性分析
為了更好實現不同食源性芽孢的定性識別,在400~1 800 cm-1的光譜波段范圍內,采用PCA和LDA對食源性芽孢樣本SERS圖譜進行分析。運用PCA分析方法,將復雜的光譜數據轉化為三維散點圖,以便直觀的觀察出相似光譜之間的細小差異,用以判別不同種類間的關系[26]。對.芽孢、.芽孢、.芽孢各10個樣本進行PCA分析,評估基于Au@AgNPs SERS基底采集的三種食源性芽孢拉曼圖譜之間的差異性。其分析結果如圖7所示。由圖7可知,PCA分析可以很明顯地將3種芽孢聚集成3個獨立的簇,每個簇獨立無重復,每種芽孢都能彼此區分開。PC1的方差貢獻率為76.04%,PC2的方差貢獻率為11.67%,PC3的方差貢獻率為5.19%,累計貢獻率達92.90%,基本代表了全部光譜信息。
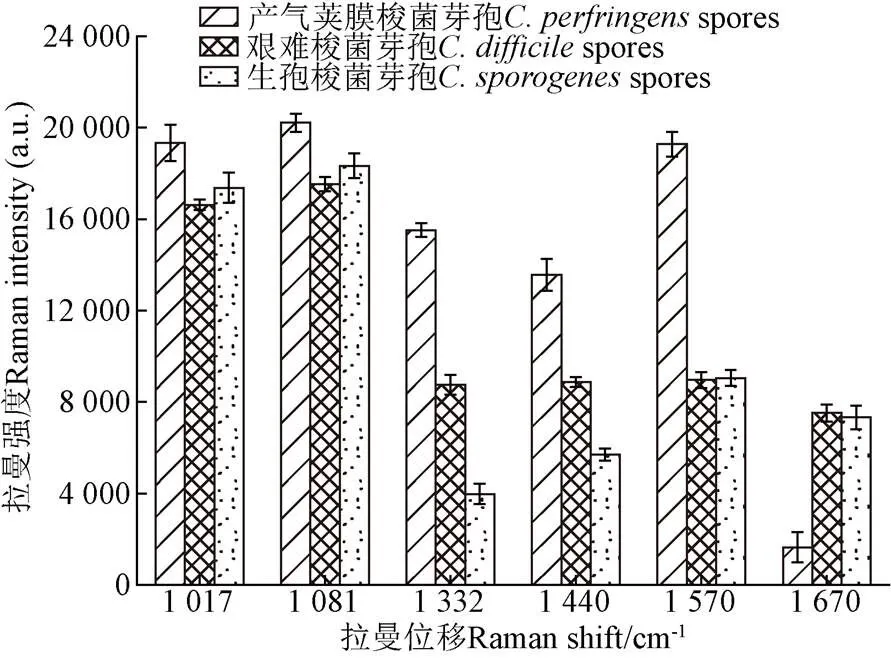
圖6 三種食源性芽孢SERS圖譜中相同出峰位置的峰強度對比
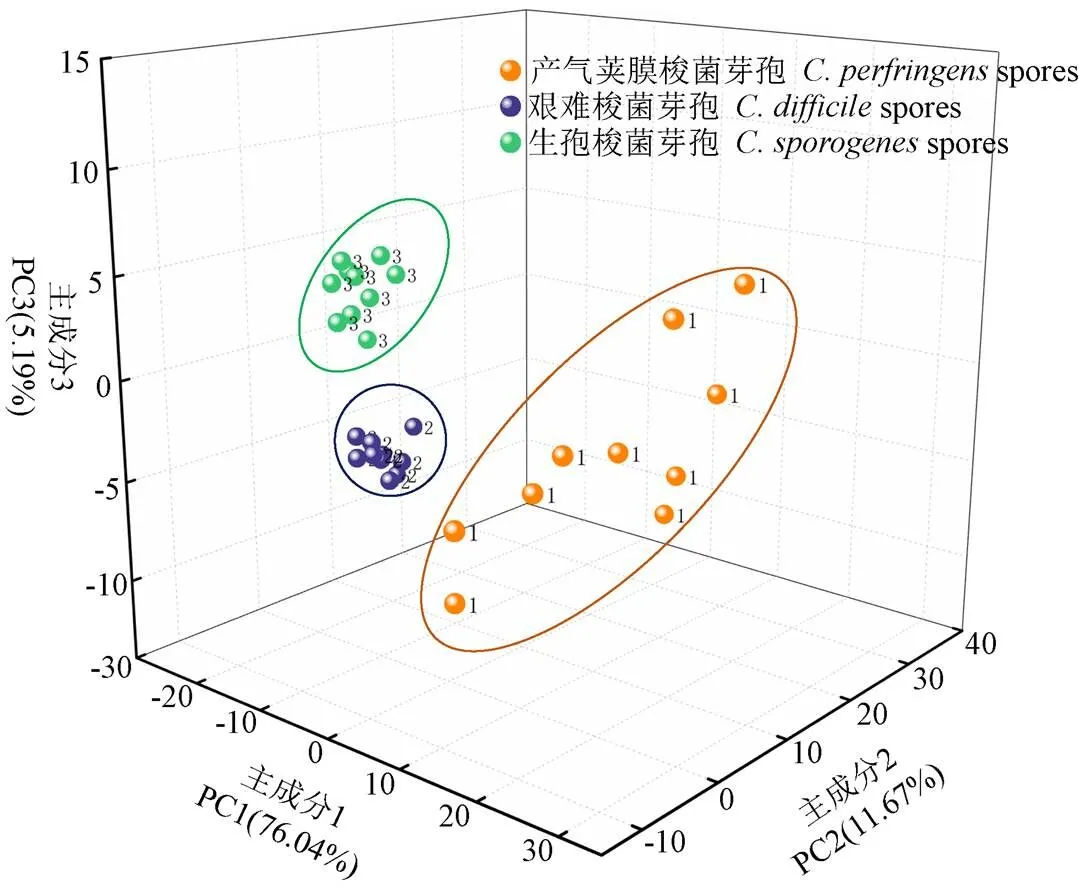
圖7 三種芽孢SERS圖譜主成分分析的三維散點圖
為了使三種芽孢分類效果更加理想,采用LDA對三種不同的芽孢進行區分。由圖8可知,LDA完全區分了三種食源性芽孢的SERS光譜,每種芽孢的所有樣本都集中在質心點附近的一個相對較小區域內,各區域間沒有交叉重疊,具有較好的靈敏性和特異性,識別率達到100%。留一法交叉驗證的將每一個樣本作為測試樣本,此方法主要用于樣本量少的情況,樣本量少于50時,一般采用留一交叉驗證,于是將采集到的3種食源性芽孢樣品的30條SERS光譜(每條光譜是積分3次得到的結果)通過“留一法”對判別模型進行交叉驗證[27-28],驗證靈敏度和特異度均為100%。與PCA相比,LDA考慮了不同樣品的類別信息,能使同種食源性芽孢樣品間的差異最小化,使不同食源芽孢樣品間的差異最大化。上述結果表明,結合PCA和LDA統計分析方法,可以實現對不同食源性芽孢的快速識別,為SERS定性識別食源性芽孢提供技術支持。

注:1、2、3分別為產氣莢膜梭菌芽孢、艱難梭菌芽孢和生孢梭菌芽孢。
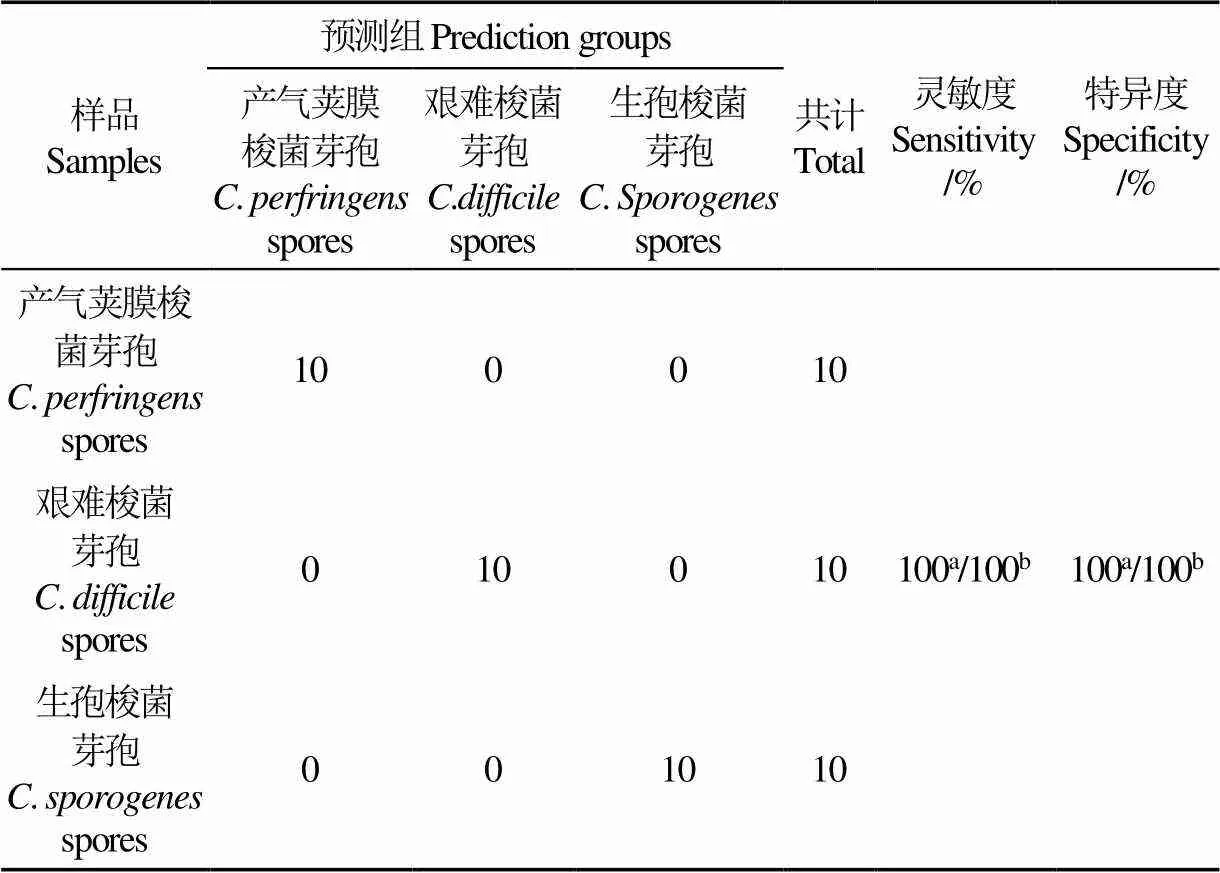
表3 三種食源性芽孢SERS光譜LDA模型的準確度
注:a表示未經交叉驗證的靈敏度和特異度;b代表交叉驗證下的靈敏度和特異度。
Note: a indicates the sensitivity and specificity without cross-validation; b represents the sensitivity and specificity under cross-validation.
3 結 論
1)本研究基于表面增強拉曼散射(Surface-enhanced Raman scattering,SERS)技術快速識別不同食源性芽孢,首先制備合成AuNPs、AgNPs、Au@AgNPs三種不同的溶膠納米材料,并對其進行了紫外可見分光光度計(UV-Visible Spectrophotometer,UV-Vis)、透射電鏡(Transmission Electron Microscope,TEM)和粒度分布進行表征,確定形貌特性。
2)將三種納米材料與食源性芽孢(.spores、.spores和.spores)偶聯,采集拉曼指紋圖譜,對比三種納米材料增強效果,Au@AgNPs對食源性芽孢的SERS增強效果最好,其增強因子達3.49×104,且光譜特異性和重現性良好。
3)分析了食源性芽孢的SERS圖譜差異性和重現性,結合化學計量學法構建快速識別模型,實現不同種屬食源性芽孢的快速識別。Ca2+-DPA的是三種食源性芽孢的共有標志特征峰,拉曼振動峰在1 017、1 440和1 570 cm-1波段顯示且峰強度不同。.芽孢在740、787、821、1 203、1 308和1 627 cm-1有獨特的拉曼峰,.芽孢在852 cm-1有獨特的拉曼峰,在1 017 cm-1(Ca2+-DPA)、1 081 cm-1(DNA、O-P-O)處峰位強度.芽孢>.芽孢>.芽孢,在1 332 cm-1(核酸中腺嘌呤核酸)、1 440 cm-1(Ca2+-DPA)處峰位強度.芽孢>.芽孢>.芽孢,三種食源性芽孢的SERS圖譜出峰位置和峰強度差異明顯。結合主成分分析(Principal Component Analysis,PCA)和線性判別分析(Linear Discriminant Analysis,LDA)構建定性識別模型,PCA前三個主成分的累計貢獻率達92.90%,LDA的識別率達到100%,說明以Au@AgNPs為基底的SERS技術檢測方法可以實現對食源性芽孢的快速識別,為食源性芽孢檢測和食品安全檢測提供了有效手段。
SERS技術具有高靈敏、干擾小和快速無損檢測等優點,在生化檢測及現場快速檢測方面有巨大優勢,在食源性致病菌快速鑒別方面具有廣闊的應用潛力和前景。盡管如此,SERS技術在食源性致病菌檢測中的實際應用依然面臨很大挑戰,大多數研究并沒有聚焦于實際樣品,食品中復雜的組成成分對檢測產生極大的干擾,給SERS技術在實際食品樣品中的微生物檢測應用帶來一定困難。如何避免去除實際應用中食品復雜組成成分的干擾,如何實現食品樣品中目標檢測微生物的分離富集和靶向捕獲等問題是SERS技術實際應用中需要突破的研究難點和研究熱點。因此,開發制備適用于不同檢測條件需求的SERS活性基底材料,將SERS技術與微流控、薄層層析(Thin-Layer Chromatography,TLC)和固相微萃取(Solid-Phase Microextraction,SPME)等技術手段融合,以期實現SERS技術在復雜環境背景下的實際應用。
[1] Singh H, Bhardwaj S K, Khatri M, et al. UVC radiation for food safety: An emerging technology for the microbial disinfection of food products[J]. Chemical Engineering Journal, 2021, 417: 128084.
[2] 劉慧,曾祥權,蔣世衛,等. 生物傳感器在食源性金黃色葡萄球菌快速檢測中的應用[J]. 食品科學,2022,43(1):372-381.
Liu Hui, Zeng Xiangquan, Jiang Shiwei, et al. Progress in biosensors for rapid detection of foodborne staphylococcus aureus[J]. Food Science, 2022, 43(1): 372-381. (in Chinese with English abstract)
[3] Liu S, Zhu Y, Li M, et al. Rapid identification of different pathogenic spore-forming bacteria in spice powders using surface-enhanced raman spectroscopy and chemometrics[J]. Food Analytical Methods, 2022, 15(10): 2810-2820.
[4] 王海陽,劉燕德,張宇翔. 表面增強拉曼光譜檢測臍橙果皮混合農藥殘留[J]. 農業工程學報,2017,33(2):291-296.
Wang Haiyang, Liu Yande, Zhang Yuxiang. Detection of mixed pesticide residues in navel orange peel by surface-enhanced Raman spectroscopy[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(2): 291-296. (in Chinese with English abstract)
[5] Lan J, Hassan M M, Ali S, et al. Evolving trends in SERS-based techniques for food quality and safety: A review[J]. Trends in Food Science & Technology, 2021, 112: 225-240.
[6] He J F, Li X, Li J. Facile construction of silver nanocubes/graphene oxide composites for highly sensitive SERS detection of multiple organic contaminants by a portable Raman spectrometer[J]. Journal of Environmental Chemical Engineering, 2022, 10(5): 2213-3437.
[7] Lebrun A, Fortin H, Fontaine N, et al. Pushing the limits of surface-enhanced Raman spectroscopy (SERS) with deep learning: Identification of multiple species with closely Related Molecular Structures[J]. Applied Spectroscopy, 2022, 76(5): 609-619.
[8] Lei Z, Cheng D, Sha X, et al. Multifunctional g-C3N4/Ag NPs intercalated GO composite membrane for SERS detection and photocatalytic degradation of paraoxon-ethyl[J]. Chemical Engineering Journal, 2020, 402: 1385-8947.
[9] Xu J, Cheng C, Shang S, et al. Flexible, reusable SERS substrate derived from ZIF-67 by adjusting LUMO and HOMO and its application in identification of bacteria[J]. ACS Applied Materials & Interfaces, 2020, 12(44): 49452-49463.
[10] Bozkurt A G, Buyukgoz G G, Soforoglu M, et al. Alkaline phosphatase labeled SERS active sandwich immunoassay for detection of[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2017, 194: 8-13.
[11] Chen L, Mungroo N, Daikuara L, et al. Label-free NIR-SERS discrimination and detection of foodborne bacteria by in situ synthesis of Ag colloids[J]. Journal of Nanobiotechnology, 2015, 13(1): 45-54.
[12] Kearns H, Goodacre R, Jamieson L, et al. SERS detection of multiple antimicrobial-resistant pathogens using nanosensors[J]. Analytical Chemistry, 2017, 89(23): 12666-12673.
[13] Khalaf Mai M, El-Senduny Fardous Fm, Abd El-Lateef Hany M, et al. Crystalline Gold nanoparticles adjusted by carboxymethyl cellulose and citrate salt: Fabrication, characterization, and in vitro anticancer activity[J]. Journal of Molecular Liquids, 2021, 340: 0167-7322.
[14] Zhu Y D, Liu W J, Liu S J, et al. Preparation of AgNPs self-assembled solid-phase substrate via seed-mediated growth for rapid identification of different bacterial spores based on SERS[J]. Food Research International, 2022, 160: 0963-9969.
[15] 汪崇文. 高性能磁性SERS基底的制備及應用研究[D]. 北京:北京工業大學,2018.
Zhao Lei. Study on the Preparation and Performance of Noble Metal-based Composite SERS Substrates[D]. Beijing: Academy of Military Sciences, 2021. (in Chinese with English abstract)
[16] Song Y, Chen J L, Yang X B, et al. Fabrication of Fe3O4@Ag magnetic nanoparticles for highly active SERS enhancement and paraquat detection[J]. Microchemical Journal, 2022, 173: 107019.
[17] Francis M K, Sahu B K, Bhargav P B, et al. Ag nanowires based SERS substrates with very high enhancement factor[J]. Physica E: Low-dimensional Systems and Nanostructures, 2022, 137: 1386-9477.
[18] 郭霖. 表面等離子體共振效應對電荷轉移過程影響的SERS探究[D]. 長春:吉林大學,2021.
Guo Lin. Investigation the Effect of Surface Plasmon Resonance on Charge Transfer Process Using Surface-enhanced Raman Scattering[D]. Changchun: Jilin University, 2021. (in Chinese with English abstract)
[19] Ma Y, Du Y, Chen Y, et al. Intrinsic Raman signal of polymer matrix induced quantitative multiphase SERS analysis based on stretched PDMS film with anchored Ag nanoparticles/Au nanowires[J]. Chemical Engineering Journal, 2020, 381(C): 1385-8947.
[20] 劉世杰,朱瑤迪,李苗云,等. 基于SERS技術的食源性致病菌芽孢拉曼光譜特征結構分析及快速識別[J]. 光譜學與光譜分析,2022,42(9):2774-2780.
Liu Shijie, Zhu Yaodi, Li Miaoyun, et al. Raman spectroscopic characteristic structure analysis and rapid identification of food-borne pathogenic bacteria spores based on SERS technology[J]. Spectroscopy and Spectral Analysis, 2022, 42(9): 2774-2780. (in Chinese with English abstract)
[21] Wod A, Mim A, Hn A, et al. Surface-enhanced Raman spectroscopy for identification of food processing bacteria[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2021, 261: 1386-1425.
[22] Evelin W, Dorota K, Aneta K, et al. Surface-enhanced Raman spectroscopy introduced into the International Standard Organization (ISO) regulations as an alternative method for detection and identification of pathogens in the food industry[J]. Analytical and Bioanalytical Chemistry, 2017, 409(6): 1555-1567.
[23] Zhu Y D, Liu S J, Li M Y, et al. Preparation of an AgNPs@Polydimethylsiloxane (PDMS) multi-hole filter membrane chip for the rapid identification of food-borne pathogens by surface-enhanced Raman spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2022, 267(2): 1386-1425.
[24] Kashif M, Majeed M I, Nawaz H, et al. Surface-enhanced Raman spectroscopy for identification of food processing bacteria[J]. Spectrochimica acta. Part A, Molecular and Biomolecular Spectroscopy, 2021, 261: 1386-1425.
[25] Guo Z M, Wang M M, Barimah A O, et al. Label-free surface enhanced Raman scattering spectroscopy for discrimination and detection of dominant apple spoilage fungus[J]. International Journal of Food Microbiology, 2021, 338: 108990.
[26] 黃雙根,吳燕,胡建平,等. 大白菜中馬拉硫磷農藥的表面增強拉曼光譜快速檢測[J]. 農業工程學報,2016,32(6):296-301.
Huang Shuanggen, Wu Yan, Hu Jianping. et al. Rapid detection of malathion pesticide in Chinese cabbage by surface-enhanced Raman spectroscopy[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(6): 296-301. (in Chinese with English abstract)
[27] 蔣海俊. 正則化雙邊二維線性判別分析[D]. 昆明:云南財經大學,2021.
Jiang Haijun. Regularized Bilateral Two-Dimensional Linear Discriminant Analysis[D]. Kunming: Yunnan University of Finance and Economics, 2021. (in Chinese with English abstract)
[28] 文冰梅,趙聯文,黃磊. AIC準則與留一法交叉驗證漸近等價的證明[J]. 統計與決策,2022,38(6):40-43.
Wen Bingmei, Zhao Lianwen, Huang Lei. Proof of the asymptotic equivalence between AIC criterion and LOOCV[J]. Statistics and Decision, 2022, 38(6): 40-43. (in Chinese with English abstract)
Enhanced performance comparison of substrate materials and rapid detection of foodborne bacterial spores based on SERS
Tian Jiaqi1, Li Miaoyun1,2, Zhu Yaodi1,2※, Zhao Lijun1,2, Liu Shijie1,2, Liu Weijia1, Jiang Pei3, Zhao Gaiming1,2, Xu Lina1,2, Sun Lingxia1,2, Ma Yangyang1,2, Liang Dong1,2
(1.,450002,;2.,450002,;3.,450006,)
The spores of foodborne pathogens are hardly eradicated in the food industry, due to the extreme resistance. The potential risks to food safety have been from the serious foodborne diseases upon germinating and infecting. Taking three common pathogenic,andspores as the research objects, rapid identification was proposed using Surface-enhanced Raman spectroscopy (SERS). A comparison was made on the enhancing ability of three noble-metal colloids substrate of AuNPs, AgNPs, and Au@AgNPs. An optimal SERS substrate material was then achieved to rapidly identify the fingerprints of foodborne spores. Three noble metal nanoparticle colloids SERS substrates were fabricated via hydrothermal reduction. The irregular spherical structure was obtained with an average size of 82.26 nm AuNPs, 49.83 nm AgNPs, and 57.85 nm Au@AgNPs. Notably, the structure of Au core and Ag shell indicated the successful preparation of Au@AgNPs. The uniform AgNPs and Au@AgNPs with the nano-scale distribution were superior to the AuNPs. Particularly, the homogeneous nanostructure provided a solid foundation for excellent SERS performance and signal reproducibility. The nanoparticle morphologies were characterized by a field-emission scanning electron microscope. The prominent characteristic peaks were selected in the spectra of spores for further analysis of enhancement performance. Among them, the Ca2+-DPA was known as the biomarker for the inner core of spores. The results showed that the optimal SERS performance of Au@AgNPs was achieved to detect the foodborne pathogenic spores with an analytical enhancement factor (AEF) of 3.49×104, indicating excellent spectroscopic specificity and signal reproducibility. According to the Raman shift and characteristic peaks, the characteristic peaks of Ca2+-DPA around 1 017, 1 440, and 1 570 cm-1were the common specific peaks but with different intensities. Specifically, thespores presented the specific characteristic peaks at around 740, 787, 821, 1 203, 1 308, and 1 627 cm-1, whereas, the specific characteristic peaks at 852 cm-1were found in thespores. The intensities of characteristic peaks at 1 017 cm-1(Ca2+-DPA), and 1 081 cm-1(DNA, O-P-O) were ranked in the order of the>>spores. However, the intensity at around 1332 cm-1(adenine nucleic acid in nucleic acid) and 1 440 cm-1(Ca2+-DPA) ofspores was stronger than that ofspores, but lower than that ofspores, indicating the remarkable differences of Raman shifts and intensity in SERS spectra of three spores. A qualitative identification and discrimination model was established to combine the SERS spectra of three spores with the multivariate statistical analysis (PCA and LDA). The PCA demonstrated that the accumulated variance contribution rate for the top three principal components was up to 92.90%, and the recognition rate of LDA analysis reached 100%, fully meeting the specificity and sensitivity. The SERS performances of three noble-metal nanoparticles substrates were utilized to analyze the fingerprints spectra of three spores using SERS and multivariate statistical analysis. A rapid and accurate performance was achieved in the classification and identification of the different strains, indicating the favorable purpose of detection. An effective and reliable risk detection can be expected to serve as the food safety control and rapid identification of microorganisms as a bio-sensor platform. The finding can provide a strong reference for safety control in the subsequent food processing.
spectral analysis; models; Surface-enhanced Raman spectroscopy (SERS); colloid nanomaterials; food-borne spores; rapid identification
10.11975/j.issn.1002-6819.2022.20.029
O657.3
A
1002-6819(2022)-20-0257-09
田家齊,李苗云,朱瑤迪,等. 基于SERS技術的基底增強效應對比及食源性芽孢快速檢測[J]. 農業工程學報,2022,38(20):257-265.doi:10.11975/j.issn.1002-6819.2022.20.029 http://www.tcsae.org
Tian Jiaqi, Li Miaoyun, Zhu Yaodi, et al. Enhanced performance comparison of substrate materials and rapid detection of foodborne bacterial spores based on SERS[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(20): 257-265. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.20.029 http://www.tcsae.org
2022-06-07
2022-10-01
河南省杰青項目(212300410008);河南省高等學校重點科研項目(22A550013);河南省高校科技創新團隊支持計劃項目(22IRTSTHN021);河南省科技攻關項目(212102110081,212102110334);河南省市場監管管理局科技計劃項目(2022sj81);小麥玉米作物國家重點實驗室開放課題項目(30501006)
田家齊,碩士,研究方向為肉類加工與質量控制。Email:tianjiaqi1023@163.com
朱瑤迪,博士,副教授,研究方向為食品無損檢測。Email:zhu_yaodi@163.com

