治療食管癌的pH敏感多肽水凝膠的設計與研究*
朱春香,吳軼群,田天立,陳曉慶,張 晴,姚 勇,葛 亮**
1南京高新醫院藥劑科,南京 211800;2中國藥科大學藥學院,南京211100
食管癌是一種高發病率與死亡率的惡性腫瘤,最新資料顯示,其發病率在全球所有癌種中居第8位,病死率居第6位,手術治療、放療以及化療是最常見的食管癌治療方式[1,2],然而傳統化療藥物靶向性不佳、藥物不良反應嚴重[3,4]等問題嚴重影響了食管癌的治療效果。阿霉素(doxorubicin,DOX)作為蒽環類廣譜非特異性小分子抗癌藥物,對多種實體瘤具有良好的療效;但是存在生物利用度低、心臟毒性強以及腫瘤耐藥等缺點[5]。目前,已見多種脂質體、膠束等輔助納米載體進行藥物遞送以彌補阿霉素的缺陷,但這些載體也存在一定局限性,例如載藥能力差、代謝產物具有毒性、易引發免疫應答而影響治療效果[6,7]。因此亟需設計一種安全高效的藥物載體提高阿霉素載藥量、緩釋能力、靶向性并降低毒副作用。
水凝膠作為一種特殊的藥物載體,具有優異的理化性質、可控的降解性和緩控性,受到了廣泛關注[8]。凝膠是由交聯聚合物在延伸流體中形成的三維網絡交聯體系;當凝膠的分散介質是水時,稱之為水凝膠:它對水和其他體液(如血清、血漿)具有高度親和力,其質量可達到凝膠干重的數千倍,同時不溶于這些流體[9]。根據是否能隨著外界環境的改變發生相應的變化,將水凝膠分為普通水凝膠和響應性水凝膠。前者對環境變化不敏感,而后者的性質(如溶脹行為、結構、機械強度、滲透率等)能夠隨外界物理或化學條件的刺激發生改變[10]。在受到溫度、pH 值、光、機械應力、溶劑、壓力等刺激時,響應性水凝膠可通過自身結構的可逆膨脹或收縮,發生溶膠-凝膠相轉變,從而控制藥物的釋放[11]。而根據外界刺激的不同,響應性水凝膠主要分為溫敏性、pH敏感性、光敏性及多敏感性水凝膠[12]。多肽水凝膠由氨基酸組成,其自組裝過程自發可逆,無需使用化學交聯劑來引發溶液-凝膠之間的轉化,其體內降解產物無毒無害且代謝完全。自組裝多肽水凝膠的高含水量和納米級多肽纖維能夠包封用于組織工程的細胞或生物活性分子,包括抗腫瘤藥物和蛋白質[13,14]。由于其制備過程簡單便利,具有非免疫原性、可生物降解、可注射、可局部給藥等優點,為納米醫學應用提供了一個理想的平臺。
本課題設計了一種基于pH 響應性多肽水凝膠裝載DOX 的藥物遞送系統用于食管癌治療的研究,其中多肽FOVVVEF 兩端的苯丙氨酸(F)能夠提供π-π 作用力以及疏水作用力,有利于多肽形成β折疊構象,而堿性氨基酸鳥氨酸(O)在pH 降低時質子化程度增強,多肽之間的靜電斥力增大并促進多肽水凝膠的瓦解,形成了多肽水凝膠的pH 敏感性。在治療時將其原位埋置于腫瘤部位,在腫瘤微酸環境中水凝膠結構瓦解,快速且穩定地釋放DOX,極大提高了藥物的局部緩釋能力,在提高療效的同時又減少了藥物毒副作用。
1 材料與方法
1.1 材料
FOVVVEF 購自南京杰肽公司;鹽酸阿霉素購自上海源葉公司;CCK-8 試劑盒購自上海翌圣生物公司;小鼠食管癌細胞(AKR)、人正常食管上皮細胞(HEEC)購自美國模式培養物集存庫(ATCC);DMEM、1640 培養基購自美國Gibco 公司;胎牛血清購自美國Hyclone 公司;DAPI 購自碧云天生物技術公司;水為超純水。
1.2 實驗儀器
電子天平(BSA-124S,德國SARTORIUS 有限公司);飛鴿離心機(TDL-80-2B,上海安亭科學儀器有限公司);反向高效液相色譜儀(LC-8A,日本島津公司);LC-MS(G6545A Q-TOF with 1290 Infinity II LC,美國Agilent 公司);紫外/可見分光光度計(UV-1800,日本島津公司);圓二色譜儀(J-810,日本JASCO 公司),旋轉流變儀(HAAKE 600,美國Thermo Fisher Scientific 公司);透射電子顯微鏡(HT-7700,日本日立公司);多功能酶標儀(ELx800,美國BioTek Instruments 公司);倒置熒光顯微鏡(IX73,日本Olympus 公司)。
1.3 方法
1.3.1 多肽的合成、純化與確證 序列為FOVVVEF的多肽使用固相多肽合成法由南京杰肽公司合成。稱取適量多肽粗品,以水為溶劑,配制成10 mg·mL-1的溶液,用0.45 μm 水相微孔濾膜過濾后使用RPHPLC 系統進行純化。
色譜條件:島津C18柱(4.6 mm×250 mm,5 μm);檢測波長:214 nm;流動相:0.1%四氫呋喃(TFA)/水(v∶v)-0.1%TFA/乙腈(v∶v);流速:5 mL·min-1;洗脫時間:45 min。
線性洗脫后,通過制備液相色譜收集目標峰,除去有機溶劑,冷凍干燥后即可得到多肽純品。稱取適量上述制備液相純化得到的各個多肽樣品,以水為溶劑,配制成濃度為1 mg·mL-1的多肽溶液,用0.22 μm 水相微孔濾膜過濾,使用LC-MS 分析儀進行結構確證。
1.3.2 多肽水凝膠的制備 制備適合濃度的多肽溶液(10~20 mg·mL-1),渦旋使多肽粉末在水中充分溶解,離心除去殘留氣泡,測得多肽溶液的pH 為6.0,以0.25 mol·L-1NaOH 溶液調節pH 至7.4,渦旋混勻,靜置5 min 觀察多肽溶液的成膠狀態;在制備載藥水凝膠時,于多肽溶液中加入1 mg·mL-1或2 mg·mL-1的鹽酸阿霉素,按上述步驟使得多肽溶液成膠。
1.3.3 TEM 使用透射電子顯微鏡(TEM)來觀察多肽在不同條件下的納米微觀結構。制備pH 7.4和pH 5.8 的多肽水凝膠,待所制備的凝膠穩定后,吸取20 μL 并稀釋10倍,稀釋液即為含有多肽納米纖維的溶液。吸取一滴稀釋液滴至碳涂層銅網上,3 min 后用濾紙吸去多余液體,再吸取一滴2%磷鎢酸溶液至銅網上,作樣品復染,3 min 后吸去多余染色劑,在紅外燈下烘干。將制作好的多肽樣品放入透射電子顯微鏡下,觀察其微觀結構。
1.3.4 圓二色譜 根據J-810 圓二色譜儀上的標準使用方法,制備20 mg·mL-1的多肽水凝膠,分別溶于pH 7.4 和pH 5.8 的磷酸鹽(PBS)緩沖液中,配制成濃度為0.2 mg·mL-1的多肽溶液,作為圓二色譜(CD)檢測的樣品,并以相應的PBS 緩沖液作為空白溶液。儀器預熱后,用相應的PBS 溶液潤洗圓型比色池3次,掃描該溶液作為空白;后用樣品潤洗圓型比色池3次,加入樣品并掃描檢測其二級結構。
1.3.5 流變學檢測 制備空白水凝膠和包載DOX的多肽水凝膠,在室溫下靜置12 h。使用旋轉流變儀進行動態頻率掃描。開機預熱,安裝固定直徑為25 mm 的圓形椎體,并將儀器溫度設置為37℃,將水凝膠轉移到圓形椎骨后緩慢降低上層椎板,水凝膠靜置30 min 后進行流變測試。動態頻率掃描的參數設置如下:頻率為0.1~10 rad·s-1,剪切力為1%,測試時間為15 min。測量后,以頻率為橫坐標,儲能模量(G′)和耗能模量(G″)為縱坐標,觀察多肽水凝膠的機械強度變化。
1.3.6 體外藥物釋放 制備不同多肽以及DOX 濃度的載藥水凝膠,將水凝膠穩定一夜,于第二天在管中加入200 μL PBS 緩沖液(pH 7.4 以及pH 5.8)作為凝膠釋放液并記為0 h,在0、0.5、1、2、4、8、12、24、48、72、96、120、144、168 h 分別收集釋放液并加入等體積的新鮮釋放液。配制不同濃度的DOX溶液并使用紫外/可見分光光度計在波長499 nm 處讀取DOX 吸光度,繪制標準曲線;分別計算釋放液中DOX 對應質量并計算累計藥物釋放量與累計釋放百分比。
1.3.7 細胞培養 當AKR 食管癌細胞/HEEC 食管上皮細胞生長密度達到80%~90%時,棄去培養基并加入3 mL PBS 緩沖液清洗細胞,加入1 mL 含0.02% EDTA 的0.25%胰蛋白酶消化細胞約1 min,吸出大部分胰酶并將培養瓶轉移至培養箱中繼續消化2 min,待細胞變圓變亮后,加入3 mL 新鮮培養基終止消化,將細胞重懸液吹勻并棄去2 mL,加入4 mL 新鮮DMEM/1640+10% FBS 培養基,分別從上、下、左、右四個方向搖動培養瓶,使重懸液均勻分布,然后將細胞放入培養箱中進一步培養。
1.3.8 生物相容性 用CCK-8 試劑盒考察空白水凝膠的生物相容性。將HEEC 細胞以5×104個/mL 的密度接種至96 孔板中,每孔100 μL,接種完成后置于37℃恒溫培養箱中孵育24 h。將多肽溶于培養基中,使多肽終濃度為0、1、10、50、100、500 μg·mL-1,0.22 μm 濾膜過濾后替換原培養基,48 h 后避光加入10 μL CCK-8 試劑,繼續以37℃恒溫培養1.5 h,使用酶標儀檢測吸光度A值,設定檢測波長為450 nm,細胞存活率公式如下:

1.3.9 細胞攝取實驗 按照“1.3.7”項下培養AKR細胞并將其接種于6 孔板中,孵育培養24 h,使其貼壁穩定。棄去原培養基,加入含有pH 5.5 和pH 7.4 條件下載藥水凝膠48 h 釋放液的新鮮培養基,設置對照組,繼續孵育培養4 h。棄去含藥培養基,PBS 緩沖液潤洗3遍,用4%的多聚甲醛固定細胞,30 min 后使用0.5 μg·mL-1DAPI 對細胞核進行染色,PBS 緩沖液漂洗3遍,使用熒光顯微鏡觀察AKR 細胞對DOX 的攝取情況。
1.3.10 體外抗腫瘤實驗 制備1.0 mg·mL-1DOX母液,使用0.22 μm 濾膜過濾除菌,用DMEM 培養基將其稀釋至實驗所需藥物濃度(0.1、1、10、20、50μg·mL-1)后備用。制備載藥水凝膠(水凝膠中藥物在釋放液中完全釋放后的濃度與游離藥物的濃度相對應),分別收集pH 5.5 和pH 7.4條件下載藥水凝膠48 h釋放液,過濾后按照每孔100 μL 的體積加入96 孔板中,孵育48 h,使用CCK-8 試劑盒檢測細胞毒性。
2 結果與討論
2.1 多肽的合成與驗證
通過多肽固相合成法得到白色FOVVVEF 多肽粉末,高效液相色譜法測得多肽粉末的純度為96.37%(圖1A),其符合后續實驗要求。ESI-MS 質譜結果顯示,多肽的實際分子量為854.03(圖1B),與理論值一致,證明分離純化后多肽均為所需目標多肽。
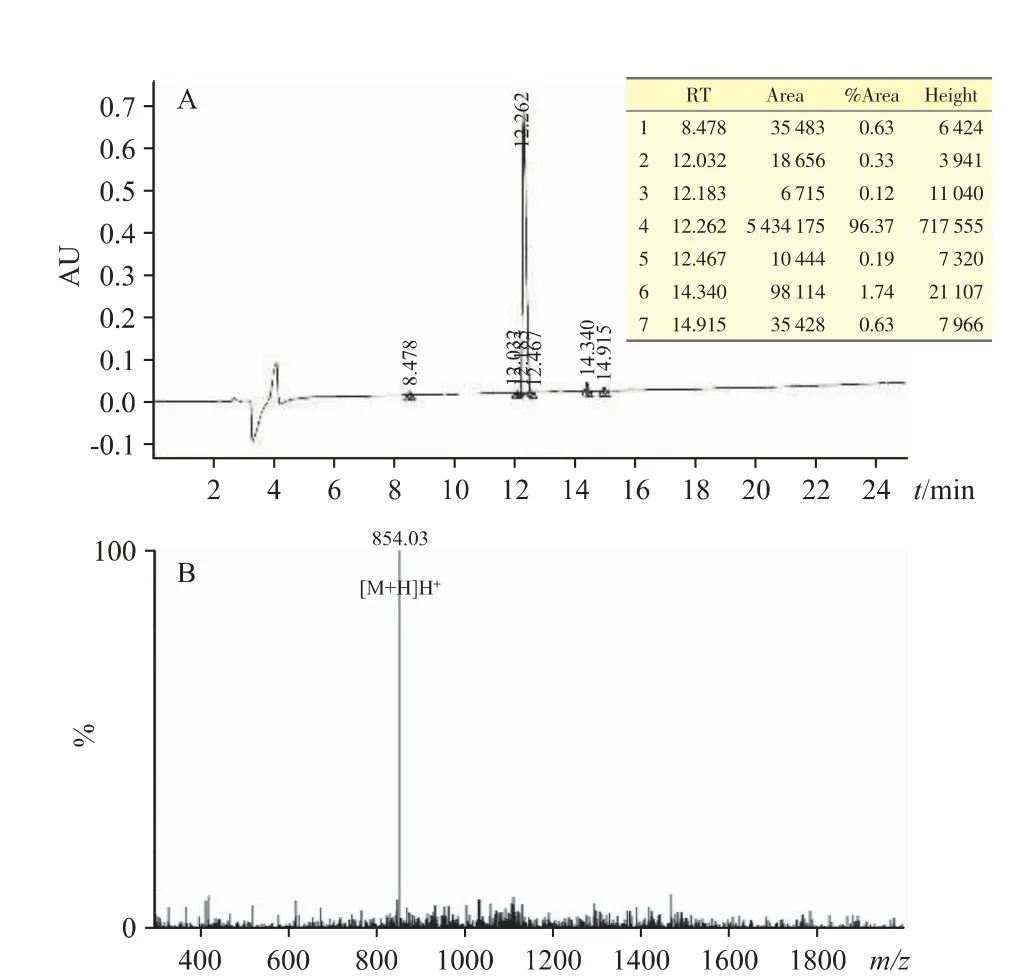
圖1 (A)FOVVVEF 多肽HPLC 圖譜;(B)FOVVVEF 多肽ESI-MS 質譜圖
2.2 多肽的性質測定
2.2.1 多肽的成膠性能及其篩選 稱取FOVVVEF多肽粉末2 mg 置于EP 管中并加入100 μL 純水(使濃度為20 mg·mL-1),旋渦5 min 使多肽與水充分混合,使用濃度為0.25 mol·L-1的氫氧化鈉溶液調節pH,靜置5 min 觀察結果見圖2。

圖2 FOVVVEF 多肽在(A)pH 5.5 和(B)pH 7.4 時狀態
制備的FOVVVEF 水凝膠能夠在中性環境中形成穩定的結構,在腫瘤微酸環境中釋放藥物,以降低載藥水凝膠對正常組織的毒性。通過氫氧化鈉調節并觀察在pH 5~8 范圍內該多肽的成膠情況,如圖2 所示,FOVVVEF 在濃度為20 mg·mL-1、pH 7.4的條件下能夠形成穩定的水凝膠,由此后續實驗對該水凝膠進行理化性質測定。
2.2.2 透射電鏡 利用TEM 對多肽凝膠的微觀形態進行直接清晰的表征,如圖3 所示。在酸性條件下(pH 5.8),多肽水凝膠主要有較短的納米纖維構成,短纖維分布松散,形態為條狀細長型,略微蜷曲,直徑約50 nm,長度在0.5~1.5 μm。在中性條件下(pH 7.4),多肽水凝膠成聚集的直棒網狀結構,交織扎堆層疊,直徑約50 nm,長度在0.5~1.5 μm,其網格結構中的空隙可以有效鎖住水分子,包載藥物,為抗腫瘤藥物的運輸提供有力支撐。從TEM 結果證實,FOVVVEF 多肽水凝膠在酸堿度環境不同時,微觀形態呈現明顯的差異,具有顯著的pH 敏感性。

圖3 (A)pH 5.8 和(B)pH 7.4 環境下FOVVVEF 多肽水凝膠的透射電子顯微鏡圖像,標尺為500 nm
2.2.3 圓二色譜 根據多肽二級結構的標準圓二色譜圖[15]可知:在190~240 nm 的紫外區段,α 螺旋結構在192 nm 波段附近有一正峰,在208、222 nm波段處呈兩個負的肩峰;β 折疊二級結構在217 nm波段附近有一負峰,在185~200 nm 波段有一強的正峰。FOVVVEF 水凝膠在pH 5.8 和pH 7.4 水溶液中的CD 光譜如圖4 所示:藍色線代表pH 為7.4時的圓二光色譜圖,在205 nm 處有最大吸收峰,在220 nm 處有一峰谷,波形接近β 折疊結構;綠色色線代表pH 為5.8 時的圓二光色譜圖,波形和藍線相似,但CD 值相對較小,波形靠下,且在波長198 nm處有一負峰,除了β 折疊結構外還存在其他類型的二級結構。
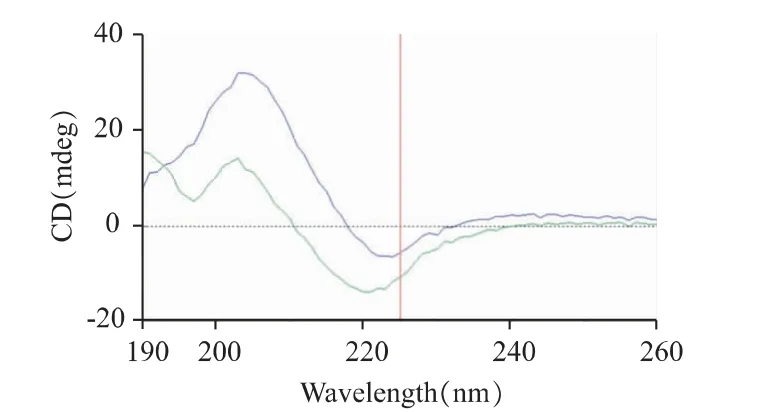
圖4 在pH 5.8(綠線)和pH 7.4(藍線)環境下FOVVVEF的圓二色譜圖
2.2.4 流變性 流變學是常用作測定自組裝多肽水凝膠相對機械剛度的方法。為了考察FOVVVEF水凝膠是否具有較好的機械剛度和穩定性,本課題組對多肽水凝膠和載藥多肽水凝膠進行了動態應變掃描,結果如圖5 所示。在1%應變、0.1~100 rad·s-1的動態頻率掃描下,多肽水凝膠和載藥多肽水凝膠均處于線性粘彈性區域。在線性粘彈區間內,兩者的儲能模量G′遠大于損耗模量G″,表明多肽水凝膠和載藥多肽水凝膠具有一定的機械強度,宏觀上表現為不具備流動性的固體穩定狀態,且兩者的儲能模量和耗能模量十分相近,可見載藥幾乎不會對該多肽水凝膠的結構產生影響。可得出FOVVVEF 水凝膠具有剛性固體性質,可以作為一種穩定的藥物遞送載體材料。
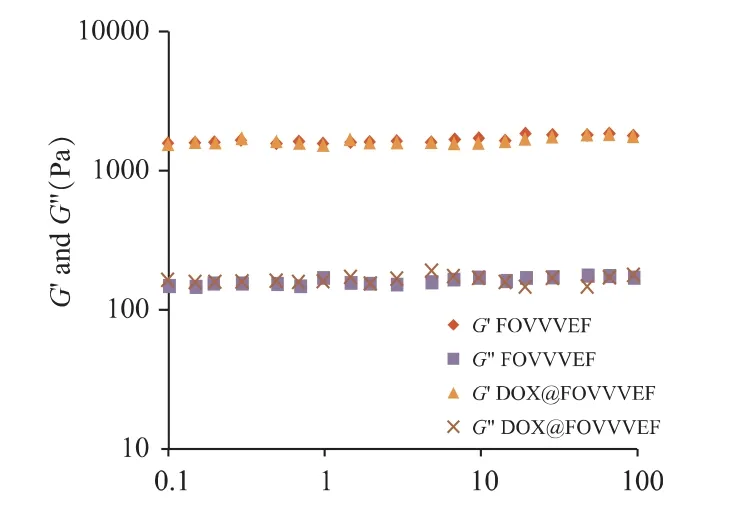
圖5 FOVVVEF 的動態應變掃描
2.3 藥物釋放
通過測量阿霉素標準品的吸光度,得到阿霉素濃度和吸光度之間的線性范圍:0.4~60 μg·mL-1,線性關系:Y=0.017 8X+0.004 7,相關系數:r2=0.999 2,X為DOX 濃度(μg·mL-1),Y 為吸光度A。
為了探究FOVVVEF 水凝膠在生物體內腫瘤部位的釋藥特點、藥物裝載情況,本課題采用不同pH的釋放介質以及不同裝載量,考察FOVVVEF 載藥水凝膠的釋放行為。分別制備了4 份不同的載藥水凝膠,多肽濃度均為20 mg·mL-1,DOX 的濃度和pH值分別為1 mg·mL-1(pH 5.8)、1 mg·mL-1(pH 7.4)、2 mg·mL-1(pH 5.8)、2 mg·mL-1(pH 7.4)。將0、0.5、1、2、4、8、12、24、48、72、96、120、144、168 h 吸取的釋放液通過紫外/可見分光光度計測量吸光度,對數據進行處理后得到藥物累積釋放量并計算累計釋放百分比。
如圖6 所示,當pH 5.8時,無論載藥水凝膠中DOX 的濃度為1 mg·mL-1還是2 mg·mL-1,其168 h的藥物釋放百分比無明顯差異,分別為89.9%和91.3%。而當pH 7.4時,兩者的DOX 釋放百分比分別為24.3%和26.7%,其數值顯著低于pH 5.8 時的數值,表明FOVVVEF 多肽水凝膠有較好的酸響應性與藥物釋放能力,在中性生理條件下具有較好的包封效果。
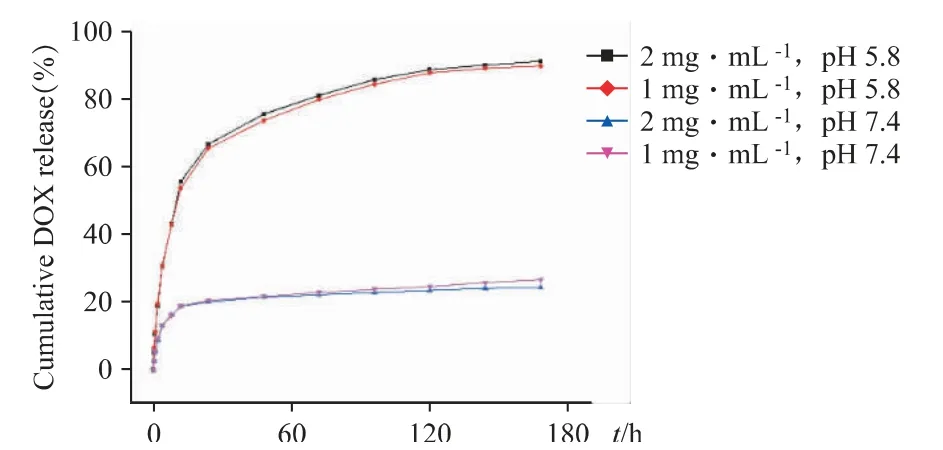
圖6 DOX@FOVVVEF 水凝膠在不同pH 條件和不同載藥濃度下的累積釋放百分比
2.4 生物相容性
驗證載藥水凝膠的抗腫瘤效果之前需保證該載體材料具有良好的生物相容性。FOVVVEF 自組裝多肽水凝膠的生物相容性結果如圖7 所示。給予HEEC 細胞不同濃度的FOVVVEF 多肽并作用48 h,發現即使多肽濃度高達500 μg·mL-1時,HEEC 細胞的存活率仍高于90%,表明FOVVVEF 多肽具備良好的生物相容性,是一種安全的藥物載體。
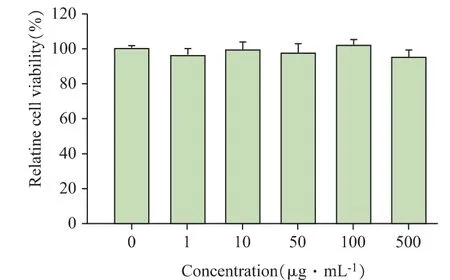
圖7 HEEC 細胞與不同濃度FOVVVEF 多肽共孵育48 h后的細胞活力
2.5 載藥水凝膠的細胞毒性
2.5.1 CCK-8 實驗 通過CCK-8 實驗考察DOX@FOVVVEF 水凝膠的體內抗腫瘤活性。如圖8所示,隨著藥物濃度升高,AKR 細胞存活率均逐漸降低。其中,在DOX 藥物濃度為10μg·mL-1以及20μg·mL-1時,pH 5.8 釋放條件下的細胞比在pH 7.4 時出現了更加顯著的細胞死亡。
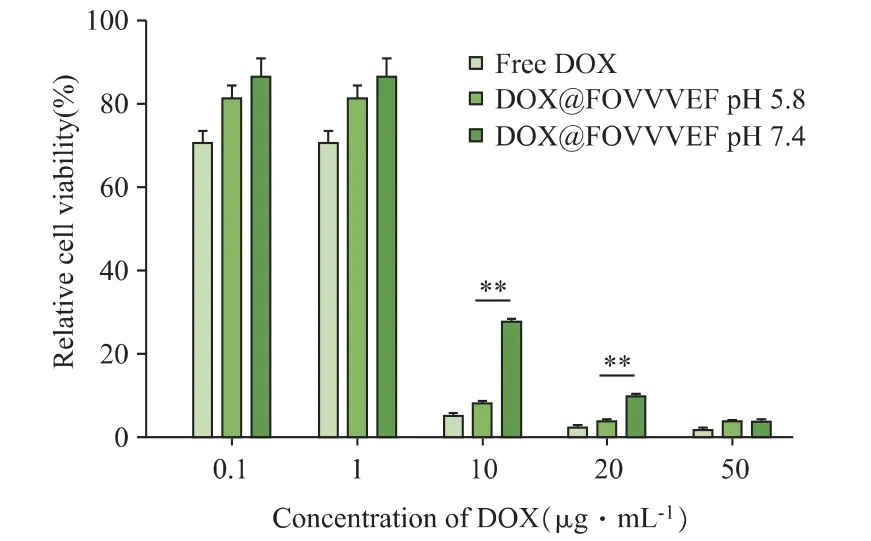
圖8 游離DOX 以及DOX@FOVVVEF 在pH 5.8 和pH 7.4 的釋放液共孵育48 h 的AKR 細胞活力,**P <0.001
2.5.2 細胞攝取實驗 通過細胞攝取實驗,驗證不同pH 條件下細胞死亡程度的差異是否與DOX 的釋放直接相關(DOX 總濃度為10 μg·mL-1)。如圖9所示,DOX@FOVVVEF 在pH 5.8 時比在pH 7.4 時具有更強的細胞內DOX 熒光強度,酸性條件下凝膠的納米纖維結構更容易降解,釋放出更多的DOX,被細胞攝取后表現出更強的熒光。

圖9 與(A)空白DMEM、DOX@FOVVVEF 在(B)pH 7.4 和(C)pH 5.8 的釋放液共孵育48 h 后AKR 細胞的DOX 攝取,標尺為100 μm
3 小 結
本課題使用了固相多肽合成法合成了序列為FOVVVEF 的七肽,該多肽在pH 7.4、濃度為20 mg·mL-1時,能夠包裹化療藥鹽酸阿霉素自組裝成穩定的多肽水凝膠,其具有優異的機械穩定性與生物相容性。在腫瘤微酸環境中,水凝膠中的堿性氨基酸與阿霉素質子化程度增強導致體系靜電斥力增大,凝膠三維機構瓦解,大量且穩定地釋放阿霉素,在細胞實驗中取得了良好的抗腫瘤作用。綜上所述,FOVVVEF 多肽水凝膠是一種理想的抗腫瘤藥物遞送載體,具有臨床應用的潛力與價值。