控制性超促排卵對小鼠胎盤功能基因表達(dá)及胎鼠體質(zhì)量的影響
馬 蓉,陳書強(qiáng),雷 輝,金 妮,王曉紅
空軍軍醫(yī)大學(xué)唐都醫(yī)院 婦產(chǎn)科生殖醫(yī)學(xué)中心,陜西西安 710038
輔助生殖技術(shù)(assisted reproductive technology,ART)是現(xiàn)代醫(yī)學(xué)的重要組成部分,近10年得到了充分的發(fā)展和應(yīng)用,以體外受精為基礎(chǔ)的輔助生殖技術(shù)已經(jīng)成為治療不孕癥的主要手段。通過ART 出生的嬰兒數(shù)量在世界范圍內(nèi)穩(wěn)步增長,到目前為止已經(jīng)超過800 萬[1]。輔助生殖技術(shù)存在多種不良的妊娠結(jié)局,包括胎盤和胎兒生長方面[2]。因此,對ART 中的每一種干預(yù)措施均應(yīng)進(jìn)行單獨(dú)研究。我們知道,自然妊娠每個月經(jīng)周期中有1個優(yōu)勢卵泡發(fā)育成熟,而在輔助生殖技術(shù)操作中,利用控制性超促排卵(controlled ovarian hyperstimulation,COH) 這一關(guān)鍵步驟,通過注射超生理濃度的促性腺激素(卵泡刺激素和黃體生成素),以覆蓋體內(nèi)自然內(nèi)分泌調(diào)節(jié)系統(tǒng),使多個卵子同時成熟,進(jìn)而獲得多個胚胎,增加妊娠成功的概率。研究顯示,COH 導(dǎo)致母體子宮內(nèi)膜微環(huán)境顯著變化,且持續(xù)在著床期和胎盤早期。那么,COH 導(dǎo)致的異常母體子宮內(nèi)膜微環(huán)境會對胚胎發(fā)育產(chǎn)生怎樣的影響呢?本研究中,我們利用小鼠模型,消除了COH 對卵母細(xì)胞、體外受精和體外胚胎培養(yǎng)等的影響[3],將未暴露于促性腺激素的體內(nèi)受精囊胚移植入自然交配和超促排卵后的假孕雌鼠體內(nèi),單獨(dú)研究COH 這一關(guān)鍵操作步驟對小鼠胎盤功能基因表達(dá)及胎鼠體重的影響。
材料與方法
1 實驗動物 SPF 級8~ 10 周齡健康雌性ICR 小鼠70 只,體質(zhì)量28~ 32 g;8~ 10 周齡雄性小鼠30 只,體質(zhì)量34~ 40 g。購于北京華阜康生物科技公司。
2 主要試劑與儀器 馬絨毛膜促性腺激素(Pro Spec),人絨毛膜促性腺激素(Millipore),溶于PBS 緩沖液;MⅡ胚胎操作液(Millipore);反轉(zhuǎn)錄試劑盒(Taraka),熒光定量試劑盒(Taraka);RIPA 中蛋白裂解液(碧云天),BCA 定量試劑盒(Thermo),Luminex 液相懸浮芯片檢測試劑盒(R&D Systems),懸液微珠芯片平臺Bio-Plex MAGPIX System(上海華盈生物醫(yī)藥科技有限公司)。
3 小鼠胚胎移植動物模型的建立 取12 只正常雄性小鼠,麻醉后,輕壓腹腔,剪去腹部被毛,消毒后以腹部橫切法剪開腹壁,用眼科鑷斜向下方夾住一側(cè)脂肪墊將睪丸、附睪和輸精管拉出切口,鈍性分離輸精管,將其燒烙掉1 cm 左右,夾住脂肪墊將睪丸放入腹腔,同樣方法處理另一側(cè),縫合手術(shù)切口。術(shù)后1 周,將自然發(fā)情雌性小鼠與其1∶1 合籠,次日上午8:00 檢查雌鼠,見陰道栓者記為假孕0.5 d 并于妊娠5.5 d 解剖子宮,檢查是否有胚胎植入,以確定雄鼠結(jié)扎成功。取3 只性成熟自然發(fā)情雌鼠作為自然交配代孕組(NC 組),取3 只性成熟雌鼠腹腔注射馬絨毛膜促性腺激素(5 IU/只),48 h 后腹腔注射人絨毛膜促性腺激素(5 IU/只),作為超促排交配代孕組(COH 組),兩組雌鼠與輸精管結(jié)扎雄性小鼠1∶1 合籠,次日上午8:00 檢查雌鼠,見陰道栓者記為假孕雌鼠妊娠0.5 d。取18 只性成熟自然發(fā)情雌鼠與18 只正常雄鼠1∶1 合籠,次日上午8:00檢查雌鼠,見陰道栓者記為供胚雌鼠妊娠0.5 d,于妊娠3.5 d 顯微鏡下使用MⅡ培養(yǎng)液從子宮內(nèi)沖出囊胚,后移入NC 組代孕鼠及COH 組代孕鼠子宮角,每側(cè)各移植8 枚。每次移植實驗建立移植模型6 只(NC 組3 只,COH 組3 只),共進(jìn)行3 次移植實驗,NC 組和COH 組移植后順利妊娠的雌鼠各8 只,于妊娠18.5 d 收取樣本。
4 胎鼠及胎盤稱重 NC 組與COH 組小鼠于妊娠18.5 d 解剖子宮,取胎鼠及胎盤稱重并記錄。
5 Real-time PCR RT-PCR 檢測胎盤生長相關(guān)印記基因Igf-2、Peg3、H19、Mest、Cdkn1c、Mash2、Cd81、Plagl1、Zim1 和Ube3a 的mRNA 表達(dá)。取妊娠18.5 d 胎盤組織,采用Trizol 法提取兩組胎盤樣本中的總RNA,用Takara 反轉(zhuǎn)錄試劑盒(Cat#RR820,Lot#AKE1145A) 進(jìn)行擴(kuò)增,按照產(chǎn)品說明書進(jìn)行操作。擴(kuò)增程序:37℃,15 min;85℃,5 s;4℃,∞。Real-time 反應(yīng)體系:2×TB Green Premix,12.5 μL;上游引物(10 μmol/L),1 μL;下游引物(10 μmol/L),1 μL;模板,2 μL,加入滅菌蒸餾水至25 μL。反應(yīng)體系以GAPDH 為內(nèi)參,引物序列見表1。

表1 Real-time PCR 引物Tab.1 Primers used for real-time PCR
6 Luminex 液相懸浮芯片技術(shù)檢測胎盤生長相關(guān)細(xì) 胞 因 子VEGF、PIGF-2、PDGF-BB、MMP-2、MMP-9 和VEGFR2 的蛋白表達(dá) 胎盤組織樣本蛋白抽提(RIPA 中裂解液),BCA 法蛋白定量(Thermo),取200 μg 等質(zhì)量上樣檢測,經(jīng)過樣品孵育、檢測抗體、顯色等步驟,送入已校正的Bio-Plex 機(jī)器中讀值。根據(jù)標(biāo)準(zhǔn)品得到的熒光檢測值,使用多參數(shù)模式對標(biāo)準(zhǔn)曲線進(jìn)行擬合,得到標(biāo)準(zhǔn)曲線及其方程,濃度單位為pg/mL。
7 統(tǒng)計學(xué)方法 采用SPSS22.0 統(tǒng)計分析軟件對數(shù)據(jù)進(jìn)行錄入及分析。計量資料以表示,兩組間比較采用t檢驗;P<0.05 為差異有統(tǒng)計學(xué)意義。
結(jié) 果
1 兩組小鼠子代體質(zhì)量、胎盤重量、胎盤效率比較 COH 組小鼠子代體質(zhì)量、胎盤重量明顯低于NC 組(P<0.05);COH 組小鼠胎盤效率(胎兒體質(zhì)量/胎盤重量)明顯低于NC 組(P<0.05)。見表2。

表2 兩組小鼠出生體質(zhì)量、胎盤重量、胎盤效率比較Tab.2 Comparison of birth weight,placental weight and placental efficiency between the two groups
2 兩組小鼠胎盤生長相關(guān)印記基因表達(dá)水平比較 與NC 組相比,COH 組小鼠胎盤印記基因Igf-2、Peg3、H19、Mest、Cdkn1c、Mash2、Cd81、Plagl1、Zim1、Ube3a 表達(dá)水平顯著降低,差異均有統(tǒng)計學(xué)意義(P<0.05)。見表3。
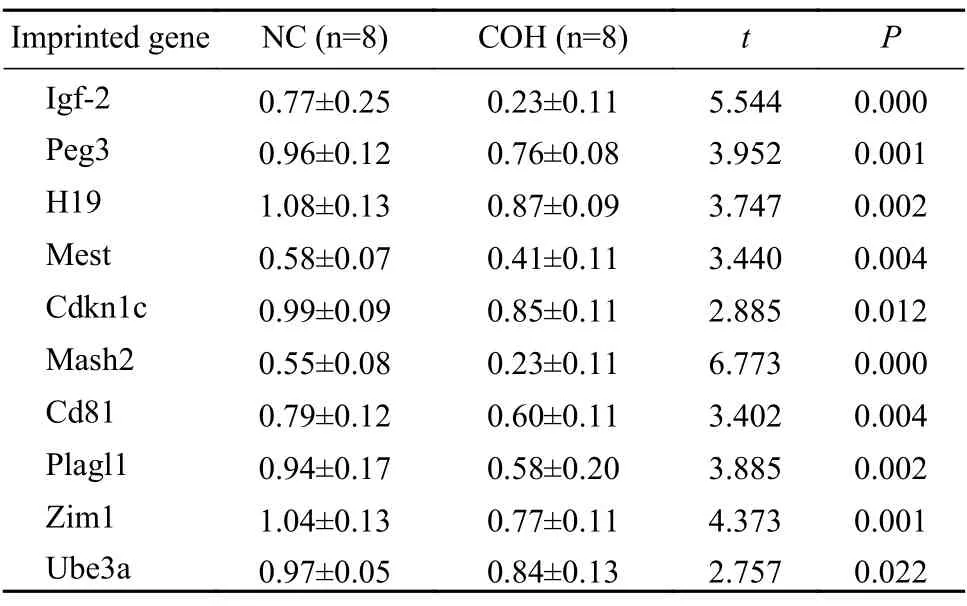
表3 Real-time PCR 檢測兩組小鼠胎盤mRNA表達(dá)水平比較Tab.3 Comparison of mRNA expression of placental tissue in mice by real-time PCR
3 兩組小鼠胎盤生長相關(guān)細(xì)胞因子比較 與NC 組相比,COH 組小鼠胎盤VEGF、PIGF-2、PDGF-BB、MMP-2、MMP-9、VEGFR2 表達(dá)水平降低,差異有統(tǒng)計學(xué)意義(P<0.05)。見表4。

表4 Luminex 液相懸浮芯片技術(shù)檢測兩組小鼠胎盤生長相關(guān)細(xì)胞因子蛋白表達(dá)水平比較Tab.4 Comparison of protein expression of placental tissue in mice by Luminex liquid suspension chip technology
討 論
研究表明,輔助生殖技術(shù)受孕分娩的新生兒低出生體質(zhì)量的發(fā)生風(fēng)險是自然受孕分娩新生兒的3 倍[4]。低出生體質(zhì)量兒的患病率和死亡率較正常體質(zhì)量新生兒顯著升高,并且低出生體質(zhì)量兒成年后患慢性疾病的風(fēng)險也顯著增加[5]。所以解析輔助生殖技術(shù)過程中導(dǎo)致試管嬰兒低出生體質(zhì)量的風(fēng)險因素,對臨床防治ART 低出生體質(zhì)量兒的發(fā)生至關(guān)重要。我們知道新鮮周期移植是在超排卵后直接將新鮮胚胎移植到高劑量外源性激素刺激的子宮中,而在冷凍周期中,胚胎則被移植到更類似于自然周期的子宮環(huán)境中。研究表明,與冷凍周期相比,新鮮周期新生兒低出生體質(zhì)量的風(fēng)險顯著升高[6]。這提示我們,COH 可能對子宮內(nèi)膜容受性、胚胎發(fā)育等產(chǎn)生多方面的影響。我們的研究通過建立小鼠模型,消除了COH 對卵母細(xì)胞、體外受精和體外胚胎培養(yǎng)等的影響[3],將未暴露于促性腺激素的體內(nèi)受精囊胚移植入自然交配或超促排卵后的假孕雌鼠體內(nèi),單獨(dú)研究COH 這一關(guān)鍵步驟對小鼠子代體質(zhì)量及胎盤的影響,通過對胎盤印記基因、胎盤生長相關(guān)細(xì)胞因子的檢測發(fā)現(xiàn),COH 影響胎盤印記基因和胎盤生長相關(guān)細(xì)胞因子的表達(dá)。
印記基因在胎兒、胎盤的生長發(fā)育及胎兒出生后的生長等方面發(fā)揮著重要調(diào)節(jié)作用,大部分印記基因在胎盤組織高表達(dá)[7],且研究發(fā)現(xiàn)印記基因可以通過控制胎盤中氨基酸、葡萄糖的轉(zhuǎn)運(yùn)調(diào)節(jié)母體與子代之間的營養(yǎng)物質(zhì)傳輸,參與調(diào)控胎盤、胚胎之間的營養(yǎng)物質(zhì)供需平衡[8]。研究表明,H19、Igf-2 和Cdkn1c 基因被印記并參與調(diào)節(jié)胎兒和胎盤的生長[9-11]。Mest 基因參與胎兒生長發(fā)育,敲除Mest 基因后出現(xiàn)胚胎和胎盤發(fā)育遲緩,且具有調(diào)節(jié)哺乳動物行為的功能[12]。本研究通過對這些重要印記基因的檢測,發(fā)現(xiàn)控制性超促排卵可能降低小鼠胎盤生長相關(guān)印記基因的表達(dá),進(jìn)而影響子代的生長發(fā)育潛能。
胎兒的發(fā)育是由胎盤支撐的,胎盤是胎兒與母親之間的界面,所有到達(dá)胎兒的營養(yǎng)和氧氣都必須通過這個器官,胎盤可以協(xié)調(diào)母體對懷孕的適應(yīng)并調(diào)動資源供胎兒使用[13]。既往研究發(fā)現(xiàn),血管生成因子VEGF、PIGF 等在正常胎盤發(fā)育過程中參與血管重構(gòu),保證了母胎界面豐富的血流及胎盤的順利形成[14-16]。PDGF 主要由單核巨噬細(xì)胞產(chǎn)生,其啟動一系列細(xì)胞內(nèi)信號轉(zhuǎn)導(dǎo),PDGFBB/PDGF-Rβ 相互作用在血管成熟中起關(guān)鍵作用[17]。MMPs 參與胚胎發(fā)育、傷口愈合、炎癥細(xì)胞遷移、動脈粥樣硬化及腫瘤浸潤轉(zhuǎn)移等多種生理和病理過程。研究發(fā)現(xiàn),MMP-2 和MMP-9 在發(fā)情、月經(jīng)周期和妊娠期間的子宮內(nèi)膜組織重塑中發(fā)揮作用,在妊娠大鼠的主動脈和子宮中MMP-2和MMP-9 表達(dá)上調(diào)[18]。本研究中,我們采用Luminex 液相懸浮芯片技術(shù)對小鼠胎盤中胎盤生長及血管發(fā)生相關(guān)細(xì)胞因子進(jìn)行了檢測,結(jié)果表明控制性超促排卵導(dǎo)致小鼠胎盤生長及血管發(fā)生相關(guān)細(xì)胞因子表達(dá)水平降低。妊娠時蛻膜NK 細(xì)胞的主要功能是分泌VEGF、PIGF 等血管生成相關(guān)的細(xì)胞因子[19-20]。根據(jù)本課題組前期的研究,控制性超促排卵可以減少妊娠時蛻膜NK 細(xì)胞的數(shù)量,可能是導(dǎo)致上述結(jié)果的重要原因,有待進(jìn)一步驗證。
綜上,我們利用小鼠模型發(fā)現(xiàn),控制性超促排卵致小鼠子代體質(zhì)量降低,胎盤重量降低,胎盤效率降低,但控制性超促排卵導(dǎo)致子代低體質(zhì)量的具體分子和細(xì)胞機(jī)制仍有待闡明。臨床中控制性超促排卵是否通過影響胎盤重量及效率而影響試管嬰兒出生體質(zhì)量,有待進(jìn)一步揭示。

