退熱六法對脂多糖致熱兔toll樣受體4/核轉錄因子-κB及炎癥因子的影響
焦誼 劉志鳳 于天源 張英琦 劉迪 王厚融 徐亞靜 官乾
發熱作為兒科常見的癥狀之一,發生率為25.7%,每人每年約0.8次[1]。長期發熱或體溫過高則會損害機體調節功能,使病情惡化。小兒推拿退熱具有安全性和有效性[2],其中以開天門[3]138、推坎宮[3]138、揉太陽[3]138-139、揉耳后高骨[3]151、清天河水[4]、推脊[5]手法最為常用,現有小兒推拿退熱研究不深入,受到社會質疑。故選取脂多糖(lipopolysaccharide,LPS)模型模擬臨床細菌性發熱,LPS作為toll樣受體4(toll-like receptor 4,TLR4)公認的配體,能刺激機體產生炎癥反應,核轉錄因子-κB p65(nuclear factor-κB p65,NF-κB p65)參與機體免疫調節、炎癥反應、感染、細胞周期調控、細胞分化及凋亡等[6],發熱過程以炎癥介質如腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素1β(interleukin-1β,IL-1β)最為重要,故以退熱六法為例,設計實驗進行深入研究。
1 材料及方法
1.1 實驗動物
清潔級2月齡新西蘭幼兔24只,體質量(2000±200)g,肛溫(39.00±0.50)℃,雌雄各半,購自北京隆安實驗動物養殖中心[合格證號為SCXK(京)2019-0006]。飼養于北京中醫藥大學動物實驗室,溫度(25±0.5)℃,相對濕度(65±5)%,12小時/12小時明暗周期,自由飲食飲水。適應性飼養3天,排除肛溫波動大于0.4℃的新西蘭兔。實驗程序經北京中醫藥大學動物使用和管理委員會批準,符合動物福利與倫理原則。
1.2 儀器及試劑
主要試劑:大腸桿菌內毒素脂多糖(美國Sigma公司;批號:055:B5 L2880);BCA蛋白濃度測定試劑盒(北京索萊寶科技有限公司;批號:PC0020);TLR4抗體(批號:bs-20594R)、NF-κB p65抗體(批號:bs-0465R)、GAPDH抗體(批號:bsm-0978M)以上試劑均購自北京奧博森生物科技有限公司。
主要儀器: ChemiDoc MP成像儀(美國BIO-RAD公司);MultiSkan3酶標儀(美國THERMO公司);BL-420N(成都泰盟軟件有限公司)、動物五分類血細胞分析儀(優利特URIT-5160Vet)。
1.3 動物分組及模型制備
將24只新西蘭兔隨機分為正常組8只、模型組8只、推拿組8只。清醒狀態下,模型組和推拿組幼兔耳緣靜脈注射濃度為0.5 μg/mL LPS,注射量為1 mL/kg[7-8],注射后1小時內肛溫上升超過0.6 ℃為造模成功,正常組不予處理。
1.4 干預方法
正常組和模型組正常飼養。推拿組:造模后1小時干預1次。(1)開天門:定位:兩眉骨內側中點至神庭穴(前正中線,額頂骨縫交界處)[9],操作:用拇指自下而上交替直推200次,2分鐘[10];(2)推坎宮:定位:精明穴(內眼角,上下眼瞼交界處)直上至絲竹空穴(眶上突外端)[9],操作:用兩拇指橈側自眉心向眉梢做分推200次,2分鐘[10];(3)揉太陽:定位:太陽穴(外眼角后上方顳窩中)[9],操作:用兩拇指橈側推運200次,2分鐘[10];(4)揉耳后高骨:定位:寰椎翼前緣直上方凹陷處[9],操作:用兩拇指或中指端揉24次掐3下,2分鐘[10];(5)推脊:定位:大椎穴(背中線上,第7頸椎與第1胸椎棘突間)至尾根[9],操作:用食中二指自上而下直推300次,5分鐘[10]。(6)清天河水:定位:腕橫紋至肘橫紋[9],操作:用食中指指面自腕推向肘,推500次,5分鐘[11]。操作要點:由推拿學科專業人員操作,且都為同一人干預,操作時蘸取與室溫相同的溫水。
1.5 取材及指標檢測
1.5.1 肛溫監測 采用BL-420N監測肛溫變化。肛溫探頭涂上適量石蠟油,插入肛門固定為5 cm,待穩定后讀數,作為幼兔的肛溫,之后每隔30分鐘記錄一次肛溫,連續監測6小時。體反應指數(total response index,TRI):按梯形法計算造模后2小時、3小時、4小時、5小時、6小時的曲線下面積(TRI2-6),橫坐標0.5小時為1 cm,縱坐標0.5 ℃為1 cm。
1.5.2 中性粒細胞比率檢測 于造模前、造模后1小時、造模后3小時(即推拿后2小時)耳緣靜脈采血,用EDTA抗凝管采取0.5 mL即可,抽取完畢后輕輕搖勻4~5次,避免凝血。在室溫保存2小時內檢測中性粒細胞比率(neutrophil granulocyte,NEU%)。
1.5.3 酶聯免疫吸附法檢測血清TNF-α、IL-1β含量 于造模后3小時(即推拿后2小時)耳緣靜脈采血1 mL,置于紅色真空采血管中,室內保存20分鐘內進行離心,4℃ 3000 rpm離心20分鐘,取上清置于EP管保存,按試劑盒方法測定血清中TNF-α、IL-1β含量。
1.5.4 蛋白免疫印跡法檢測肝、肺組織TLR4、NF-κB p65蛋白表達 于造模后3小時腹腔注射10%水合氯醛(0.35 mL/100g),抽取腹主動脈血,取出適量大小肝臟、肺臟組織100 mg,將組織放于組織裂解液中研磨,每10分鐘震蕩1次,共震蕩4次,混合液4℃、12000 rpm 離心20分鐘,吸取上清。BCA蛋白試劑盒進行蛋白定量,加5×蛋白上樣緩沖液混勻,95℃變性5分鐘。配置8%分離膠和5%濃縮膠,上樣后穩定電泳濃縮膠60 V、分離膠80 V,冰上電轉100 V 70分鐘,10%脫脂奶粉封閉2小時,依據Maker裁膜,一抗(TLR4 1∶1000,NF-κB p65 1∶2000,GAPDH 1∶1000)室溫搖床孵育1小時后4℃冰箱過夜。洗膜3次,孵育二抗(羊抗兔IgG 1∶10000,羊抗小鼠 IgG 1∶10000),顯影液均勻滴在膜上,成像儀顯影,Image Lab圖像分析軟件分析目的條帶,定量分析各蛋白條帶灰度值。
1.6 統計學分析
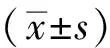
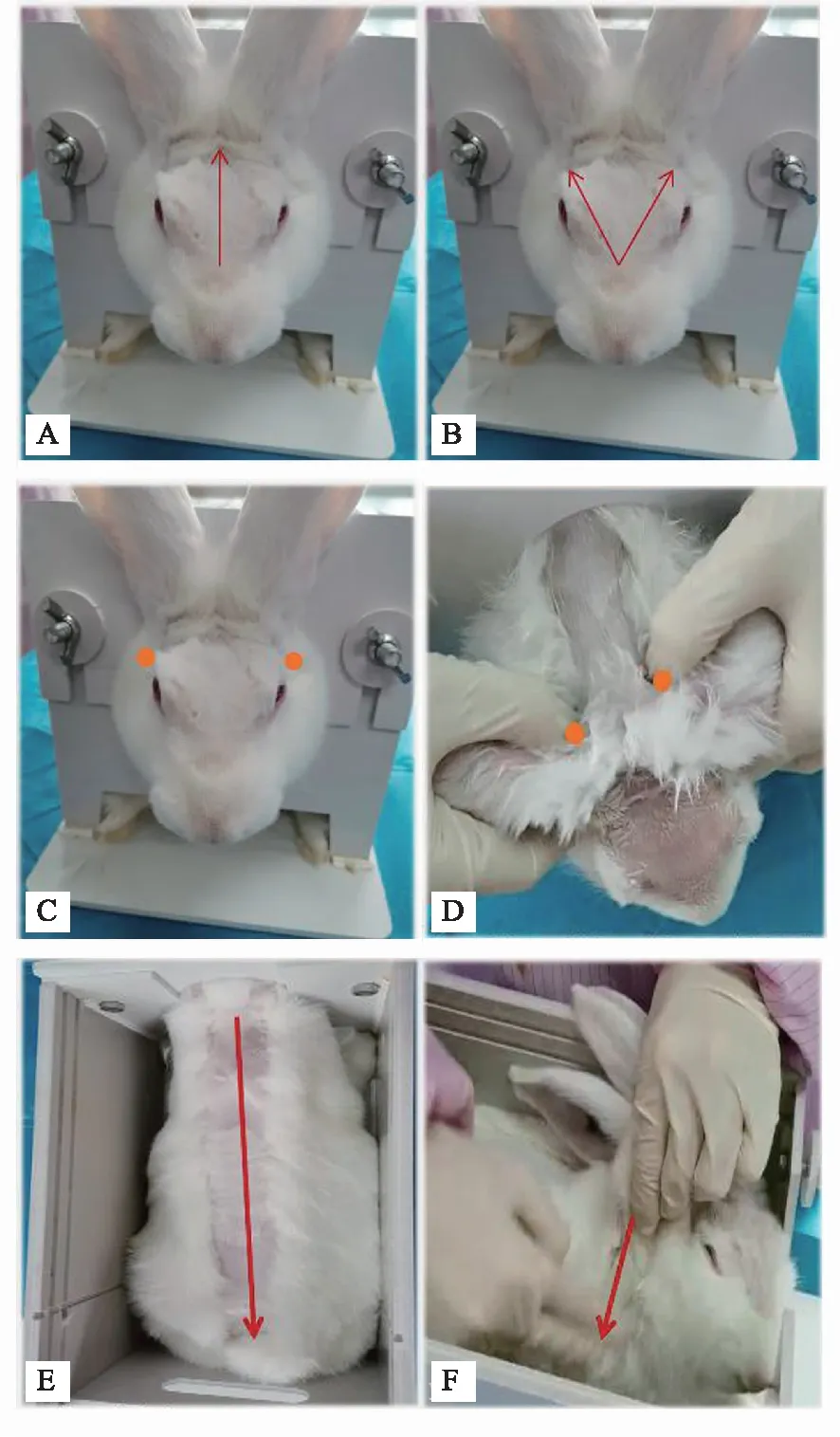
注:A:開天門;B:推坎宮;C:揉太陽;D:揉耳后高骨;E:推脊;F:清天河水
2 結果
2.1 各組幼兔肛溫變化比較
基礎肛溫:正常組基礎肛溫與模型組、推拿組相比,無顯著性差異(P>0.05);造模后1小時(推拿前):推拿組與模型組無顯著性差異(P>0.05),推拿組和模型組肛溫顯著高于正常組(P<0.05);造模后2小時、3小時、4小時(即推拿后1小時、2小時、3小時):推拿組肛溫顯著低于模型組(P<0.05);造模后5小時、6小時(即推拿后4小時、5小時):推拿組肛溫與模型組無統計學意義(P>0.05)。見表1、圖2。
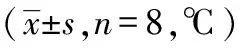
表1 退熱六法對各組幼兔肛溫的影響
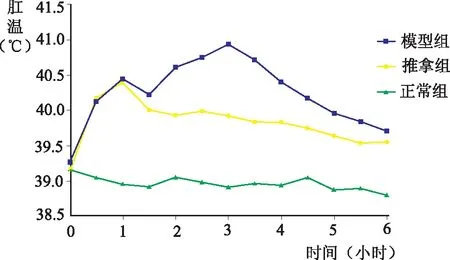
圖2 退熱六法對各組幼兔肛溫的影響
造模后3小時、4小時、5小時、6小時,推拿組體反應指數明顯低于模型組(P<0.05)。見表2。
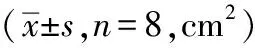
表2 退熱六法對各組幼兔體反應指數的影響
2.2 各組幼兔中性粒細胞比率變化比較
造模后3小時,推拿組NEU%顯著低于模型組(P<0.05);組內比較,模型組造模后1小時、3小時的 NEU%高于造模前(P<0.05),推拿組只有造模后1小時的 NEU%高于造模前(P<0.05);推拿組造模3小時 NEU%與造模前無統計學意義(P>0.05)。見表3。
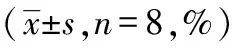
表3 退熱六法對各組幼兔外周血中性粒細胞比率表達的影響
2.3 退熱六法對發熱幼兔血清炎癥因子的影響
造模后3小時,模型組血清中TNF-α含量明顯高于正常組(P<0.05),推拿組血清中TNF-α含量明顯低于模型組(P<0.05);模型組血清中IL-1β含量高于正常組(P<0.05),推拿組血清中IL-1β含量低于模型組(P<0.05)。見表 4。
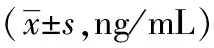
表4 退熱六法對各組幼兔血清炎癥因子表達的影響
2.4 退熱六法對發熱幼兔肝、肺組織TLR4/NF-κB p65的影響
造模后3小時,推拿組和模型組肝、肺組織中TLR4、NF-κB p65表達高于正常組(P<0.05);推拿組肝、肺組織中TLR4表達低于模型組(P<0.05),推拿組和模型組NF-κB p65表達無明顯差異(P>0.05)。見圖5、6,表3、4。
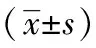
表5 退熱六法對各組幼兔肝組織TLR4及NF-κB p65蛋白表達的影響
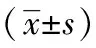
表6 退熱六法對各組幼兔肺組織TLR4及NF-κB p65蛋白表達的影響
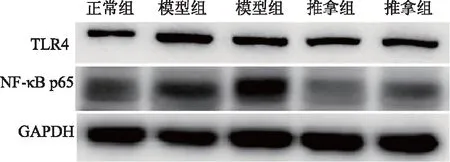
圖3 退熱六法對各組幼兔肝組織TLR4/NF-κB p65表達的影響
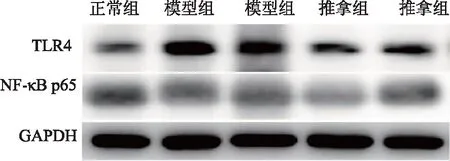
圖4 退熱六法對各組幼兔肺組織TLR4/NF-κB p65表達的影響
3 討論
小兒推拿手法治療發熱有著獨特的優勢,較口服及靜脈給藥更能獲得家長的認可[12],其療效及機制問題,是推拿學科關注的熱點之一,臨床上小兒推拿退熱的手法不統一,治療范疇及機制不明確,以致療效和安全性被質疑。魏理珍等[13]研究發現清天河水可能通過抑制下丘腦正調節介質前列腺素E2(prostaglandin E2,PGE2)和環磷酸腺苷(cyclic adenosine monophosphate,cAMP)含量而降溫。臨床上推拿退熱效果顯著,推拿能下調發熱患兒外周血清TNF-α、IL-6、IL-8等炎癥因子水平[14]。因此,本研究探討了推拿對炎癥性發熱的影響,結果提示推拿能明顯抑制發熱,抑制炎癥反應,下調中性粒細胞比率,可能是通過TLR4信號通路實現。
根據研究發現,耳緣靜脈注射0.5 μg/kg的LPS,造模成功率達83%,造模后1小時肛溫明顯升高,造模后3小時肛溫達最高峰,與基礎肛溫相比,約上升1.6℃,隨后肛溫逐漸下降,持續約6小時,與研究相符[8]。選取退熱六法作為干預方式,其中頭面四大手法屬于“和法”,可調節陰陽,天人相應,天河水倍受歷代醫者的推崇,均認為清天河水是“清法”的重要代表,在各種熱證下均可施用,脊椎占督脈近三分之二的循行部位,推脊對督脈氣機有調節作用。推拿后即刻便會出現降溫現象,降溫幅度最高達1℃。
發熱是體溫調節系統紊亂的表現,是反應炎癥性疾病的重要標志,眾所周知,TLR4介導的信號轉導參與了慢性和急性炎癥反應[15],其中TLR4/NF-κB是炎癥調節的經典信號通路,參與了炎癥性發熱的體液機制。炎性細胞因子能影響免疫反應,并對各種組織或器官造成損傷[16]。TNF-α、IL-1β參與調節早期免疫反應[17],是發熱的關鍵介質,其中肺臟、肝臟是失調炎癥反應的潛在目標。基因敲除TNF-α后注射LPS,發現小鼠體溫明顯升高,說明TNF-α參與了負反饋機制,限制了發熱的程度[18],有研究表明注射TNF-α血清抗體能影響發熱的早期階段[19],這與推拿后能即刻降低體溫相似。IL-1β通過血液、體液途徑直接作用于中樞引起發熱[20],中性粒細胞首先募集到發生感染的部位[21],分泌IL-1β[22],引起炎癥反應,中性粒細胞具有兩重作用,一則產生抑菌作用,二則存在細胞毒性,所以當其適當發揮效應后應抑制其活化和浸潤,防止對機體產生傷害[23],研究結果顯示,退熱六法作用于LPS模型兔后能抑制外周中性粒細胞增多,保護機體免受傷害。脂多糖是一種典型內毒素,作為配體可以激活細胞膜上的TLR4,啟動下游炎癥反應,上調促炎細胞因子。肝臟在調節各種新陳代謝、體內平衡、宿主防御活動中起著關鍵作用,能清除細菌和內毒素,發揮代謝、免疫等功能[24],TLR4介導LPS誘導的肝組織損傷,使用TLR4抑制劑可以改善肝臟損傷和全身炎癥[25],LPS誘導大量促炎性介質將中性粒細胞募集到肺組織中,造成肺部的炎性損傷[26],TLR4作為潛在的治療標記,可用于抑制肺部的炎癥反應,根據研究結果顯示,退熱六法干預能抑制肝臟和肺臟組織中TLR4的表達量。
綜上,本研究揭示了退熱六法對LPS引起的炎癥性發熱具有退熱作用,研究表明,退熱六法能抑制外周炎癥反應,下調中性粒細胞比率,影響TLR4信號通路,下游通路不涉及NF-κB p65,這些結果為推拿治療小兒發熱提供了科學依據,回答了臨床上推拿退熱的部分理論機制。

