苦參堿經TLR4/NF-κB通路對膀胱癌小鼠免疫機制的調控作用
瞿小祥,孔東波,魯小紅,江波濤,鄒偉,查文良
(咸寧市中心醫院/湖北科技學院附屬第一醫院 泌尿外科,湖北 咸寧 437100)
膀胱癌是第二常見的泌尿系統惡性腫瘤,經尿道膀胱腫瘤切除術聯合輔助化療可以取得較好的治療效果,但是臨床研究顯示膀胱癌的復發率仍高達70%,其中約15%會發展為肌肉浸潤性疾病[1]。免疫抑制被認為是腫瘤發生和發展的有利特征,CD4+細胞、自然殺傷(nature kill,NK)細胞水平降低使腫瘤細胞免于被機體的免疫系統清除,研究顯示核因子(nuclear factor,NF)-κB通路在膀胱癌的發生和轉移中具有重要意義,并參與腫瘤的免疫逃逸機制[2-3]。近年來中藥在腫瘤中的應用得到了科學家們的廣泛關注,苦參堿是一種生物堿化合物,存在于中草藥苦參中,據報道苦參堿具有治療多種疾病的藥理特性,如抗炎、抗病毒、抗纖維化和心血管保護作用,并且苦參堿注射液已被應用于臨床[4-5]。最近的證據顯示苦參堿具有抗腫瘤活性,包括乳腺癌[6]、膀胱癌[7]以及肝癌[8]等。研究表明苦參堿的抗炎和抗腫瘤作用至少部分是與NF-κB通路有關,苦參堿通過抑制Toll樣受體4(Toll like receptor,TLR4)介導的NF-κB活化來減輕金黃色葡萄球菌脂磷壁酸誘導的子宮內膜炎[9]。因此,本研究主要分析苦參堿對膀胱癌小鼠模型的影響,并分析其對 TLR4/NF-κB通路和免疫水平的影響,探究其作用機制。
1 材料與方法
1.1 實驗材料
人膀胱癌細胞系T24(HTB-4,ATCC公司,美國),裸小鼠(上海斯萊克實驗動物中心,中國),苦參堿注射液(H2004134,廣州白云山明興制藥有限公司),細胞核/胞漿細胞組分提取試劑盒(#K266-25,Biovision公司,美國),抗體和二抗(Abcam公司,美國),PVDF膜(Bio-Rad公司,美國),ECL 顯色試劑盒(Thermo Fisher公司,美國),TRIzol(Sigma公司,美國),PrimeScript-RT試劑盒和SYBR Premix Ex Taq試劑盒(TAKARA公司,日本),蛋白酶K和TUNEL凋亡試劑盒(Roche公司,中國),流式細胞儀以及小鼠CD4+、CD8+、NK細胞表型抗體試劑(Becton Dickinson公司,美國),CD4+抗體(Bioworld公司,美國),IgSABC試劑盒(Spring Bioscience公司,美國)。
1.2 分組和建模
通過皮下注射的方式構建膀胱癌小鼠模型,將DMEM培養基中處于對數生長期的T24細胞重新配制成濃度為1×107個·ml-1的細胞溶液,在小鼠左側前肢皮下注射細胞溶液0.2 ml,在建模后第7 天可以觸摸到有瘤體生成,提示建模成功。隨機選擇36只建模成功的小鼠,隨機分為對照組、苦參堿低劑量組和苦參堿高劑量組(n=12)。在建模后第8天苦參堿低劑量組和苦參堿高劑量組小鼠腹腔注射苦參堿,劑量分別為5和10 mg·kg-1[10],1次·d-1。在建模后第28天,小鼠稱重,取眼眶血,然后處死小鼠。
1.3 檢測指標和方法
1.3.1 腫瘤生長情況 在實驗期間觀察小鼠情況,并在建模后第28 天通過頸椎脫臼處死小鼠,取出腫瘤組織,稱重,用游標卡尺測量皮下腫瘤并使用下式計算體積:體積=[(長度×寬度)/2]3×0.523 6。
1.3.2 細胞周期蛋白D1(Cyclin D1)、增殖細胞核抗原(PCNA)、TLR4和NF-κB蛋白表達水平的檢測 采用蛋白質印跡法檢測增殖相關蛋白Cyclin D1、PCNA、TLR4和NF-κB蛋白的水平來評估腫瘤細胞增殖能力。將腫瘤組織研磨后收集總蛋白,通過BCA試劑盒檢測濃度。為了檢測細胞核和細胞質中NF-κB蛋白的表達水平,通過細胞核/胞漿細胞組分提取試劑盒分別提取細胞質和細胞核中蛋白質。應用SDS-PAGE(120 V,90 min)分離40 μg的總蛋白。將分離的蛋白質通過濕法轉移到PVDF膜上,并在膜上添加1∶500稀釋的抗-CyclinD1、抗-PCNA、抗-TLR4、抗-NF-κB抗體在室溫下孵育過夜。然后在室溫下加入1∶5 000稀釋的HRP標記的二抗,4 ℃下孵育2 h。通過ECL檢測蛋白印跡帶。將GAPDH作為內參,通過檢測灰度分析Cyclin D1、PCNA、TLR4和NF-κB蛋白的相對表達水平。細胞質和細胞核中的NF-κB分別以GAPDH和TBP作為內參。
1.3.3 TUNEL染色檢測凋亡 將腫瘤組織利用多聚甲醛固定48 h,固定后利用不同濃度的酒精進行脫水,然后加入二甲苯進行透明處理并包埋至石蠟中,使用切片機切成4 μm厚的切片。切片水化后制成玻片標本,加入蛋白酶K(20 μg·ml-1)消化,然后按照試劑盒說明書加入TUNEL試劑,于37 ℃孵育1 h。最后加入蘇木精對細胞核進行復染。在顯微鏡下觀察,計算凋亡指數(凋亡指數=凋亡染色陽性細胞數目/總細胞數目×100%),隨機選擇5個視野,計算均值。
1.3.4 實時熒光定量聚合酶鏈反應(RT-qPCR)檢測mRNA 用TRIzol從腫瘤組織中提取總RNA,分別采用PrimeScript-RT試劑盒和SYBR Premix Ex TaqTM試劑盒進行逆轉錄(42 ℃/60 min,70 ℃/5 min,4 ℃下保存)和qPCR實驗(95 ℃/10 min,94 ℃/15 s,60 ℃/1 min,60 ℃/1 min,40個循環,4 ℃下保存),內參為GAPDH。通過比較循環閾值(ΔΔCt)分析mRNA的表達水平。
1.3.5 T細胞亞群測定 采用流式細胞術檢測外周血中CD4+和CD8+細胞比例,收集外周血,通過密度梯度離心法收集單個核細胞,按照試劑盒說明書分別加入CD4+和CD8+標志試劑并在避光下孵育1 h,利用FITC標記的CD4標記CD4+細胞,利用APC標記的CD8標記CD8+細胞。使用流式細胞儀測量T細胞亞群,所有實驗均重復3次。
1.3.6 CD4+細胞浸潤情況檢測 通過免疫組化染色標記CD4蛋白檢測腫瘤組織中CD4+細胞浸潤情況。按照1.3.3的方法制作組織切片,將切片在-20 ℃的冷丙酮中固定15 min。然后在37 ℃下與抗小鼠CD4抗體孵育1 h,然后使用Ig SABC試劑觀察,最后利用蘇木精復染細胞核,棕色和黃色染色代表陽性細胞,隨機選擇5個視野,計算陽性染色細胞數目的平均值。
1.4 統計學處理
使用SPSS 19.0統計軟件進行數據分析。計量資料以均數±標準差表示,進行ANOVA方差分析,兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 苦參堿對膀胱癌小鼠模型的抑制作用
建模后第28天3組小鼠的腫瘤體積和質量比較差異有統計學意義(P<0.05),苦參堿低劑量組和苦參堿高劑量組的腫瘤體積和質量均顯著低于對照組(P<0.05),苦參堿高劑量組的腫瘤體積和質量顯著低于苦參堿低劑量組(P<0.05),見表1。
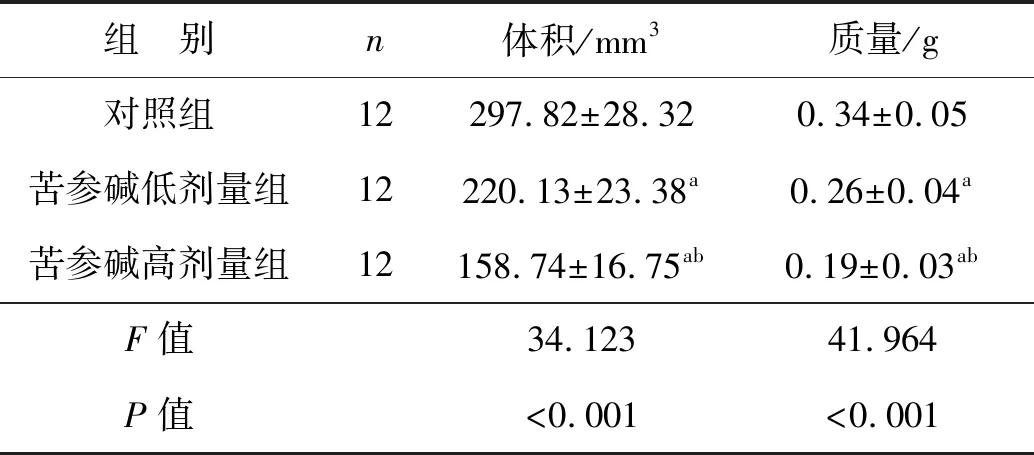
表1 苦參堿對腫瘤體積和質量的影響
2.2 苦參堿對膀胱癌小鼠模型細胞增殖的影響
3組Cyclin D1和PCNA蛋白表達水平比較差異均有統計學意義(P<0.05),苦參堿低劑量組和苦參堿高劑量組的Cyclin D1和PCNA蛋白表達水平均顯著低于對照組(P<0.05),苦參堿高劑量組的Cyclin D1和PCNA蛋白表達水平均顯著低于苦參堿低劑量組(P<0.05),見圖1、表2。
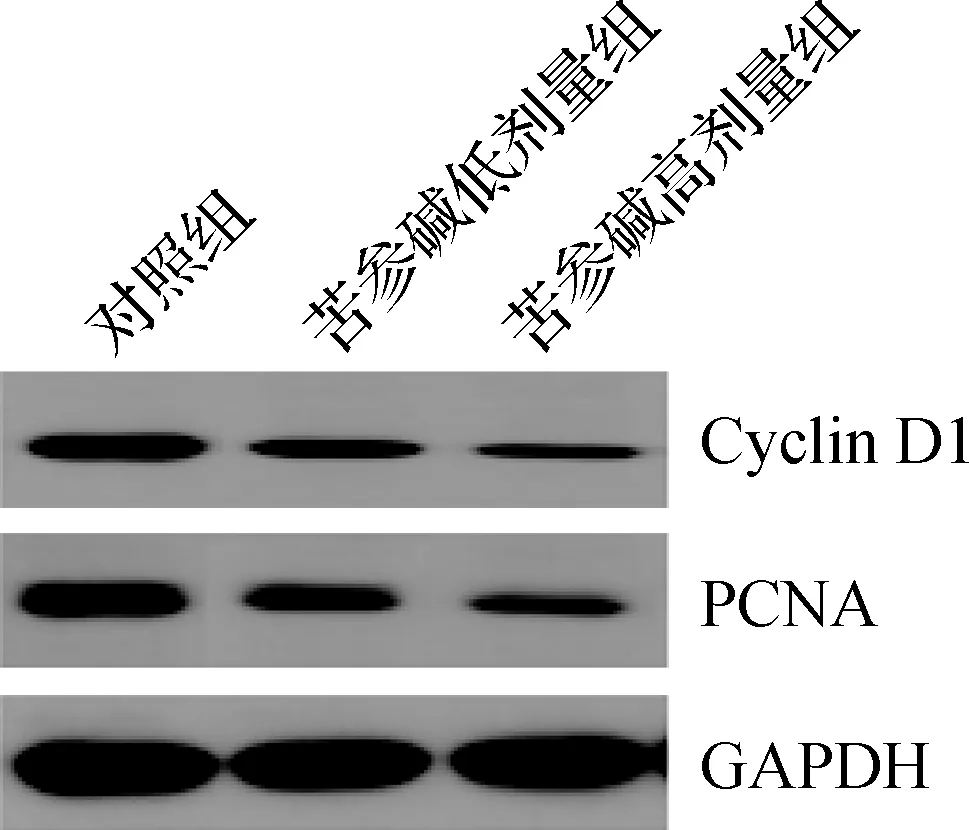
圖1 蛋白質印跡法檢測苦參堿對膀胱癌小鼠模型中Cyclin D1和PCNA蛋白的影響
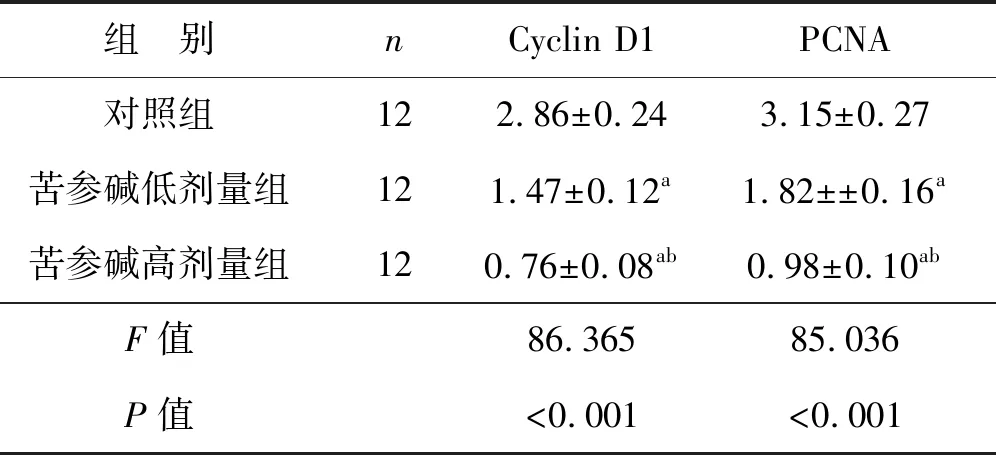
表2 苦參堿對膀胱癌小鼠模型中Cyclin D1和PCNA蛋白的影響
2.3 苦參堿對膀胱癌小鼠模型細胞凋亡的影響
如圖2所示,藍色為被染色的細胞核,棕色為凋亡細胞。3組的凋亡指數比較差異有統計學意義(P<0.05),苦參堿低劑量組和苦參堿高劑量組的腫瘤細胞凋亡指數顯著高于對照組(P<0.05),并且苦參堿高劑量組的腫瘤細胞凋亡指數顯著高于苦參堿低劑量組(P<0.05),見表3。
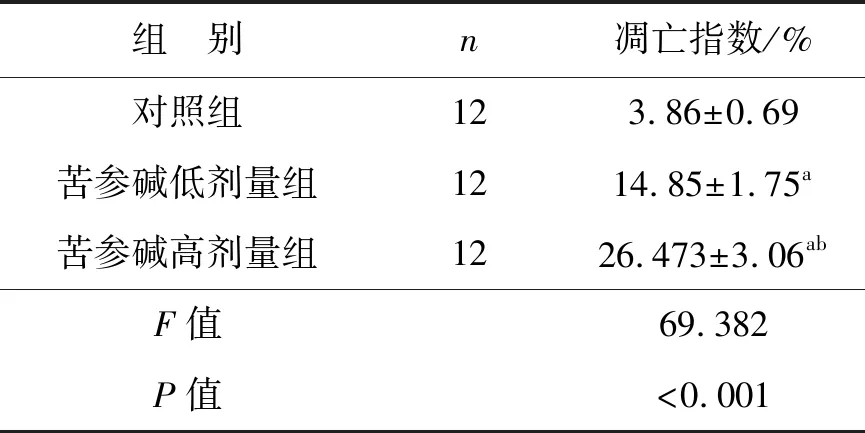
表3 苦參堿對膀胱癌小鼠模型細胞凋亡的影響

圖2 TUNEL染色檢測苦參堿對膀胱癌小鼠模型細胞凋亡的影響 ×200
2.4 苦參堿對膀胱癌小鼠模型腫瘤細胞TLR4/NF- κB通路中基因轉錄水平的影響
3組腫瘤組織中TLR4/NF-κB通路中基因轉錄水平比較差異有統計學意義(P<0.05),苦參堿低劑量組和苦參堿高劑量組的TLR4和NF-κB mRNA表達水平均顯著低于對照組(P<0.05),苦參堿高劑量組的TLR4和NF-κB mRNA表達水平均顯著低于苦參堿低劑量組(P<0.05),見表4。
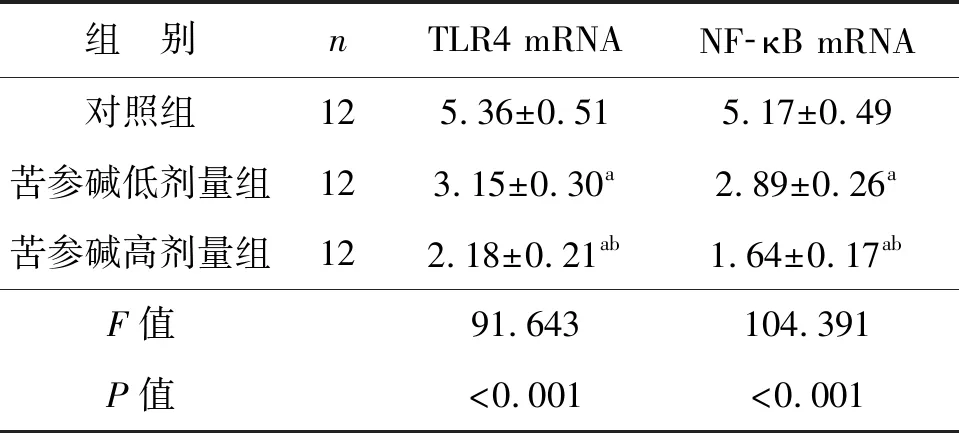
表4 苦參堿對膀胱癌小鼠模型腫瘤細胞TLR4和NF-κB mRNA水平的影響
2.5 苦參堿對膀胱癌小鼠模型腫瘤細胞TLR4和NF- κB蛋白表達水平的影響
3組腫瘤組織中TLR4和NF-κB蛋白表達水平比較差異有統計學意義(P<0.05),苦參堿低劑量組和苦參堿高劑量組TLR4和NF-κB蛋白水平均顯著低于對照組(P<0.05),苦參堿高劑量組TLR4和NF-κB蛋白水平均顯著低于苦參堿低劑量組(P<0.05),見圖3、表5。
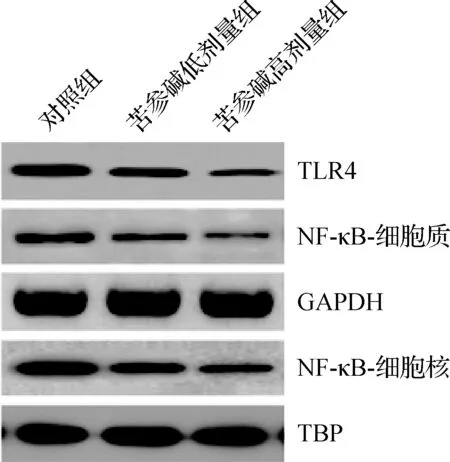
圖3 蛋白質印跡法檢測苦參堿對膀胱癌小鼠模型腫瘤細胞中TLR4和NF-κB蛋白水平的影響
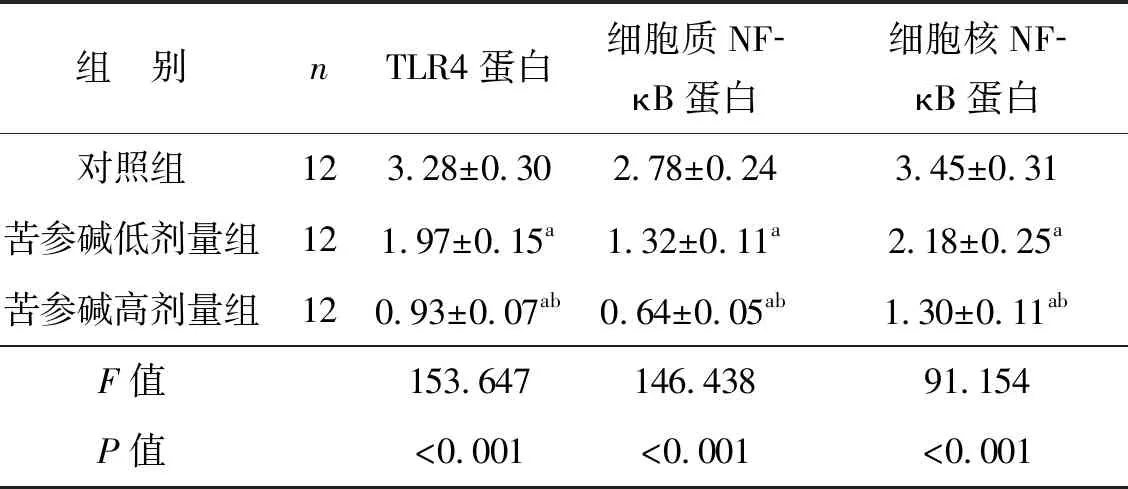
表5 苦參堿對膀胱癌小鼠模型腫瘤細胞TLR4和NF-κB蛋白表達水平的影響
2.6 苦參堿對膀胱癌小鼠模型T淋巴細胞亞群的影響
3組小鼠CD4+細胞百分比和CD4+/CD8+差異有統計學意義(P<0.05),CD8+細胞百分比差異無統計學意義(P>0.05)。苦參堿低劑量組和苦參堿高劑量組的CD4+細胞百分比和CD4+/CD8+均顯著高于對照組(P<0.05),苦參堿高劑量組的CD4+細胞百分比和CD4+/CD8+均顯著高于苦參堿低劑量組(P<0.05),見圖4、表6。
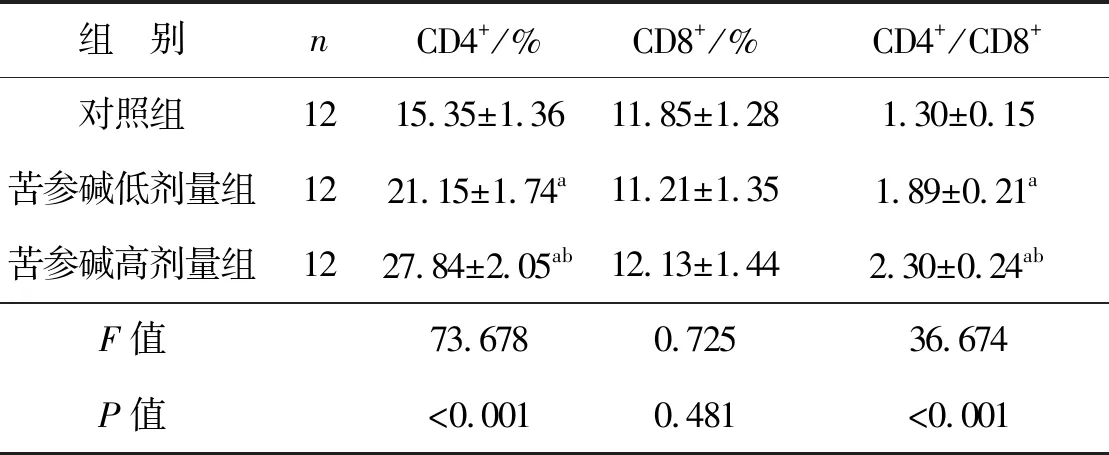
表6 苦參堿對膀胱癌小鼠模型T淋巴細胞亞群的影響
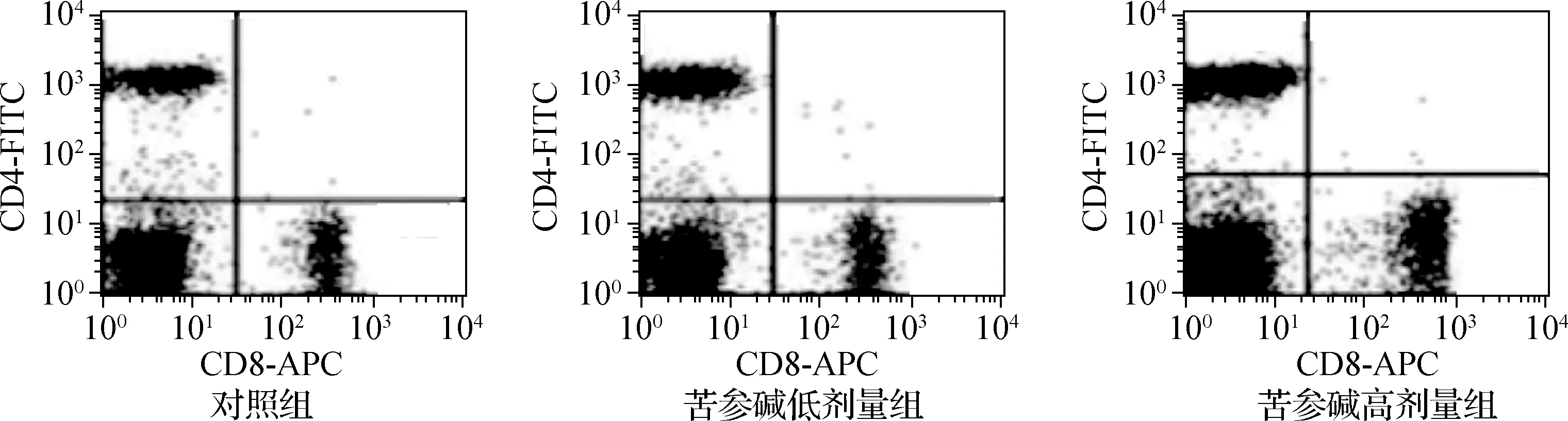
圖4 流式細胞術檢測苦參堿對膀胱癌小鼠模型T淋巴細胞亞群的影響
2.7 苦參堿對膀胱癌小鼠模型腫瘤組織中CD4+細胞浸潤的影響
3組CD4+細胞數目比較差異有統計學意義(P<0.05)。苦參堿低劑量組和苦參堿高劑量組的CD4+細胞數目顯著高于對照組[(6.47±0.85)個](P<0.05),苦參堿高劑量組的CD4+細胞數目[(59.65±5.03)個]顯著高于苦參堿低劑量組[(24.24±2.76)個](P<0.05)。
3 討 論
膀胱癌是男性最常見的惡性腫瘤之一,現階段治療膀胱癌的方法主要有化學療法和根治性膀胱切除術等,盡管外科手術技術、化學療法和放射療法取得了重大的進步,但膀胱癌的總體生存率仍然較低[11]。尋找新的、有效的治療膀胱癌的方法具有重要意義。
苦參堿是一種生物堿,主要來源于中藥苦參以及豆科植物和槐屬植物的根和莖。在臨床上,苦參堿在治療心血管疾病、炎癥和神經系統疾病中有著廣泛應用[12-13]。苦參堿會影響多種細胞生物學過程,包括線粒體功能、細胞氧化應激、自噬、代謝、鈣平衡和內質網應激[14-15]。近年來,其抗腫瘤活性引起了廣泛的關注,有體外研究發現苦參堿對膀胱癌細胞系BIU-87具有抑制作用[16]。一項最新研究結果顯示苦參堿對于膀胱癌模型大鼠也具有抑制作用[17],但是相關研究極少,苦參堿是否可以劑量依賴性地抑制膀胱癌仍不明確,并且其作用機制也不清楚。本研究結果顯示,苦參堿可以劑量依賴性地抑制腫瘤增殖相關蛋白CyclinD1和PCNA的表達,誘導細胞凋亡,抑制腫瘤的生長。此外,本研究還發現苦參堿可以劑量依賴性地抑制TLR4和NF-κB的轉錄和翻譯。大量研究已經證實了TLR4/NF-κB通路在膀胱癌發生和進展中的作用,TLR4可以使NF-κB磷酸化激活,NF-κB被激活后會進入細胞核誘導促癌基因的轉錄[18-19]。有研究顯示,苦參堿通過抑制TLR4/MyD88/NF-κB途徑和NLRP3炎性小體抑制豬肺泡巨噬細胞中炎性細胞因子的分泌[20]。苦參堿可以通過抑制過氧化氫處理的胰腺細胞中cadherin和Vimentin蛋白的表達,從而抑制其遷移和侵襲能力[21]。張弦等[22]研究顯示,苦參堿通過抑制TLR4信號通路的轉導調控肝細胞的凋亡 。Huang等[23]通過體內研究發現苦參堿可以明顯抑制前列腺癌小鼠模型中NF-κB蛋白的表達水平,從而抑制腫瘤的生長和轉移。結合過往研究結果,本研究提示苦參堿可通過抑制膀胱癌細胞中的TLR4和NF-κB的轉錄和翻譯、NF-κB蛋白的表達和激活,進而抑制促癌基因的轉錄水平,從而抑制膀胱癌細胞的生長并誘導凋亡。
免疫抑制是腫瘤的重要特點之一,膀胱癌患者的T淋巴細胞受到抑制,CD4+細胞比例降低,并且CD4+/CD8+值降低[24]。腫瘤組織中T細胞減少不但會直接導致腫瘤的進展和轉移,其分泌的干擾素γ和白細胞介素2等水平也降低,從而抑制巨噬細胞的活化和腫瘤細胞的清除[25]。研究已經顯示了CD4+T細胞可以以MHC Ⅱ類依賴性方式殺死自體腫瘤細胞,提高CD4+T細胞比例是免疫療法的有效途徑之一[26]。使用T細胞激活劑可以改善膀胱癌患者的臨床結果[27]。本研究結果顯示,苦參堿可以劑量依賴性的方式提高膀胱癌小鼠模型中CD4+的比例和CD4+/CD8+值,并且免疫組化染色結果也顯示了苦參堿可以提高腫瘤組織中的CD4+細胞浸潤。最新臨床研究顯示,苦參堿注射液可以通過提高免疫能力對新型冠狀病毒肺炎的治療起到輔助作用[28]。張瑞奎等[29]的研究結果顯示苦參堿可以劑量依賴性地提高乳腺癌大鼠模型外周血中CD3+和CD4+細胞的比例,促進干擾素γ和腫瘤壞死因子α的表達,并抑制免疫抑制因子的表達。這提示苦參堿可通過促進CD4+細胞的水平提高機體的免疫能力,提高腫瘤組織中浸潤的CD4+細胞水平,從而通過分泌干擾素γ和腫瘤壞死因子α誘導巨噬細胞的激活,進而發揮抗膀胱癌功能。
綜上所述,在膀胱癌小鼠模型中,苦參堿不但可以通過抑制TLR4/NF-κB通路誘導膀胱癌細胞的凋亡和抑制增殖,還可以提高CD4+/CD8+值促進CD4+細胞的腫瘤組織浸潤。但是關于苦參堿在膀胱癌中的作用和調控T淋巴細胞的分子機制還需進一步研究。

