高能電子束輻照對獼猴桃細胞壁降解相關酶活性和基因表達的影響
李瑞娟,楊淑霞,王 丹,黃天姿,梁 錦,張 璐,羅安偉
(西北農林科技大學食品科學與工程學院, 陜西楊凌 712100)
獼猴桃因其風味獨特,皮薄多汁,富含維生素C、糖、有機酸、礦物質等多種營養物質而深受消費者青睞[1]。因獼猴桃屬于典型的呼吸越變型水果,常溫下極易軟化、腐爛。質地是評價獼猴桃品質的重要指標之一,對獼猴桃采后商業價值起決定作用。果實軟化伴隨著細胞壁組分降解、過量乙烯生成、活性氧代謝失衡等一系列復雜生理生化過程,其中細胞壁組分降解是導致果實軟化的重要因素之一[2]。果膠和纖維素是構成果實細胞壁的主要多糖物質。在果實貯藏過程中,細胞壁降解酶PG、PME、β-Gal和Cx活性及其基因相對表達量升高,會加速果膠和纖維素降解,細胞壁結構被破壞,導致果實硬度下降[3]。果實軟化使細胞內汁液流出,更易引起微生物侵染,加速腐爛,使其失去商業價值。因此,有必要采取一定措施減緩果實軟化來延長獼猴桃采后貯藏期。
近年來,人們應用各種技術處理獼猴桃來保持品質和延長貨架期。HU等[4]發現漆蠟涂膜通過抑制果實PME和PG活性緩解果膠物質的降解,延緩了獼猴桃的成熟和軟化。朱婷婷等[5]研究發現低溫貯藏可抑制獼猴桃乙烯合成和淀粉降解相關基因表達,保持果實硬度,延緩其成熟進程;另外,富氫水處理獼猴桃可以緩解果實果膠水解和PG、PME和Cx活性升高,延緩果實硬度下降,降低腐爛率[6]。然而,這些保鮮方法存在成本高、化學成分殘留、商業化操作不便等問題,對于獼猴桃采后貯藏仍需尋找一種綠色、安全且高效的保鮮技術。
高能電子束輻照作為一種新型的非熱食品加工技術,具有操作簡便、處理時間短、不產生放射性污染、輻照劑量均勻等優點[7-8]。高能電子束輻照技術應用于新鮮水果,不僅可以有效殺滅果實表面微生物,降低病蟲害,還可抑制果實生理代謝和生化作用,對保持果實營養成分和延長貨架期尤為重要[9]。已有研究報道不同劑量的輻照對藍莓[10]、柑橘[11]、櫻桃[12]等水果均起到了良好的保鮮效果。然而,國內外研究者對于電子束輻照獼猴桃保鮮的研究報道較少,且主要集中在輻照對理化品質、抗氧化活性和外觀的影響[13-14],關于電子束輻照對獼猴桃軟化及相關酶基因表達的影響鮮有報道。因此,本實驗以‘海沃德’獼猴桃為試材,探究不同劑量高能電子束輻照對獼猴桃果實采后貯藏過程中細胞壁組分、相關酶活性及基因表達的影響,探明電子束輻照延緩獼猴桃軟化的機理,以期為電子束輻照保鮮獼猴桃及其他鮮活果蔬提供理論依據。
1 材料與方法
1.1 材料與儀器
‘海沃德’獼猴桃 于2020年10月20日采收自陜西省寶雞市岐山縣永紅獼猴桃專業合作社基地(北緯34.36°,東經107.14°),果實可溶性固形物含量為6.0%~6.5%。挑選成熟度和大小一致、無病蟲害和機械損傷的果實用于實驗;RNAprep Pure多糖多酚植物總RNA提取試劑盒、FastKing cDNA第一鏈合成試劑盒和SuperReal彩色熒光定量預混試劑盒北京天根生化科技有限公司。
ESS-010-03電子直線型加速器(功率為10 MeV,能量為20 kW) 陜西楊凌核盛輻照公司;TAXT PLUS/50物性測定儀(探頭直徑為0.5 cm) 英國Stable Micro systems公司;T-203電子天平 北京科普爾科技發展有限公司;HC-3018R高速冷凍離心機安徽中科中佳科學儀器有限公司;N6000雙光束紫外分光光度計 上海佑科儀器儀表有限公司;NanoDropOne超微量分光光度計 美國賽默飛世爾儀器有限公司;SC46-T100 PCR儀 美國伯樂公司;Q6熒光定量PCR儀 美國生命技術公司。
1.2 實驗方法
1.2.1 輻照處理 根據黃天姿等[15]的研究,設定輻照劑量為300、400和500 Gy,以不做輻照(0 Gy)的果實為對照組。輻照時,將獼猴桃單層擺放于不銹鋼托盤中,通過傳送帶運進輻照室進行輻照。利用重鉻酸銀劑量計監測獼猴桃實際吸收劑量,劑量誤差小于10%。輻照結束后將各組果實用帶孔的0.03 mm厚PE袋包裝后立即運回實驗室,于陰涼處放置24 h散去田間熱后,將其轉移至0~1 ℃、RH 90%~95%冷庫中貯藏。每15 d取一次樣,直到第90 d結束貯藏。每組每次取20個獼猴桃,測定果實硬度和細胞壁組分,部分果肉用液氮速凍,置于-80 ℃冰箱中用于酶活性及基因相對表達量分析。每個指標重復測定3次。
1.2.2 樣品制備 可溶性果膠測定液:稱取3 g獼猴桃果肉,研磨成漿,轉入到50 mL離心管中,加入25 mL 95%乙醇,沸水浴加熱30 min。取出后冷卻至室溫,于8000 r/min離心20 min,棄上清液。再加入95%乙醇,沸水浴加熱,重復3~5次。棄上清,向沉淀物中加入20 mL蒸餾水,在50 ℃水浴中保溫30 min。取出冷卻至室溫,于8000 r/min離心20 min,將上清液移入100 mL容量瓶,用少量蒸餾水洗滌沉淀,離心后將上清并入100 mL容量瓶,用蒸餾水定容,備用。
原果膠測定液:上述蒸餾水洗滌后的沉淀物,仍保留在原刻度離心管中。向其中加入25 mL 0.5 mol/L硫酸溶液,在沸水中加熱1 h。取出冷卻至室溫后,于8000 r/min離心20 min,將上清液移入100 mL容量瓶中,加蒸餾水至刻度,備用。
纖維素測定液:向上述沉淀物中緩慢加入20 mL 60%硫酸,25℃放置30 min使纖維素溶解。取5 mL溶解液,移入100 mL容量瓶中,加蒸餾水至刻度,備用。
粗酶提取液:稱取獼猴桃果肉3 g,加入5 mL經預冷的95%乙醇,冰浴研磨后倒入離心管,低溫放置10 min,于4 ℃、8000 r/min離心20 min。棄上清液,往沉淀物中加入5 mL預冷的80%乙醇,低溫放置10 min,相同條件下離心,棄去上清液,向沉淀物中加入5 mL預冷的磷酸提取緩沖液,于4 ℃放置提取20 min,再離心收集上清液,4 ℃保存備用。
1.2.3 指標測定
1.2.3.1 硬度測定 每組隨機取5個果實,在其赤道部位均勻取3個點,削去果皮,在TPA模式下測定,單位為kg/cm2。
1.2.3.2 細胞壁組分測定 原果膠和可溶性果膠含量參照曹建康等[16]的咔唑比色法測定,纖維素含量參照李圓圓[17]的蒽酮硫酸法測定。具體如下:分別吸取1 mL原果膠、可溶性果膠待測液,加入到25 mL刻度管中,然后小心地沿著管壁加入6 mL濃硫酸,在沸水中加熱20 min,取出冷卻至室溫后,加入0.2 mL 1.5 g/L咔唑-乙醇溶液,搖勻。在暗處放置30 min后,測定反應液在波長530 nm吸光度值。重復三次,含量用%表示。吸取2 mL纖維素待測液,加入到25 mL刻度管中,加0.5 mL 2%蒽酮試劑和6 mL濃硫酸,震蕩后靜置12 min,測定反應液在620 nm處的波長。重復三次,含量用%表示。
1.2.3.3 酶活性測定 PG、β-Gal和Cx活性測定參照曹建康等[16]的二硝基水楊酸法;PME活性測定參照劉耀娜等[18]的溴麝香草酚藍法。具體如下:
PG活性測定:取2支25 mL具塞試管,每支試管中都分別加入1 mL 50 mmol/L、pH5.5乙酸-乙酸鈉緩沖液和0.5 mL 10 g/L多聚半乳糖醛酸溶液。再往其中一支試管中加入0.5 mL 1.2.2中的粗酶提取液,另一支試管中加入0.5 mL經煮沸5 min的酶提取液作為對照,混勻后置于37 ℃水浴中保溫1 h。保溫后,迅速加入1.5 mL 3,5-二硝基水楊酸試劑,在沸水中加熱5 min。然后迅速冷卻至室溫,以蒸餾水稀釋至25 mL,混勻,在波長540 nm處測定吸光度。重復三次,酶活性用mg/(h·g)表示。
β-Gal活性測定:取1.2.2中的粗酶提取液0.4 mL,加0.56 mL 0.1 mol/L pH4.0檸檬酸鹽緩沖液和0.4 mL 13 mmol/L 4-硝基苯-β-D-吡喃葡萄糖苷溶液,37 ℃保溫15 min,加2 mL 0.2 mol/L Na2CO3溶液終止反應,測定波長400 nm處吸光度。重復三次,酶活性用mg/(h·g)表示。
Cx活性測定:取2支25 mL刻度試管編號,分別加入1.5 mL 10 g/L CMC溶液。向一支試管中再加入1.2.2中的0.5 mL粗酶提取液,向另外一支試管中加入0.5 mL經煮沸5 min的酶提取液作為對照,置于37 ℃恒溫水浴保溫1 h。取出后迅速加入1.5 mL 3,5-二硝基水楊酸試劑,在沸水浴中加熱5 min。然后迅速冷卻至室溫,以蒸餾水稀釋至25 mL刻度處,混勻,測定波長540 nm處吸光度。重復三次,酶活性用mg/(h·g)表示。
PME活性測定:稱取3 g獼猴桃果肉,加5 mL 8.8%預冷的NaCl冰浴研磨,于4 ℃、8000 r/min離心20 min,收集上清液,用0.1 mol/L NaOH調pH7.5后即為粗酶提取液,4 ℃保存備用。反應體系包括4 mL 0.5%果膠溶液,0.3 mL 0.01%溴麝香草酚藍,加500 μL粗酶液啟動反應,測定620 nm 處的吸光值。重復三次,酶活性用mg/(h·g)表示。
1.2.3.4 實時定量PCR(qRT-PCR) 以獼猴桃基因組數據庫中(http://bioinfo.bti.cornell.edu/cgi-bin/kiwi/home.cgi)各基因全長序列為模板,采用NCBI的Primer-BLAST在線設計引物(由北京奧科鼎盛生物科技有限公司合成),引物序列如表1所示。
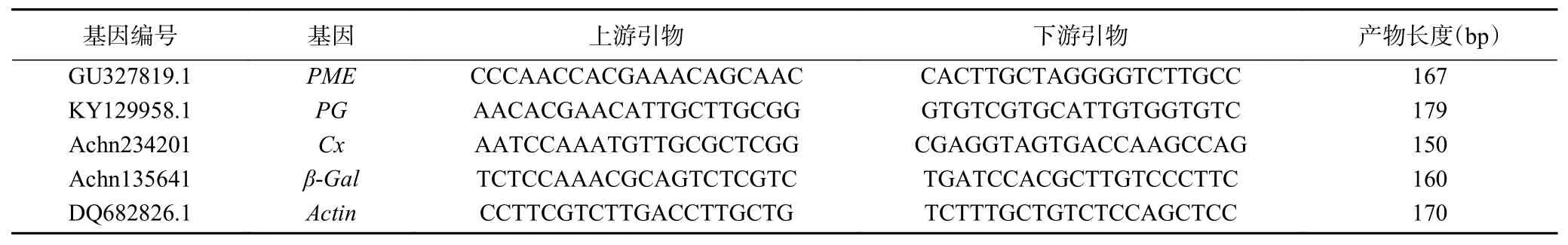
表1 定量RT-PCR引物Table 1 Primers used for qRT-PCR
RT-PCR反應體系為:cDNA模板2 μL、熒光染料10 μL、正反向引物(10 μmol/L)各0.6 μL、RNase-Free ddH2O 6.8 μL。PCR反應程序為:95 ℃ 15 min,1個循環;95 ℃ 10 s,40個循環;62 ℃ 30 s,40個循環。以Actin為參比,通過熒光定量PCR儀測定各基因相對表達量。采用2-ΔΔCT法進行結果分析。
1.3 數據處理
數據結果用平均值±標準誤表示,利用SPSS 20.0軟件進行方差分析,采用Duncan法進行多重比較(P<0.05)。使用Origin 8.5軟件作圖。
2 結果與分析
2.1 電子束輻照對獼猴桃貯藏期果實硬度的影響
硬度是評價果實軟化最直觀的指標。如圖1所示,不同劑量輻照處理的獼猴桃果實硬度隨貯藏時間延長均呈下降趨勢,但輻照組果實硬度總體高于對照組,說明電子束輻照有利于減緩采后獼猴桃貯藏期間果實硬度下降。貯藏后期(60~90 d),四組果實硬度下降速率減慢。貯藏90 d,對照組、300、400和500 Gy輻照組果實硬度分別降低了86.06%、78.22%、75.12%和78.84%。與其他組相比,400 Gy輻照組果實硬度保持效果較好,說明適宜的電子束輻照劑量能延緩果實后熟軟化速率。MOSTAFAVI等[19]發現γ輻照(200~400 Gy)可以保持蘋果硬度,抑制果實在貯藏過程中的軟化;TRUC等[20]研究發現,電子束輻照芒果可顯著抑制果實硬度的下降,這與本研究結論一致。

圖1 電子束輻照對獼猴桃貯藏期果實硬度的影響Fig.1 Effect of electron beam irradiation on firmness of kiwifruit during storage
2.2 電子束輻照對獼猴桃貯藏期原果膠和可溶性果膠含量的影響
果膠參與細胞壁分子間相互作用,主要存在于中間片層和初生細胞壁中,在果實后熟軟化過程中,原果膠會被相關酶水解成可溶性果膠,導致細胞壁結構破壞[21]。如圖2A所示,在整個貯藏期,各組果實中原果膠含量均呈現降低趨勢。獼猴桃果實原果膠含量初始值為0.75%,貯藏的前30 d下降速度最快;貯藏第15~45 d,對照組果實原果膠含量明顯顯著低于其他組(P<0.05),說明在此貯藏期內電子束輻照對維持獼猴桃中原果膠含量效果顯著。在輻照組中,500 Gy組果實原果膠含量在貯藏第45 d和90 d時高于其他兩組,各組果實原果膠含量沒有顯著性差異(P>0.05)。表2相關性分析結果顯示,對照組果實硬度和原果膠含量呈顯著正相關(r=0.865*),而300、400和500 Gy輻照組中二者呈極顯著正相關(r=0.911**、r=0.902**、r=0.910**)。
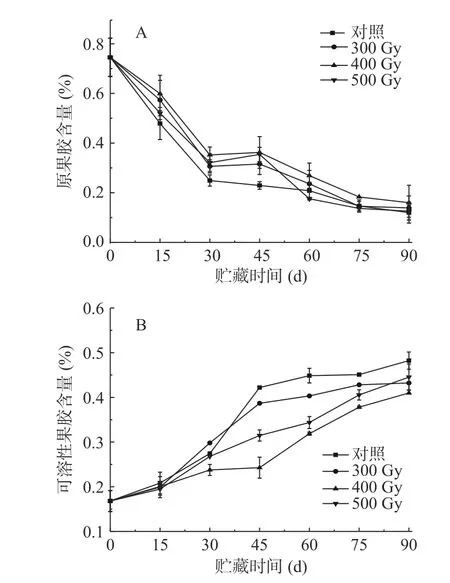
圖2 電子束輻照對獼猴桃貯藏期原果膠(A)和可溶性果膠(B)含量的影響Fig.2 Effect of electron beam irradiation on protopectin (A)and soluble pectin (B) content of kiwifruit during storage
如圖2B所示,各組獼猴桃可溶性果膠含量在貯藏期內均呈升高趨勢。貯藏第0 d,可溶性果膠含量為0.17%,隨著貯藏時間延長,各組果實可溶性果膠含量逐漸升高且均在第90 d時達到峰值,從高到低依次是對照組(0.48%)、500(0.45%)、300(0.43%)和400 Gy(0.41%)輻照組。其中,前15 d,各組之間不存在顯著性差異(P>0.05);30 d時,400 Gy輻照組可溶性果膠含量顯著低于其他三組(P<0.05);45 d時,四組含量差異顯著(P<0.05)。在貯藏中后期(45~90 d),對照組果實可溶性果膠含量顯著高于輻照組(P<0.05),說明電子束輻照對獼猴桃原果膠分解為可溶性果膠起到了一定的抑制作用,使可溶性果膠含量降低。表2相關性分析表明,對照組、300、400、500 Gy組果實硬度和可溶性果膠含量呈極顯著負相關(r=-0.958**、r=-0.963**、r=-0.976**、r=-0.975**)。PRAKASH等[22]用劑量為0.5、1.24和3.70 kGy的γ射線輻照番茄,發現隨著貯藏時間延長和輻照劑量增加,果實可溶性果膠含量有所降低;WANG等[23]報道,2.5 kGy的γ射線輻照的藍莓果實在貯藏期內原果膠含量保持較高水平,可溶性果膠含量增加緩慢。上述結果表明,輻照可以通過調節果膠在果實細胞壁中的溶解來保持細胞壁的完整性,從而減少果實在貯藏過程中的軟化。
2.3 電子束輻照對獼猴桃貯藏期間纖維素含量的影響
纖維素是構成果實細胞壁的另一重要部分,其分解會促進果實變軟。如圖3所示,獼猴桃纖維素含量隨著貯藏時間增加呈現降低趨勢,這與在梨[24]和荔枝[25]中變化類似。貯藏期間,輻照組果實纖維素含量始終高于對照組,差異顯著(P<0.05)。各組果實纖維素含量均在貯藏第90 d時降到最低,從高到低依次是400 Gy>500 Gy>300 Gy>對照組,與獼猴桃初始纖維素含量(5.94%)相比分別下降了3.23%、3.31%、3.49%和4.07%。在輻照組中,400 Gy組果實纖維素含量在整個貯藏期始終保持在最高水平。結果表明適宜劑量的電子束輻照能夠維持貯藏期間獼猴桃果實的纖維素含量,更好的保持細胞壁結構的完整性。表2相關性分析結果顯示,對照組、300、400、500 Gy組果實硬度和纖維素含量呈極顯著正相關(r=0.931**、r=0.925**、r=0.970**、r=0.972**)。
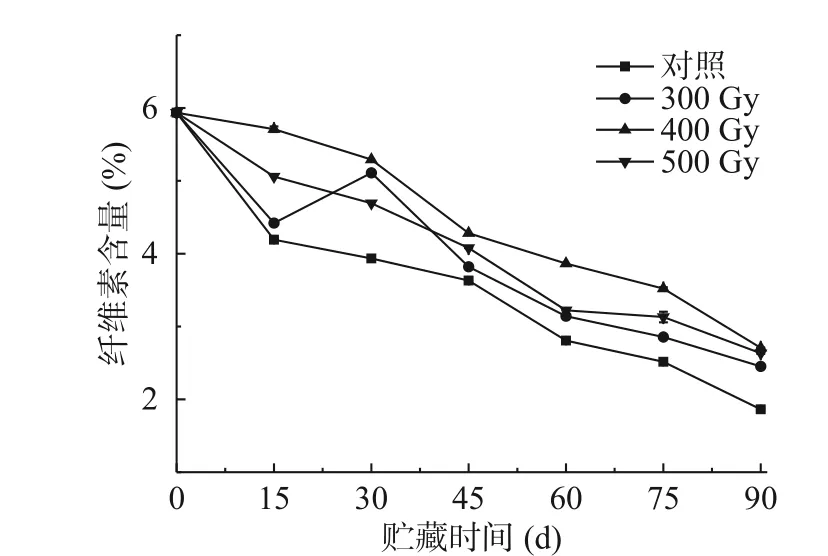
圖3 電子束輻照對獼猴桃貯藏期纖維素含量的影響Fig.3 Effect of electron beam irradiation on cellulose content of kiwifruit during storage
2.4 電子束輻照對獼猴桃貯藏期間細胞壁降解酶活性的影響
PG作為主要的細胞壁降解酶之一,能作用于酯化的高半乳糖醛酸,使細胞壁結構破壞而使果實軟化。PME使果膠去甲酯化,催化生成高半乳糖醛酸,為PG提供反應底物[26]。如圖4A所示,采后獼猴桃果實PG活性總體呈上升趨勢。第0 d時,各組PG活性最低,值為1.46 mg/(h·g)。0~15 d,四組果實PG活性快速上升,15~30 d緩慢下降,30~90 d先快速上升后變為緩慢上升。貯藏0~90 d期間,輻照組獼猴桃PG活性始終低于對照組,從高到低排序為對照組>300 Gy>500 Gy>400 Gy。各組獼猴桃PG活性均在貯藏第90 d時達到峰值,分別為對照組(9.43 mg/(h·g))、300 Gy(8.93 mg/(h·g))、500 Gy(8.71 mg/(h·g))、400 Gy(7.64 mg/(h·g))。研究發現適宜劑量的電子束輻照能使PG活性維持在較低水平,尤其是在貯藏中后期,抑制效果更顯著,這可能是由于電子束輻照使酶分子構象發生了變化,降低酶活性,從而可緩解原果膠的水解。由表2可知,各組獼猴桃PG活性與原果膠含量呈顯著負相關(P<0.05),與果實硬度、纖維素含量均呈極顯著負相關(P<0.01);400 Gy組與可溶性果膠含量呈顯著正相關(P<0.05),其他三組與可溶性果膠含量極顯著正相關(P<0.01),說明PG對促進果實軟化發揮了重要作用。
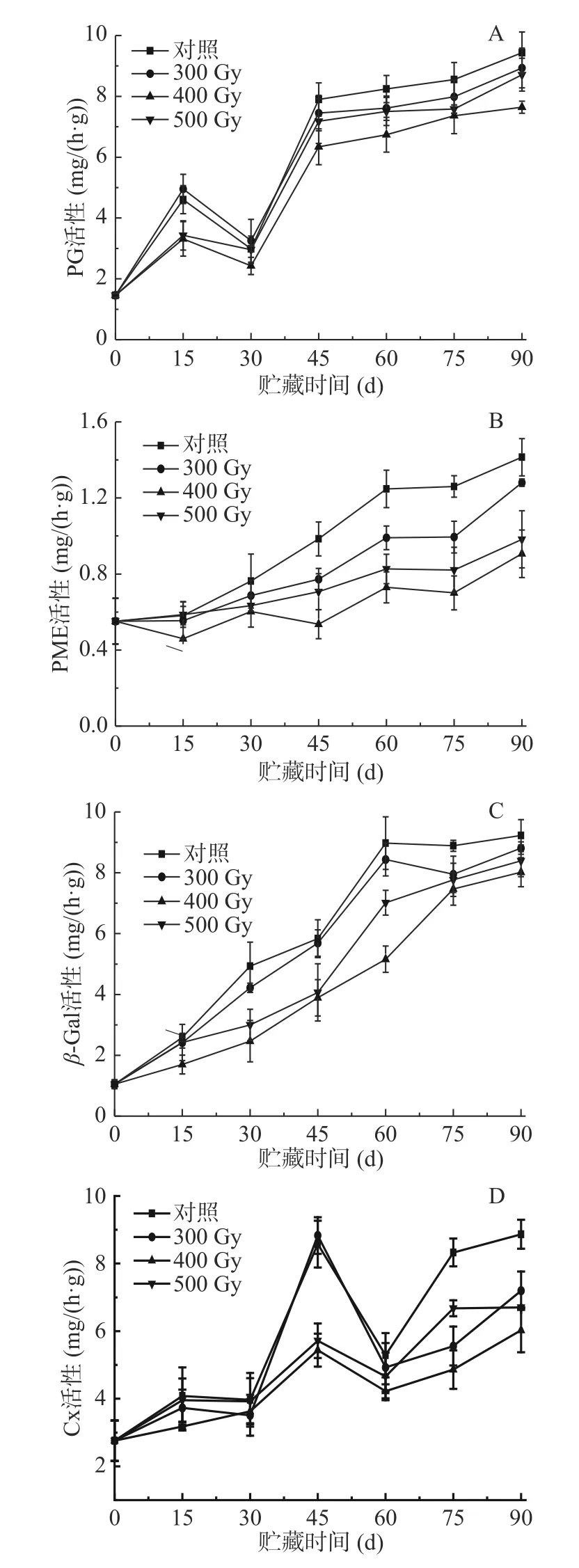
圖4 電子束輻照對獼猴桃貯藏期PG (A)、PME (B)、β-Gal(C)和Cx (D)活性的影響Fig.4 Effect of electron beam irradiation on PG (A),PME(B),β-Gal (C) and Cx (D) activities of kiwifruit during storage

表2 果實硬度、細胞壁組分、酶活性及其基因表達之間的相關性分析Table 2 Correlation analysis of fruit firmness, cell wall components, enzyme activities and gene expressions
如圖4B所示,采后獼猴桃果實PME活性隨著貯藏時間延長呈不斷上升趨勢。貯藏0~15 d,400 Gy組果實PME活性顯著低于其他三組(P<0.05);從第30 d開始至貯藏結束,輻照組獼猴桃PME活性始終低于對照組,差異顯著(P<0.05);而在輻照組果實中,PME活性從高到低依次是300 Gy>500 Gy>400 Gy,表明電子束輻照一定程度上可抑制PME活性的上升,減少了PG作用底物,從而保持細胞壁組分不被解聚。表2結果顯示,各組獼猴桃PME活性與果實硬度呈極顯著負相關(P<0.01),與原果膠含量呈顯著負相關(P<0.05);對照組、400、500 Gy果實PME活性與可溶性果膠含量呈極顯著正相關(P<0.01),而300 Gy組二者呈顯著正相關(P<0.05);對照組、300、500 Gy果實PME活性與纖維含量呈極顯著負相關(P<0.01),而400 Gy組二者呈顯著負相關(P<0.05)。Martins等[27]研究表明,經1030 Gy的γ射線處理后的桃果實,PG和PME活性在其貯藏期間不受輻照的影響,說明不適宜劑量的輻照對延緩果實軟化作用沒有積極影響。陳召亮等[28]發現用2 kGy以上劑量的電子束輻照處理草莓,顯著降低了PG、PME和Cx活性,延緩細胞壁的降解,這一結果與本文一致。
β-Gal可以去除細胞壁多糖側鏈中的半乳糖殘基,促進細胞壁結構的解體。如圖4C所示,四組果實β-Gal活性在貯藏0~90 d內不斷上升,至90 d時達到峰值,對照組、300、400和500 Gy組分別為9.23、8.81、8.02和8.39 mg/h·g。在整個貯藏期,輻照組果實β-Gal活性始終低于對照組,其中,貯藏15~75 d內,400和500 Gy組獼猴桃β-Gal活性顯著低于對照組和300 Gy組(P<0.05)。在輻照組中,400 Gy組獼猴桃中β-Gal活性在整個貯藏過程保持最低水平,說明適宜劑量電子束輻照能夠顯著鈍化β-Gal活性,減緩獼猴桃果實采后貯藏時的質地軟化。相關性分析表明,各組獼猴桃β-Gal活性與果實硬度、原果膠含量和纖維素含量呈極顯著負相關(P<0.01),與可溶性果膠含量呈極顯著正相關(P<0.01)(表2),表明β-Gal活性增強與果實質地變軟密切相關。
Cx通過將纖維素和半纖維素水解成葡萄糖分子來破壞細胞壁結構。如圖4D所示,獼猴桃果實Cx活性整體上呈上升趨勢,說明在貯藏過程中果實纖維素含量會不同程度降低。前15 d內,400 Gy組Cx活性顯著低于其他組(P<0.05);貯藏第30~60 d,400和500 Gy組Cx活性顯著低于對照組和300 Gy組(P<0.05),組間差異不顯著(P>0.05);之后,各組Cx活性均明顯升高,至貯藏結束,對照組Cx活性達到最高,值為8.87 mg/h·g,分別是300、400和500 Gy組的1.23、1.47倍和1.32倍,組間差異顯著(P<0.05)。電子束作為一種非熱加工方式,并不能使果實溫度達到酶的失活的溫度,而是通過電子槍發出的高能電子束直接破壞酶的空間結構致其失活。由表2可知,對照組獼猴桃Cx活性與果實硬度、原果膠、可溶性果膠、纖維素含量呈顯著相關(P<0.05),而在300 Gy輻照組果實中相關性不顯著;400 Gy輻照組中Cx活性與果實硬度、原果膠、可溶性果膠含量呈顯著相關(P<0.05),與纖維素含量呈極顯著相關(P<0.01)。相比對照組,電子束輻照能使獼猴桃果實Cx活性在貯藏期間保持較低水平,有效抑制纖維素被降解,維持細胞壁結構。這與陸仙英等[29]以3和6 kJ/m2的短波紫外線(UV-C)照射香梨時Cx活性顯著低于對照組的結果相類似。
果實軟化主要是由細胞壁降解相關酶對細胞壁的水解引起的,因此采后果實酶活性的控制對于延長貨架期至關重要。SINGH等[30]研究了腐胺(PUT)在1、2和3 mmol/L條件下對梨果采后浸泡處理的影響,結果表明2和3 mmol/L的PUT能夠抑制PME和Cx的活性,保持梨果實品質。TANG等[31]以紅棗為原料,用褪黑素處理后發現抑制了果實PG、PME、β-Gal和Cx活性以及可溶性果膠的產生,并保持原果膠含量,從而延緩果實衰老。GE等[32]在探究磷酸三鈉(0.5 g/L)處理對棗果軟化的影響時也有相同的結果。上述結果表明,不同的處理方式均不同程度抑制了細胞壁降解酶活性的升高,減緩了果實果膠和纖維素的降解,延緩了獼猴桃后熟軟化進程。
2.5 電子束輻照對獼猴桃貯藏期間細胞壁降解酶基因表達的影響
如圖5A所示,在冷藏過程中,PG表達量在對照果和輻照果中均有所增加,輻照組獼猴桃PG表達量始終低于對照組。其中,貯藏0~15 d,輻照組果實PG表達量顯著低于對照組,但各輻照組之間差異不顯著(P>0.05);從第30 d開始至貯藏結束,四組果實PG表達量差異顯著(P<0.05),說明采后電子束輻照對獼猴桃冷藏期間PG調控明顯,基本維持在較低水平,特別是400 Gy電子束輻照對于抑制PG表達量的增加效果最明顯。表2相關性分析顯示,對照組中PG表達量與果實硬度、原果膠、可溶性果膠、纖維素含量呈極顯著相關(P<0.01),在500 Gy組中呈顯著相關(P<0.05);300和400 Gy組中,PG表達量與果實硬度、可溶性果膠、纖維素含量呈顯著相關(P<0.05),而與原果膠含量呈極顯著相關(P<0.05)。
如圖5B所示,隨著獼猴桃采后貯藏時間的延長,PME基因表達量不斷提高。貯藏前期(0~30 d),對照組和300 Gy組PME表達量均呈先升高后降低趨勢,而400和500 Gy組開始緩慢降低,組間差異顯著(P<0.05)。貯藏中后期(30~90 d),四組果實PME表達量隨著貯藏時間延長而不斷增加。總體而言,各組獼猴桃PME表達水平從高到低依次是對照組>300 Gy>500 Gy>400 Gy,即輻照組在整個貯藏期均顯著低于對照組(P<0.05),且輻照組間也存在顯著差異(P<0.05)。表2顯示,對照組中PME表達量與原果膠、纖維素含量呈顯著負相關(P<0.05),與果實硬度、可溶性果膠相關性不顯著;而輻照組中五個指標相關性都不顯著。可見,與對照相比,不同劑量的電子束輻照對獼猴桃PME基因相對表達量抑制效果明顯。WANG等[33]的研究結果表明,殼聚糖涂膜處理對草莓果實冷藏過程中延緩軟化效果明顯,主要歸因于PG和PME活性以及PG1和PME1轉錄水平受到抑制。POMBO等[34]研究報道紫外-碳輻射對草莓果實軟化的影響可能與處理后細胞壁降解相關基因轉錄的減少有關。上述結果表明,不同的保鮮方式均有效抑制了果實采后貯藏過程中PG和PME基因的表達,進而減緩軟化速率。
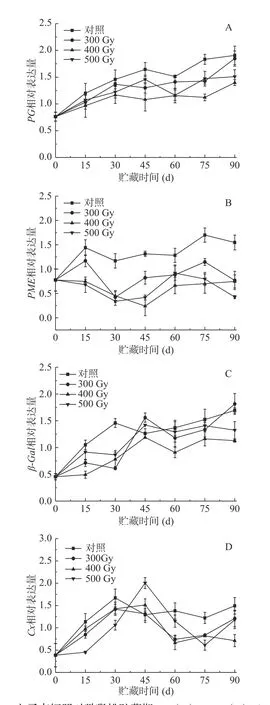
圖5 電子束輻照對獼猴桃貯藏期PG (A)、PME (B)、β-Gal(C) 和Cx (D)基因表達的影響Fig.5 Effect of electron beam irradiation on PG (A), PME(B), β-Gal (C) and Cx (D) gene expressions of kiwifruit during storage
如圖5C所示,整個貯藏期,獼猴桃果實β-Gal相對表達量呈上升趨勢,到貯藏第30 d,輻照組顯著低于對照組(P<0.05);之后,400 Gy組顯著低于其他組(P<0.05);貯藏第90 d時,對照組、300、400和500 Gy組β-Gal相對表達量分別增加了1.67、1.81、1.13和1.32,可知400 Gy組β-Gal基因表達量較其他組β-Gal表達量上升更緩慢,說明電子束輻照劑量為400 Gy時能有效抑制β-Gal基因的表達。表2表明,對照組β-Gal相對表達量與硬度、可溶性果膠含量呈顯著相關(P<0.05),與原果膠、纖維素含量呈極顯著負相關(P<0.05);在300、400和500 Gy組中,β-Gal與硬度呈顯著負相關(P<0.05)(表2)。
如圖5D所示,在整個貯藏期,獼猴桃果實Cx基因表達水平呈先上升后降低趨勢。其中,對照組和300 Gy組Cx基因在第30 d時達到最高表達量,分別為1.67和1.42,而400和500 Gy組在第45 d時達到峰值,分別為1.51和2.00。從60 d開始到貯藏結束,對照組Cx基因相對表達量顯著高于輻照組(P<0.05),與原果膠含量呈顯著負相關(r=-0.870*)(表2)。貯藏期間,500 Gy組果實Cx基因表達量與300和400 Gy組差異顯著(P<0.05)。同時,劑量為400和500 Gy的電子束輻照延遲了獼猴桃果實Cx基因表達高峰的出現,且在貯藏大多數時期輻照組低于對照組,表明適宜劑量電子束輻照可以通過抑制獼猴桃Cx基因的表達來降低果實的軟化速率。WANG等[35]研究顯示MeJA處理的藍莓果實表現出更高含量原果膠和纖維素,及更低水平的可溶性果膠。此外,MeJA處理顯著抑制果實PG、PME、β-Gal和Cx活性和轉錄水平,保持果實硬度。SHI等[36]發現殼聚糖-水楊酸聯合處理對保持葡萄柚果實硬度的作用可能歸因于其抑制PG、PME、Cx和β-Gal活性及其基因表達的能力。以上結果表明,電子束輻照、MeJA處理和殼聚糖-水楊酸聯合處理可以通過抑制細胞壁降解酶活性及其基因表達水平來調節果實細胞壁多糖降解過程,從而減緩貯藏期間果實硬度下降。
3 結論
果實細胞壁組分降解引起獼猴桃軟化,細胞壁降解酶是加速果實后熟軟化的重要原因。研究結果表明,高能電子束輻照有效延緩了‘海沃德’獼猴桃原果膠和纖維素含量的下降及可溶性果膠含量的上升,降低了PG、PME、β-Gal和Cx活性。同時,電子束輻照通過抑制PG、PME、β-Gal和Cx基因的表達水平,維持果實硬度,延長獼猴桃采后貯藏期。相比于300和500 Gy,400 Gy劑量的電子束輻照對獼猴桃細胞壁水解酶活性及其基因相對表達量具有更顯著的調控作用,從而抑制了獼猴桃果實原果膠和纖維素的降解,保持細胞壁結構完整,延遲了果實軟化進程。

