木瓜皮多酚和黃酮提取工藝優化及酪氨酸酶與胰脂肪酶抑制活性研究
裴文清,呂瀘楠,王靖宇,浦思琦,雷 霜,王春麗
(華東理工大學藥學院, 制藥工程與過程化學教育部工程研究中心,上海市新藥設計重點實驗室, 上海 200237)
木瓜是一種常見的熱帶水果,被認為是類胡蘿卜素、葉酸、礦物質和抗壞血酸等的重要營養來源[1]。據報道,木瓜各部位都具有藥用價值,如花可用于治療黃疸和高血壓,果肉可用于預防風濕病,葉子可用于治療癌癥[2-3]。SILVA等[4]認為木瓜皮含有的酚類物質可能極為豐富,因此木瓜皮作為果實加工過程中產生的廢渣,其相當于果實重量的12%[5],若不能合理利用,將會對環境和經濟造成一定負擔,但是針對木瓜皮多酚類物質研究較少,主要集中在功能性食品開發上,如JIANG等[6]通過添加一定量的木瓜籽與果皮制備小麥餅干,HIRAGA等[7]研究將未成熟木瓜皮和果肉變為功能性食品的可能性。
黑色素在保護皮膚免受紫外線輻射方面具有重要作用。然而,黑色素的過量產生會導致各種皮膚疾病,如雀斑、黃褐斑、老年斑和黑色素瘤[8]。酪氨酸酶(EC 1.14.18.1)在黑色素生成過程中起著關鍵作用,其催化左旋酪氨酸(L-Tyr)羥基化為左旋多巴(LDopa),后者氧化為多巴醌,進而自發轉化為多巴色素,隨后轉化為5,6-二羥基吲哚并進一步氧化和聚合生成黑色素[9],因此,抑制酪氨酸酶可有效阻止黑色素的生成,并可用于美白化妝品、臨床、制藥等行業。曲酸作為美白化妝品中的酪氨酸酶抑制劑,由于可能會致癌已經被一些國家禁用[10],因此,追求毒性較低且有效的酪氨酸酶抑制劑仍是研究熱點。多酚類化合物副作用小,毒性低,是最常見的酪氨酸酶抑制劑[11-12],黃酮類化合物因含有酚羥基同樣具有酪氨酸酶抑制作用[13],如柳偉等[14]發現木瓜皮具有較好地酪氨酸酶抑制活性,可能與其多酚含量有關。
肥胖和超重會引起各種疾病,如糖尿病、心血管疾病、癌癥和神經退行性疾病[15]。胰脂肪酶(EC 3.1.1.3)是由胰腺合成和分泌的,可水解腸腔中50%~70%的脂肪,并將其水解成甘油和脂肪酸,因此抑制胰脂肪酶將有助于降低體重、降低高脂血癥以及預防與肥胖相關的疾病[16-17]。皂苷類、萜類和酚類都是抑制胰脂肪酶的活性成分,但是酚類是研究最多的胰脂肪酶抑制劑,比如烏龍茶、白茶、綠茶和紅茶多酚均抑制胰脂肪酶[18-19]。
近年來,針對木瓜皮酚類化合物抗氧化活性的研究較多[20-21],然而缺乏對酪氨酸酶及胰脂肪酶抑制活性的研究,基于此,本文一方面優化木瓜皮多酚和黃酮提取工藝,另一方面評價木瓜皮抑制酪氨酸酶及胰脂肪酶的活性,從而為綜合利用木瓜皮提供思路。
1 材料與方法
1.1 材料與儀器
新鮮木瓜 購買于河南平頂山牛家村農貿市場;抗壞血酸(VC) 分析純,上海源聚生物科技有限公司;奧利司他、曲酸、棕櫚酸對硝基苯酯 分析純,上海阿拉丁生化科技股份有限公司;蘆丁、福林-酚試劑、亞硝酸鈉、碳酸鈉 分析純,上海麥克林有限公司;九水硝酸鋁、過硫酸鉀、氫氧化鈉 分析純,國藥試劑;2, 2'-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸[2, 2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS] 分析純,Sigma-Aldrich公司;沒食子酸 分析純,國安試劑;胰脂肪酶(100 U/mL)、1, 1-二苯基-2-三 硝 基 苯 肼 (2, 2-diphenyl-1-picrylhydrazy,DPPH) 分析純,上海源葉生物科技有限公司;酪氨酸酶(73 U/mL) 美國Worthington公司;左旋酪氨酸、左旋多巴 分析純, Aladdin公司。
JY5002電子天平 上海復平儀器儀表有限公司;UV-1900PC紫外分光光度計 上海奧譜勒儀器有限公司;SK331OHP型超聲波清洗儀 上海科導超聲儀器有限公司;WK-400B型高速藥物粉碎機山東精誠機械有限公司;多功能酶標儀 美國伯騰儀器有限公司;SHZ-3循環水多用真空泵 上海予華分析儀器有限公司;RE-52AA型旋轉蒸發儀 上海振捷實驗設備有限公司。
1.2 實驗方法
1.2.1 原料預處理 新鮮木瓜洗凈削皮,將果皮切成絲狀,50 ℃烘干至恒重,粉碎過30目篩,于-20 ℃保存備用。
1.2.2 提取工藝 稱取2.0 g木瓜皮粉末,加入一定量一定濃度的乙醇,在一定溫度下以180 W超聲提取一定時間后,抽濾,濾渣重復提取一次,旋轉蒸發除去乙醇,定容,備用。
1.2.3 單因素實驗
1.2.3.1 超聲溫度對木瓜皮多酚與黃酮提取的影響稱取2.0 g木瓜皮粉末,按超聲功率180 W,料液比1:20 g/mL,超聲時間30 min,乙醇濃度50%,分別在30、40、50、60、70 ℃超聲溫度下進行提取,探究不同超聲溫度對木瓜皮多酚和黃酮提取量的影響,并確定最佳超聲溫度。
1.2.3.2 超聲時間對木瓜皮多酚與黃酮提取的影響稱取2.0 g木瓜皮粉末,按超聲功率180 W,料液比1:20 g/mL,超聲溫度40 ℃,乙醇濃度50%,分別在15、30、45、60、75 min超聲時間下進行提取,探究不同超聲時間對木瓜皮多酚和黃酮提取量的影響,并確定最佳超聲時間。
1.2.3.3 乙醇濃度對木瓜皮多酚與黃酮提取的影響稱取2.0 g木瓜皮粉末,按超聲功率180 W,料液比1:20 g/mL,超聲溫度40 ℃,超聲時間 60 min,分別在40%、50%、60%、70%、80%乙醇濃度下進行提取,探究不同乙醇濃度對木瓜皮多酚和黃酮提取量的影響,并確定最佳乙醇濃度。
1.2.3.4 料液比對木瓜皮多酚與黃酮提取的影響稱取2.0 g木瓜皮粉末,按超聲功率180 W,超聲溫度40 ℃,乙醇濃度50%,超聲時間60 min,分別在1:10、1:15、1:20、1:25、1:30 g/mL料液比的條件下進行提取,探究不同料液比對木瓜皮多酚和黃酮提取量的影響,并確定最佳料液比。
1.2.4 正交試驗 在單因素實驗基礎上,以多酚和黃酮含量為評價指標,設計L9(34)正交試驗用以確定提取木瓜皮多酚和黃酮的最佳工藝條件,實驗因素設計見表1。

表1 正交試驗因素水平設計Table 1 Factors and levels of orthogonal experiment
1.2.5 多酚含量測定 參照文獻[20]并略作修改:取樣品溶液1.5 mL,加入1.0 mL福林酚試劑,混勻后靜置5 min后加入2.0 mL 10% Na2CO3,混合后定容到25 mL,25 ℃放置1 h后于765 nm處測定吸光度。以(0~16 μg/mL)沒食子酸為標準品,繪制標準曲線y=0.1208x-0.0022(R2=0.9996)。多酚含量(以沒食子酸計)用mg/g表示。
1.2.6 黃酮含量測定 參照文獻[21]并略作修改:取樣品溶液0.2 mL,分別加5%亞硝酸鈉溶液0.4 mL,搖勻放置6 min后加10%硝酸鋁溶液0.4 mL,搖勻放置6 min,加入4%氫氧化鈉溶液4 mL,最后用50%乙醇溶液加至刻度線,搖勻放置15 min后,分別于510 nm處測定吸光度。以( 0~80 μg/mL)蘆丁為標準品,繪制標準曲線y=0.0145x+0.0008(R2=0.9996)。黃酮含量(以蘆丁計)用mg/g 表示。
1.2.7 抗氧化活性測定
1.2.7.1 DPPH自由基清除能力參考文獻[20]并略作改動。取一系列濃度(0.2~1.0 mg/mL)的樣品溶液1 mL及4 mL 0.02 mg/mL DPPH 溶液加入試管中,混勻后放置30 min,并在517 nm處測定吸光度A1。測定用無水乙醇代替DPPH溶液時的吸光度A2,用50%乙醇代替樣品溶液時的吸光度A0;VC作同樣處理,DPPH自由基的清除率按公式1計算。

1.2.7.2 ABTS自由基清除能力測定 參照文獻[22]配制ABTS儲備液,并用無水乙醇調整使其在734 nm處 的 吸 光 值 處 在(0.7000±0.005),即 得ABTS工作液。取一系列濃度(0.2~1.0 mg/mL)的樣品溶液1 mL及4 mL的ABTS工作液中放入試管中,充分混勻,暗處反應6 min 后在734 nm下測定吸光值A1,同時測定用無水乙醇代替ABTS時的吸光度A2,用蒸餾水代替樣品溶液時的吸光度A0。VC作同樣處理,ABTS自由基的清除率參考公式1計算。
1.2.8 抑制酶活性測定
1.2.8.1 抑制酪氨酸酶活性參考文獻[23]并略作改動,按表2進行反應,分別以左旋酪氨酸和左旋多巴作為底物,將50 μL磷酸鹽緩沖液(0.2 mol/L,pH6.8),20 μL酪氨酸酶溶液和50 μL樣品提取液添加到96孔板中,在37 ℃下恒溫10 min。隨后,加入80 μL底物,在37 ℃下恒溫5 min。最后,通過使用酶標儀測量在475 nm下的溶液吸光值。曲酸作同樣處理。酪氨酸酶抑制率按公式2計算。

表2 反應體系組成Table 2 Composition of reaction system

式中:Aa代表無樣品的對照組的吸光度;Ab代表不含樣品和酶的空白對照組的吸光度;Ac代表樣品含有酶的吸光度;Ad代表不含酶的樣品對照組的吸光度。
1.2.8.2 抑制胰脂肪酶活性 棕櫚酸對硝基苯酯作為脂肪酶的水溶性底物,被酶水解可得黃色產物4-硝基苯酚,因此本實驗使用棕櫚酸對硝基苯酯作為底物,參考文獻[24]并略作改動,按表3進行反應,將30 μL磷酸緩沖液、50 μL胰脂肪酶溶液和20 μL樣品提取液加到96孔板中,在37 ℃恒溫15 min,隨后,加入100 μL底物,在37 ℃恒溫15 min。最后,通過使用酶標儀測量在405 nm下的溶液吸光值。奧利司他作同樣處理。胰脂肪酶抑制率參考公式2計算。

表3 反應體系組成Table 3 Composition of reaction system
1.3 數據處理
所有試驗均重復測定三次,數值表示為平均值±標準差。利用Origin 8.0作圖,采用正交設計助手進行實驗設計和方差分析。
2 結果與分析
2.1 單因素實驗結果
2.1.1 超聲溫度對提取木瓜皮多酚和黃酮的影響由圖1可知,多酚和黃酮含量整體呈先上升后下降的趨勢,當溫度從30 ℃升高到 40 ℃時,木瓜皮多酚和黃酮含量緩慢增長,當提取溫度為40 ℃時,多酚和黃酮含量均達到最高,分別為(75.79±1.42)mg/g和(153.56±3.25)mg/g,當溫度超過40 ℃時,多酚和黃酮含量開始減少,說明多酚和黃酮含量受溫度影響較大,當溫度升高時,分子運動劇烈,擴散性增大,隨之含量增加,但當溫度過高時,可能影響到分子的穩定性,導致結構遭到破壞,致含量下降[25]。因此,選擇40 ℃為最佳超聲溫度。

圖1 超聲溫度對木瓜皮多酚和黃酮含量的影響Fig.1 Effect of ultrasonic temperature on polyphenols and flavonoids contents of papaya peel
2.1.2 超聲時間對提取木瓜皮多酚和黃酮的影響由圖2可知,隨著超聲時間的延長,木瓜皮多酚和黃酮含量整體上一直有所增加,當時間為60 min時,多酚和黃酮含量均達到最高,分別是(72.34±0.33)mg/g和(157.01±3.25)mg/g,而當超聲時間超過60 min,多酚和黃酮含量下降趨勢較大,可能是由于時間延長,伴隨著超聲過程中溶液溫度的升高,導致酚類物質發生氧化、降解,致使其含量下降[26]。因此選擇60 min作為超聲時間比較合適。

圖2 超聲時間對木瓜皮多酚和黃酮含量的影響Fig.2 Effect of ultrasonic time on polyphenols and flavonoids contents of papaya peel
2.1.3 乙醇濃度對提取木瓜皮多酚和黃酮的影響由圖3可知,乙醇濃度在40%~50%范圍內時,木瓜皮多酚和黃酮含量隨著濃度的增大而增大,當乙醇濃度為50%時,木瓜皮多酚和黃酮含量均達到最高,分別是(80.85±0.56)mg/g和(159.31±4.88)mg/g。當乙醇濃度超過50%時,木瓜皮多酚和黃酮含量逐漸減少。乙醇濃度會影響木瓜皮中多酚和黃酮含量,考慮到水與乙醇互溶,因此需要選擇合適的比例[27]。此外,當乙醇濃度較小時,不能完全溶解木瓜皮中的多酚和黃酮類物質,當濃度過大時,又可能使木瓜皮中其他溶于醇的雜質流出,而導致其含量降低[28]。因此選擇50%乙醇濃度比較合適。
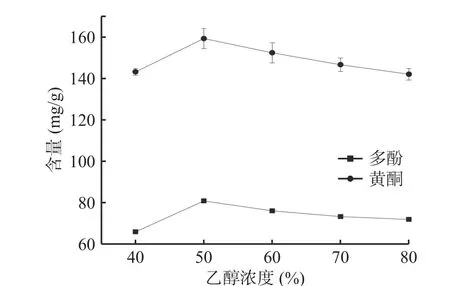
圖3 乙醇濃度對木瓜皮多酚和黃酮含量的影響Fig.3 Effect of ethanol concentration on polyphenols and flavonoids contents of papaya peel
2.1.4 料液比對提取木瓜皮多酚和黃酮的影響 由圖4可知,隨著料液比的增大,木瓜皮多酚和黃酮含量開始逐漸增大,當料液比為1:20 g/mL時,多酚和黃酮含量均達到最大值,分別為(79.70±0.86)mg/g和(160.46±4.30)mg/g,超過1:20 g/mL時,多酚和黃酮含量開始減少,可能是當料液比為1:20 g/mL時,木瓜皮中多酚和黃酮已全部溶出,再增大料液比可能使其他醇溶性雜質析出,與活性成分共同競爭溶出空間從而導致含量下降[29]。因此,選擇1:20 g/mL為最佳料液比。

圖4 料液比對木瓜皮多酚和黃酮含量的影響Fig.4 Effect of solid-liquid ratio on polyphenols and flavonoids contents of papaya peel
2.2 正交試驗結果
通過單因素實驗,可知木瓜皮多酚與黃酮含量受超聲溫度(A)、超聲時間(B)、乙醇濃度(C)和料液比(D)的影響較大,故而設計L9(34)正交試驗,考察多酚與黃酮的最佳提取工藝,并進行分析,結果見表4,表5。
結合表4與表5,可知4個因素影響木瓜皮多酚和黃酮含量趨勢一致,均為D(料液比)>B(超聲時間)>A(超聲溫度)>C(乙醇濃度),此外木瓜皮多酚和黃酮通過正交試驗得到的最優組合一致,均為A2B2C3D3,即超聲溫度40 ℃、超聲時間60 min、乙醇濃度60%、料液比1:25 g/mL。

表4 正交試驗結果Table 4 Results of orthogonal experiment

表5 方差分析結果Table 5 Results of variance analysis
2.3 驗證實驗
按照最佳提取工藝條件A2B2C3D3進行三次平行實驗,結果得到多酚含量平均為(82.00±0.65)mg/g,黃酮含量平均為(162.76±2.82)mg/g,均高于上述9個實驗組合,說明經過正式試驗優化得到的木瓜皮提取工藝組合較為可行。
2.4 抗氧化活性測定結果
2.4.1 DPPH自由基清除率測定 DPPH是一種穩定的自由基,當接受電子或自由基時,溶液顏色由紫色逐漸變淡,同時伴隨著在最大波長處吸光值的降低,故可根據吸光值的變化評價物質的抗氧化活性[30]。結合圖5,木瓜皮提取物有較強的清除DPPH自由基的能力。當濃度為0.2 mg/mL時,清除率為(67.74%±0.27%),高于ASGHAR等[31]研究中木瓜皮對DPPH自由基的清除率,這可能是因為木瓜皮提取物中含有較高的多酚和黃酮類物質。當濃度從0.2 mg/mL增加到0.8 mg/mL時,清除率整體增長較快,而當濃度超過0.8 mg/mL時,清除率增長緩慢甚至基本不變,當處于最大濃度時,木瓜皮提取物和VC對DPPH自由基的清除率分別為(94.79%±0.10%)和(96.00%±0.10%),故木瓜皮提取物抗氧化活性較強。

圖5 DPPH自由基清除實驗結果Fig.5 Results of DPPH free radical scavenging capacity
2.4.2 ABTS自由基清除率測定 由圖6可知,木瓜皮提取物具有清除ABTS自由基的能力。當濃度處于0.2 mg/mL時,木瓜皮提取物和VC對ABTS自由基清除率分別達到(93.27%±0.23%)和(98.35%±0.17%),說明在較低濃度范圍就具有較強的抗氧化活性。當濃度高于0.6 mg/mL時,清除率增長緩慢直至基本不變,當濃度達到最大時,木瓜皮提取物對ABTS自由基清除率為(96.94%±0.23%),略高于澳洲堅果青皮(89.14%±0.33%)[32],接近于香芋皮(99.82%±0.07%)[33],說明木瓜皮提取物有較強的抗氧化活性,具有應用于天然抗氧化劑的潛力。

圖6 ABTS自由基清除實驗結果Fig.6 Results of ABTS free radical scavenging capacity
2.5 抑制酶活性測定結果
2.5.1 酪氨酸酶抑制活性測定 本文分別以L-Tyr和L-Dopa作為底物,發現木瓜皮提取物具有酪氨酸酶抑制活性,結果見圖7。在2.0~10.0 mg/mL濃度范圍內,木瓜皮提取物對酪氨酸酶抑制活性隨著濃度的增大而增強,并呈現較好的線性關系和劑量效應關系。當濃度為8.0 mg/mL時,木瓜皮提取物以L-Tyr為底物的酪氨酸酶抑制率達到(69.44%±3.93%),略高于LEE等[34]研究中木瓜對酪氨酸酶的抑制率。在質量濃度為10.0 mg/mL 時,以L-Tyr作為底物,木瓜皮提取物抑制率為(83.33%±6.80%);以L-Dopa作為底物,木瓜皮提取物抑制率為(67.12%±0.32%),結果表明,木瓜皮提取物能在一定程度上抑制酪氨酸酶活性,可能會阻止或者中斷黑色素形成,揭示木瓜皮或許可作為潛在的酪氨酸酶抑制劑,成為美白化妝品的天然原料。

圖7 酪氨酸酶抑制活性實驗結果Fig.7 Results of tyrosinase inhibitory activity
2.5.2 胰脂肪酶抑制活性測定 木瓜皮提取物具有良好的胰脂肪酶抑制活性,結果如圖8所示。在2.0~10.0 mg/mL濃度范圍內,木瓜皮提取物對胰脂肪酶抑制率隨著濃度的增大而增加,表現出較好地線性關系。在最大濃度時,木瓜皮提取物對胰脂肪酶抑制率為(82.78%±1.28%),高于木瓜汁對胰脂肪酶的抑制率[35],說明木瓜皮具有開發為胰脂肪酶抑制劑的潛力。

圖8 胰脂肪酶抑制活性實驗結果Fig.8 Results of pancreatic lipase inhibitory activity
3 結論
本實驗對木瓜皮多酚和黃酮的提取工藝進行了優化,發現兩者最佳提取條件一致,即超聲溫度40 ℃、超聲時間60 min、乙醇濃度60%、料液比1:25 g/mL,在此條件下多酚和黃酮的含量分別為(82.00±0.65)mg/g和(162.76±2.82)mg/g。
在最優提取條件下,評價木瓜皮提取物的抗氧化、酪氨酸酶和胰脂肪酶抑制活性。木瓜皮提取物對DPPH自由基、ABTS自由基的清除率分別可達(94.79%±0.10%)和(96.94%±0.23%),接近VC對這兩種自由基的最大清除率,說明木瓜皮具有較好地抗氧化活性。
以L-Tyr為底物,發現木瓜皮提取物對酪氨酸酶具有較強地抑制活性,說明木瓜皮提取物可能會阻止酪氨酸酶將L-Tyr羥基化為L-Dopa,而以LDopa為底物,發現木瓜皮提取物仍具有一定的酪氨酸酶抑制活性,說明木瓜皮提取物可能會阻止酪氨酸酶將L-Dopa氧化為多巴醌。此外,木瓜皮提取物還具有較強地胰脂肪酶抑制活性,抑制率可達(82.78%±1.28%),表明木瓜皮可能是較好地胰脂肪酶抑制劑,能阻止或中斷胰脂肪酶將脂肪水解為甘油和游離脂肪酸從而減少腸道吸收。由此可知,木瓜皮具有開發為酪氨酸酶和胰脂肪酶抑制劑的潛力,并可應用于美白化妝品、醫學美容、減肥和醫療等行業。

