鐵基載氧體煤化學鏈制氫的強化反應
安 陽,袁思杰,吳 曼,王凌云,郭慶杰
(青島科技大學 化工學院,山東 青島 266042)
二氧化碳的排放會導致氣候變化,而氫能作為一種燃燒效率高、無碳排放的二次能源受到廣泛關注[1-2]。目前的制氫方式主要是化石燃料重整制氫[3]和可再生資源制氫[4],工業上常用的蒸汽甲烷重整(SMR)制氫需要變壓吸附裝置(PSA)脫除CO2,能耗較大[5]。我國煤炭資源豐富,開發煤炭高效制氫方式迫在眉睫[6-8]。
制氫工藝基于化學鏈燃燒技術[9-10]發展而來,兼顧了碳捕集和高效制氫技術[11]。目前化學鏈與制氫結合的方式主要有3種:化學鏈重整制氫(CLR)、混合燃燒-氣化化學鏈制氫(HLG)以及水蒸氣代替空氣的化學鏈制氫(CLHG)[12]。
CLR工藝是將燃料和水蒸氣通入燃料反應器,載氧體(oxygen carrier,OC)提供晶格氧后發生化學鏈氣化,燃料部分氧化得到合成氣,經過轉變反應器和變壓吸附裝置后得到高純氫[13-14]。目前,對CLR工藝的研究較多,但是該工藝復雜,且后續裝置耗能較多,還需進一步完善。HLG工藝是將燃料和水蒸氣直接氣化,通過化學鏈燃燒進行碳捕集并提供熱量[15]。陽紹軍等[16]用CaO吸收甲烷重整和水煤氣變換產生CO2,化學鏈燃燒使用NiO作載氧體,模擬計算氫氣體積分數為93.23%。蔣景周等[12]將生物質氣化,經過分離設備得到高純氫,剩余不含氫氣的氣體與載氧體發生化學鏈燃燒,實現碳捕集,載氧體在空氣反應器中再生,同時為氣化裝置提供熱量。HLG工藝中化學鏈技術的作用有限,同樣需要分離裝置,能耗較多。
CLHG與化學鏈燃燒類似,將空氣替換成水蒸氣,在蒸汽反應器中還原態載氧體被水氧化,生成高純氫和氧化態載氧體。CLHG是一種綠色、高效得制氫技術[17],研究重點主要集中在載氧體的反應性能優化方面[18],其中鐵基載氧體價廉易得[19],惰性組分Al2O3耐燒結性能良好[20],易于大規模制備。孫小燕等[21]對以Fe3O4為載氧體的二反應器CO化學鏈制氫進行了模擬和熱重分析,得出了部分反應機理和動力學參數。Chiesa等[22]使用鐵基載氧體從熱力學方面模擬了三反應器天然氣化學鏈制氫的可行性,氫氣純度和碳捕集效率良好。Zhu等[23]提出了一種用于氫氣和合成氣聯產的化學循環干重整工藝,在還原的鐵基載氧體上可以實現CO2和CH4到合成氣的有效轉化,在蒸汽氧化階段中提高氫氣產率,但是對于化學鏈制氫工藝的優化方面的研究仍有不足之處。
為完善更加經濟、高效的制氫工藝,本文中擬綜合二反應器煤CLHG和三反應器煤CLHG的優勢,以煤為燃料,通過增加反應過程實現對化學鏈制氫過程的強化,稱為強化煤化學鏈制氫(enhanced coal chemical looping hydrogen generation,強化煤CLHG)。強化煤CLHG的優化過程為:選取廉價的鐵基載氧體,以梅花井煙煤為原料,在固定床上進行相關實驗,首先探究煤與鐵基載氧體的質量比對強化煤CLHG工藝的影響;對比強化煤CLHG與三反應器煤CLHG工藝,通過XRD表征不同階段鐵基載氧體的變化;對比二反應器煤CLHG、三反應器煤CLHG以及強化煤CLHG這3種工藝過程在循環實驗中的氫氣產量,探究強化煤CLHG工藝的可行性,以期為工業化應用提供參考依據。
1 實驗
1.1 制氫原理
化學鏈制氫的主要反應式有
Fe2O3+C→CO2+H2O+FeO或Fe,
(1)
FeO或Fe+H2O→Fe3O4+H2,
(2)
Fe3O4+C→FeO或Fe+CO2+H2O,
(3)
Fe3O4+O2→Fe2O2。
(4)
3種化學鏈制氫方式的反應流程示意圖如圖1所示。圖1(a)為二反應器煤CLHG,圖1(b)為三反應器煤CLHG,圖1(c)為強化煤CLHG。由圖1(c)可知,強化煤CLHG的反應流程為:在燃料反應器(FR)中Fe2O3載氧體被煤還原,發生的反應為式(1);在蒸汽反應器(SR)中還原態的載氧體FeO或Fe被水蒸氣部分氧化,制取氫氣,發生的反應為式(2);部分氧化的載氧體Fe3O4進入FR與新加入的煤進行反應為式(3);還原態載氧體FeO或Fe在SR中與水再次反應制氫,發生的反應為式(2);最后Fe3O4進入空氣反應器(AR)煅燒實現載氧體的再生,發生的反應為式(4)。綜上,相比于二、三反應器煤CLHG,強化煤CLHG進行了2次制氫,使用空氣反應器的次數少,能夠有效降低能量消耗。
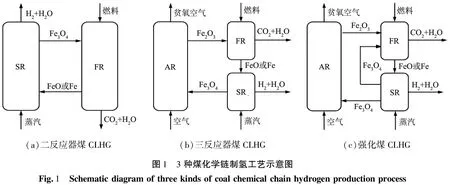
(a)二反應器煤CLHG(b)三反應器煤CLHG(c)強化煤CLHG圖1 3種煤化學鏈制氫工藝示意圖Fig.1 Schematicdiagramofthreekindsofcoalchemicalchainhydrogenproductionprocess
1.2 鐵基載氧體的制備
采用浸漬法制備Fe4Al6載氧體(Fe2O3質量分數為40%,Al2O3質量分數為60%)。相比于其他制備方法,浸漬法制備的載氧體負載均勻,制備時間較短,適合大規模生產。制備方法如下:將202.4 g的Fe(NO3)3·9H2O(分析純,國藥集團)溶于去離子水中,將60 g的Al2O3(分析純,國藥集團)作為載體加入溶液中,在80 ℃下加熱攪拌2 h,然后移入100 ℃的烘箱中干燥10 h,最后在950 ℃的馬弗爐中煅燒4 h,即可獲得Fe4Al6載氧體。將樣品進行壓碎并篩分,獲得粒徑為150~450 μm的均質顆粒。
1.3 煤樣
選取寧夏梅花井煤作原料,對煤樣進行粉碎、篩分處理,獲得粒徑為97~125 μm的均質顆粒,裝袋備用。梅花井煤樣的工業分析與元素分析見表1。
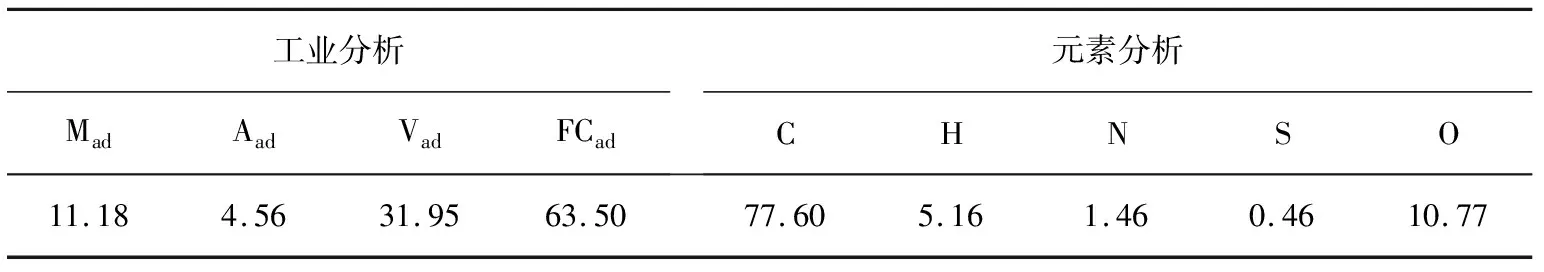
表1 煤樣的工業分析和元素分析
1.4 裝置及流程
管式爐反應器實驗裝置示意圖如圖2所示。由圖可知,實驗裝置由氣體分配系統(空氣和氬氣儲氣罐、氣體流量計)、蒸汽發生系統(蠕動泵、蒸汽發生器)、管式爐反應系統(管式爐反應器、石英舟、溫度控制系統)、冷卻系統、檢測分析系統(濕式氣體流量計、氣相色譜儀)組成。蒸汽發生器由蠕動泵控制水流量,在300 ℃的爐內預熱,產生的蒸汽進入管式爐。氣相色譜儀可對氣體中各組分的含量進行分析。
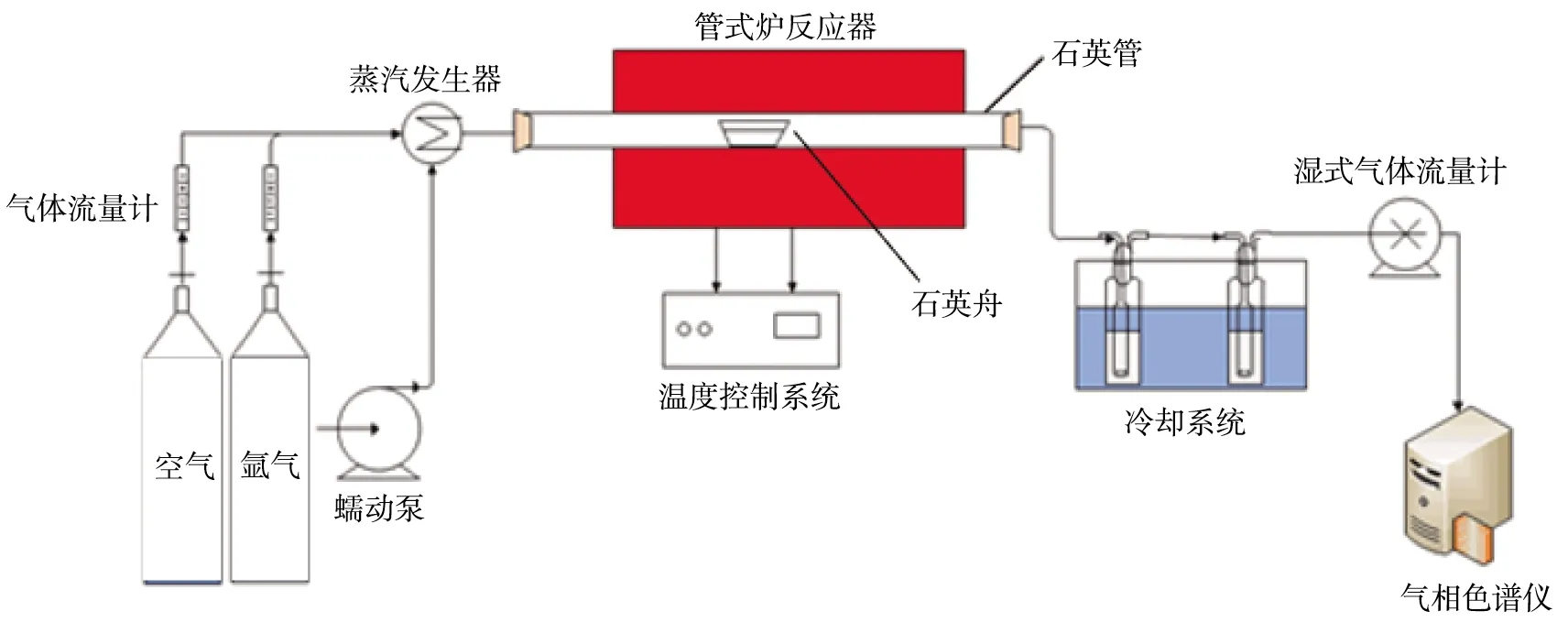
圖2 管式爐反應器實驗裝置示意圖
實驗流程為:在還原階段,稱取一定質量的煤和載氧體,混合均勻后置于石英舟中,將其放在石英管的冷溫區;采用高純氬作吹掃氣和保護氣,以200 mL/min的氣體速率對管內持續吹掃20 min;當系統溫度達到設定值時,迅速將石英舟推至石英管的中間加熱區,設定反應時間為90 min;出口氣體經冷卻系統、流量計后,通過氣袋收集氣體,每組氣袋收集5 min;在蒸汽氧化階段,氬氣氛下通入速率為0.1 g/min的水蒸氣,反應90 min后得到部分氧化的載氧體,同時收集出口氣體;將部分氧化的載氧體與煤按比例混合均勻,重復上述步驟1次;蒸汽氧化階段結束后,關閉氬氣氣路,通入空氣,反應時間為90 min,使載氧體完全氧化。
1.5 數據處理方法
氣體產物的體積分數φi的計算公式為
(5)
式中:φi(i分別代表H2、CO、CO2、CH4)為出口氣體中各氣體的體積分數,%;Vi為各氣體的體積,L。
碳轉化率rC的計算公式為
(6)
式中:rC為氣體產物中的碳與煤中碳的物質的量之比,%;Vg為氣體產物的總體積,L;mcoa為煤樣質量,g;wC為煤中碳的質量分數,%。
2 結果與討論
2.1 煤與載氧體的質量比對強化煤CLHG的影響
在強化煤CLHG工藝中,煤與鐵基載氧體的質量比(記為mcoa∶mOC)對碳轉化率、氫氣產量和氫氣體積分數的影響如圖3所示。
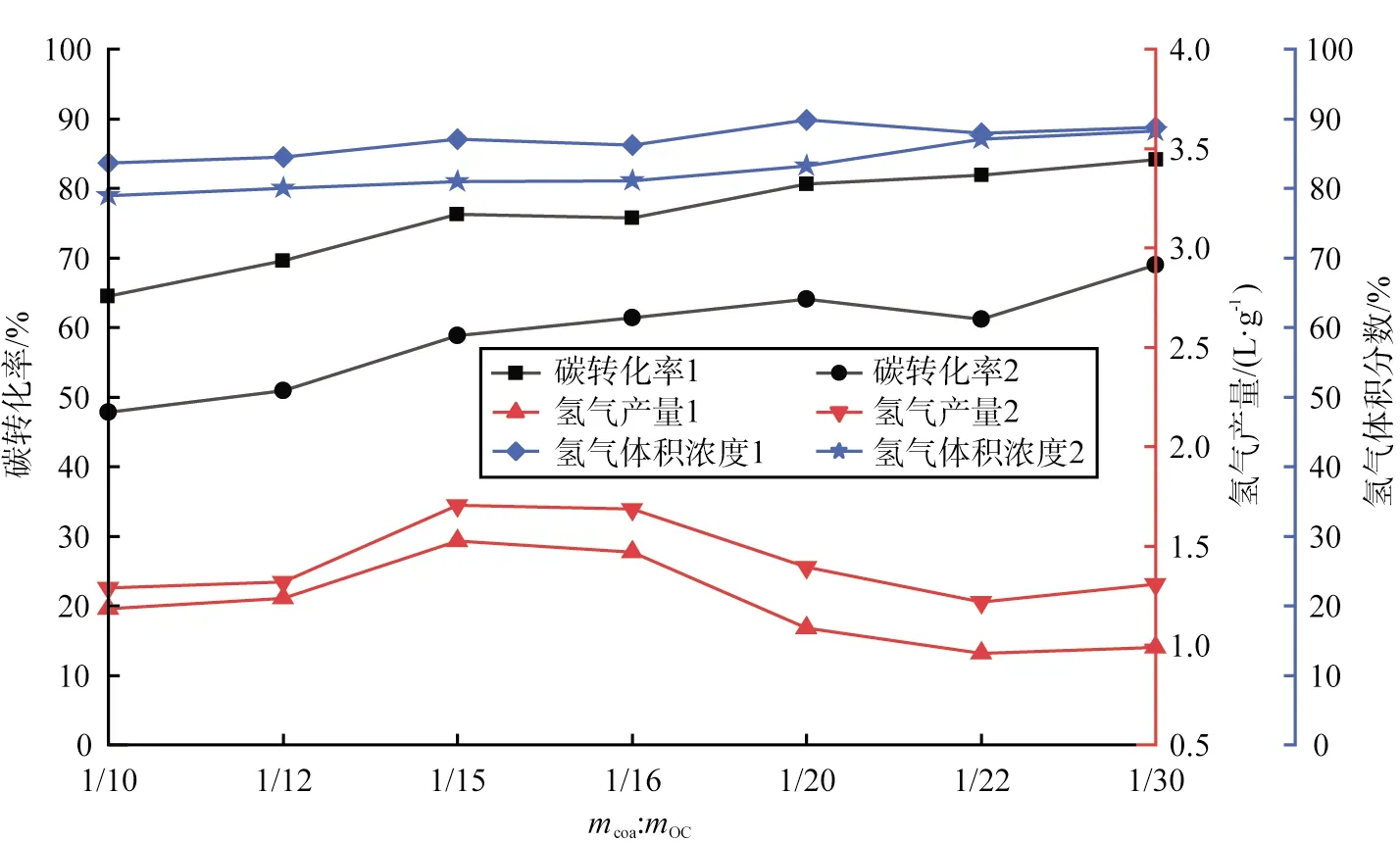
圖3 煤與載氧體的質量比對碳轉化率、氫氣產量和氫氣體積分數的影響
由圖可知,隨著鐵基載氧體質量的增加,碳轉化率逐漸上升,當mcoa∶mOC為1∶30時,碳轉化率達到最大值84.16%,這是因為有更多的晶格氧與煤進行反應;然而氫氣產量與mcoa∶mOC并不是線性關系,隨著鐵基載氧體質量的增加,產氫量先上升后降低,在mcoa∶mOC為1∶15時氫氣產量達到峰值1.74 L/g;在mcoa∶mOC為1∶15之前,鐵基載氧體質量增加,意味著有更多的FeO或Fe參與反應,使得氫氣產量逐漸增加;而在mcoa∶mOC為1∶15之后,隨著鐵基載氧體質量增加,鐵基載氧體的深度還原能力變弱,還原階段后產生的Fe逐漸減少,化學反應式為
3FeO+H2O→Fe3O4+H2,
(7)
3Fe+4H2O→Fe3O4+4H2。
(8)
由式(7)、(8)可知,Fe與水蒸氣反應產生的氫氣量是FeO與水蒸氣反應的4倍,所以氫氣產量逐漸下降,氫氣體積分數基本沒有變化。綜上,強化煤CLHG工藝中mcoa∶mOC最佳值為1∶15,氫氣產量峰值為1.74 L/g。
2.2 強化煤CLHG與三反應器CLHG的對比
通過對比強化煤CLHG與三反應器CLHG,2種制氫工藝的出口氣體體積分數隨反應時間變化的曲線如圖4所示。由圖可知,2種制氫工藝的還原階段即0~90 min,三反應器煤CLHG以Fe2O3為載氧體,其出口氣體主要是CO2和CO,煤炭未被完全轉化;強化煤CLHG以Fe3O4為載氧體,其出口氣體主要是CO,CO2的體積分數較三反應器煤CLHG明顯降低;這主要是因為Fe3O4的晶格氧含量低于Fe2O3,導致氧源不充足,煤無法完全氧化成CO2,但是鐵基載氧體更多地還原成低價態,有利于鐵基載氧體與水的反應。在蒸汽氧化階段即90~180 min,2種制氫工藝的主要出口氣體均是H2,體積分數峰值出現在115 min,三反應器煤CLHG的體積分數峰值為21.6%,強化煤CLHG的體積分數峰值為22.2%,H2體積分數在達到峰值后的下降速度比三反應器煤CLHG緩慢,CO2體積分數稍高,說明還原階段后的殘余焦炭在蒸汽氧化階段進一步反應。
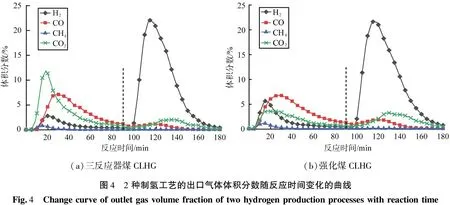
(a)三反應器煤CLHG(b)強化煤CLHG圖4 2種制氫工藝的出口氣體體積分數隨反應時間變化的曲線Fig.4 Changecurveofoutletgasvolumefractionoftwohydrogenproductionprocesseswithreactiontime
三反應器煤CLHG的碳轉化率為73.14%,氫氣產量為1.47 L/g;強化煤CLHG的碳轉化率為60.83%,低于三反應器煤CLHG的,說明三反應器煤CLHG更能促進煤的轉化,Fe2O3載氧體的反應性能更高,但是不利于載氧體的還原。強化煤CLHG的產氫量為1.74 L/g,比前者提高了18.37%,氫氣全部來自FeO或Fe與水蒸氣的反應,分析原因主要有2點:強化煤CLHG的鐵基載氧體深度還原,更多的載氧體被轉化成FeO和Fe;還原階段的殘炭在蒸汽氧化階段與部分氧化的載氧體進一步反應,使得部分Fe3O4再次被還原成FeO或Fe,如式(3)。
不同反應階段載氧體的XRD圖譜如圖5所示。根據文獻[24-25]可知:FeAl2O4在還原階段不利于Fe0的生成,因為熱力學性質很難與水反應。由曲線(b)、(d)比較可知,曲線(d)中的FeAl2O4特征峰減弱,Al2O3和Fe的特征峰增強,說明鐵基載氧體被深度還原,使得更多的還原態載氧體與水蒸氣反應,導致氫氣產量增加;由曲線(c)、(e)比較可知,前者仍存在明顯的Fe特征峰,而后者的Fe特征峰減弱,說明后者在蒸汽氧化階段鐵基載氧體與水蒸氣充分反應。
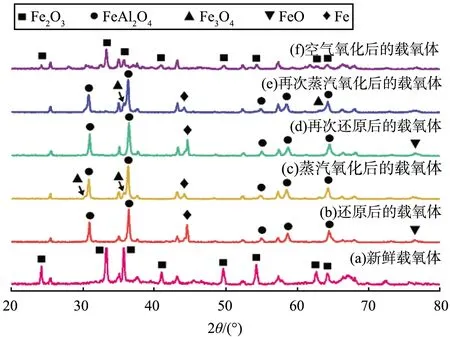
圖5 不同反應階段載氧體的XRD圖譜
2種制氫工藝的碳轉化率和氫氣產量如表2所示。由表可以看出,除殘炭后,強化煤CLHG的產氫量(1.13 L/g)比三反應器煤CLHG(1.03 L/g)高出9.71%,說明鐵基載氧體被深度還原,與XRD表征結果一致。與未除殘炭結果對比可以發現,除殘炭后的氫氣產量(1.13 L/g)明顯低于未除殘炭的(1.74 L/g),說明還原階段后的殘炭量是影響氫氣產量的主要因素,FeO或Fe被水蒸氣部分氧化成Fe3O4,殘炭將Fe3O4進一步還原成FeO或Fe,使得更多的水蒸氣參與反應,最終氫氣產量增加。

表2 2種制氫工藝的碳轉化率和氫氣產量
2.3 3種制氫工藝的多循環實驗
進行二反應器煤CLHG、三反應器煤CLHG、強化煤CLHG實驗后,分別收集載氧體,與煤混合后重復3種制氫工藝實驗,探究載氧體的循環性能。3種制氫工藝在多循環實驗中的碳轉化率和氫氣產量如圖6所示。由圖可知,在6次循環實驗中,二反應器煤CLHG的碳轉化率快速下降,三反應器煤CLHG的循環實驗中,碳轉化率和氫氣產量都輕微下降;強化煤CLHG在6次循環實驗中,碳轉化率和氫氣產量上下波動,但是未出現下降趨勢;與三反應器煤CLHG相比,碳轉化率總體相差不大,產氫量一直高于三反應器煤CLHG的;在二反應器煤CLHG中,Fe3O4作為載氧體,深度還原導致載氧體表面積炭嚴重,從而阻塞了載氧體的孔道結構,同時高溫下載氧體發生了燒結,最終影響了晶格氧的釋放;在蒸汽氧化階段,殘炭進一步反應,使得鐵基載氧體被再次還原,從而使得氫氣產量下降緩慢;對比三反應器煤CLHG,強化煤CLHG的第2、4、6次循環實驗中,鐵基載氧體被深度還原,產生更多的FeO或Fe,在蒸汽氧化階段有部分殘炭與載氧體再次反應,增強還原態的鐵基載氧體與水的反應性能,使得氫氣產量增加。
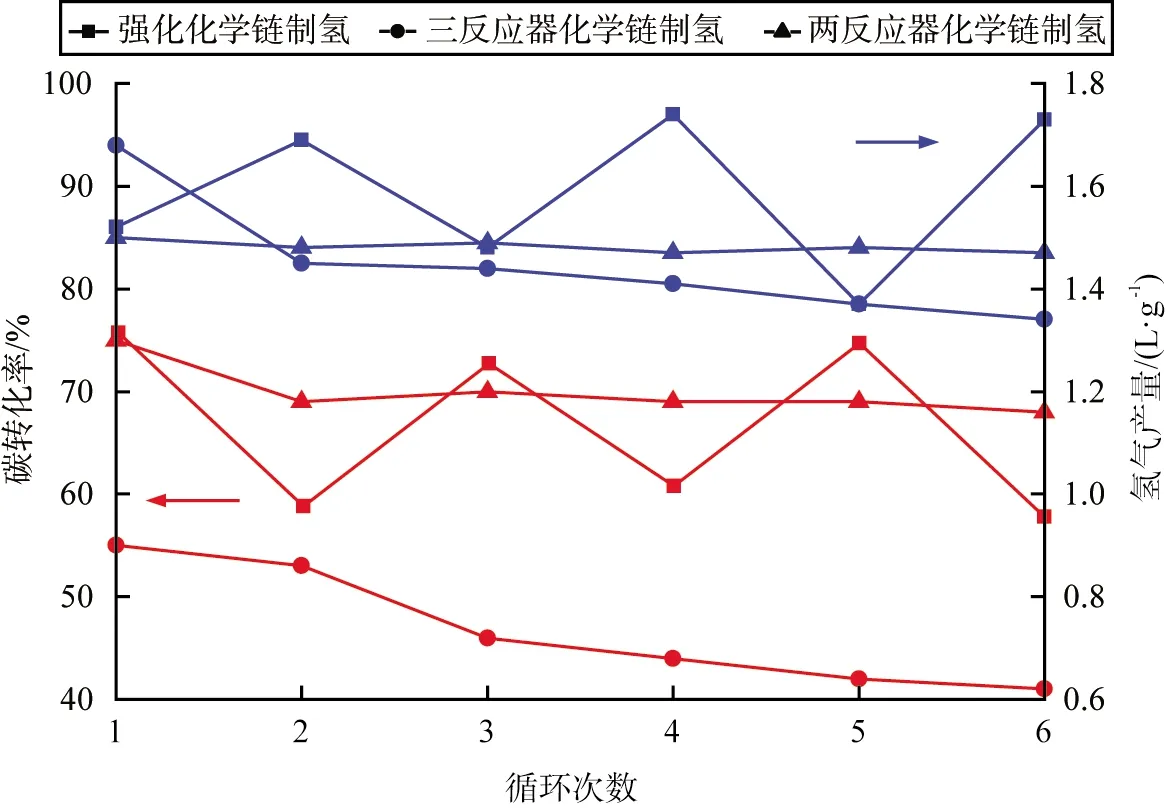
圖6 3種制氫工藝在多循環實驗中的碳轉化率和氫氣產量
3 結 論
1)強化煤CLHG與三反應器煤CLHG相比,鐵基載氧體被深度還原,還原階段的殘炭被充分利用,氫氣產量為1.74 L/g,比三反應器煤CLHG的1.47 L/g提高了18.37%。
2)隨著鐵基載氧體質量的增加,強化煤CLHG的氫氣產量先增加后降低,這是鐵基載氧體還原程度和殘炭共同作用的結果,煤與載氧體的質量比為1∶15時,鐵基載氧體的反應性能最佳,氫氣產量峰值為1.74 L/g。
3)6次循環實驗中,強化煤CLHG與三反應器煤CLHG的碳轉化率總體相差不大,二反應器煤CLHG下降嚴重;強化煤CLHG的氫氣產量始終高于二反應器CLHG和三反應器CLHG的。強化煤CLHG的鐵基載氧體的循環反應性能更為優異。

