臍帶間充質干細胞及其外泌體對HK-2細胞脂多糖損傷的作用研究*
徐 瑩,周 茹,秦華章,張欣洲,馬華林**
(1.深圳市人民醫院/暨南大學第二臨床醫學院/南方科技大學第一附屬醫院血液內科,廣東 深圳 518020;2.深圳市人民醫院/暨南大學第二臨床醫學院/南方科技大學第一附屬醫院腎內科/深圳市腎臟病重點實驗室)
急性腎損傷(acute kidney injury,AKI)是膿毒癥常見的并發癥之一,膿毒癥若并發AKI將明顯加重膿毒癥病情以及增加患者病死率[1-2]。有研究表明[3],腎小管上皮細胞急性損傷是膿毒癥致AKI重要的病理生理機制。眾多研究表明[4-6],膿毒癥誘導的免疫反應參與促炎與抗炎的激活及后續的效應,包括細胞和體液免疫,接著產生一系列的炎癥介質,其中包括IL-1、TNF-α和IL-6,并發展成為細胞因子風暴。我們課題組前期的研究結果表明[7],人臍帶間充質干細胞(human umbilical cord mesenchymal stem cells,HuMSCs)對脂多糖(LPS)誘導的大鼠AKI模型可起到有效保護作用。本研究擬觀察HuMSCs及其來源外泌體對人腎皮質近曲小管上皮細胞(human kidney-2,HK-2)LPS毒性的保護作用及機制。
1 材料與方法
1.1 實驗細胞及材料
人腎皮質近曲小管上皮細胞(human kidney-2,HK-2),購自中科院典型培養物保藏委員會干細胞庫。人臍帶間充質干細胞的培養HuMSCs均由深圳市人民醫學院干細胞研究中心實驗室分離、擴增培養以及保存。實驗中使用的人臍帶間充質干細胞均經過流式細胞儀檢測,細胞表型特征符合MSC表型;微生物檢測結果為陰性。
1.2 實驗方法
1.2.1 實驗分組
培養HK-2細胞,mock組不做任何處理;其余組在加入LPS(1μg/mL)處理24h后,co-cul組采用共培養方式,將鋪滿已用TNFα預處理24h的人臍帶MSC細胞的上室放入共培養體系(HK-2細胞在下室),其余各組更換新的培養基,HK-2細胞+LPS+人臍帶MSC細胞-Ex分別加入不同濃度的人臍帶MSC細胞來源的exosomes繼續培養24h后,收集各組的HK-2細胞及上清液備用(MTS、凋亡預實驗確定LPS誘導損傷濃度效果),每組7個復孔。
mock組:HK-2細胞
0μg/mL組:HK-2細胞+LPS
co-cul組:HK-2細胞+LPS+人臍帶MSC細胞(TNFα預處理后的細胞)
25μg/mL組:HK-2細胞+LPS+25μg/mL人臍帶MSC細胞-Ex
50μg/mL組:HK-2細胞+LPS+50μg/mL人臍帶MSC細胞-Ex
75μg/mL組:HK-2細胞+LPS+75μg/mL人臍帶MSC細胞-Ex
100μg/mL組:HK-2細胞+LPS+100μg/mL人臍帶MSC細胞-Ex
1.2.2 MTS檢測細胞增殖變化
細胞活力的MTS法檢測HK-2細胞接種在96孔板內,將20μL檢測液加入培養孔,繼續培養4h后使用酶標儀上檢測490nm波長時的吸光度。
1.3 方法
1.3.1 外泌體分離提取
根據試劑說明書,使用ExoQuick試劑沉淀試劑盒(System Biosciences,SBI,Mountain View,CA)通過聚合物配制方法從血清中分離外泌體。分離后立即將所有外泌體儲存在-80°C備用。 使用標準的Bradford蛋白質測定法(Bio-Rad,弗吉尼亞州,美國)確定分離的外泌體總蛋白質濃度。
1.3.2 HuMSC-ex的鑒定
(1)透射電鏡和納米顆粒示蹤技術(NTA)檢測HuMSC-ex。
取20μL HuMSC-ex滴加于銅網上,靜置5min,將殘余液體吸去后置于磷鎢酸(pH 6.8)液滴上行負染5min,然后采用透射電鏡觀察并拍照。取100μL HuMSC-ex,采用納米顆粒分析儀進行檢測及數據分析。
(2)Western blot檢測HSPA8、Alix、CD63以及TSG101等標記蛋白分子的表達。
HuMSC-ex與RIPA按1∶1混勻,置于冰上10min,震蕩1min,重復3次,然后離心15min取上清液,測得蛋白濃度后加入緩沖液,煮沸10min。配制SDS-PGAE,計算上樣量,加樣后行聚丙烯酰胺凝膠電泳。電泳結束后在恒流濕轉2h,脫脂牛奶室溫封閉1h。HSPA8、Alix、CD63以及TSG101抗體稀釋后孵育過夜,洗膜后曝光。
1.3.3 qRT-PCR和Western blot檢測各組TLR4的表達
qRT-PCR檢測采用Invitrogen設計并合成了特異性引物qRT-PCR,所有的qRT-PCR分析均通過Light-Cycler480實時PCR系統(羅氏)來執行。免疫印跡(Western blot)法用Bio-Rad蛋白測定系統(Bio-Rad,Hercules,CA,USA)測定蛋白質濃度,然后用12% SDS聚丙烯酰胺凝膠電泳,轉移到PVDF膜(Millipore)上。膜在室溫下用5%脫脂奶粉堵塞1h,與初級抗體孵育一夜。膜與HRP標記的次級抗體孵育室溫下1h,在TBST(三乙醇胺緩沖鹽水與吐溫)中洗滌3~10min。含有這些蛋白質的膜用適當的抗體進行免疫印跡。
1.3.4 Elisa檢測培養上清液中炎癥介質(IL-1、IL-6、TNF-α)的水平
按照試劑說明做好準備工作,配制好各種溶液。根據待測樣品數量和標準品的數量決定所需的板條數。分別將標本和不同濃度標準品(100mL/孔)加入相應孔中,空白孔加樣本/標準品稀釋液100mL/孔,用封板膠紙封住反應孔,37℃孵箱孵育90min。洗板4次:甩盡孔內液體,每孔加洗滌液350uL,靜置30秒后甩盡液體,在厚迭吸水紙上拍干。加入生物素化抗體工作液(100mL/孔)。用封板膠紙封住反應孔,37℃孵箱孵育60min。洗板4次。加入酶結合物工作液(100mL/孔)。用封板膠紙封住反應孔,37℃孵箱孵育30min。洗板4次。加入顯色劑90mL/孔,避光,37℃孵箱孵育25~30min。加入終止液100mL/孔,混勻后即刻測量OD450值(5min內)。
1.4 統計學方法
應用SPSS13.0軟件進行統計分析,采用單因素方差分析(ANOVA)比較樣本均數,P<0.05為差異有顯著性意義。
2 結 果
2.1 外泌體的分離和鑒定
大量培養人臍帶MSC細胞,經濃度為10ng/mL TNF-α刺激48h后,收集上清液,分離exosomes。
(1)透射電鏡下觀察HuMSC-ex 的形態為圓形或者橢圓形囊泡狀結構,直徑約為 100nm左右,大小不均(圖1A)。
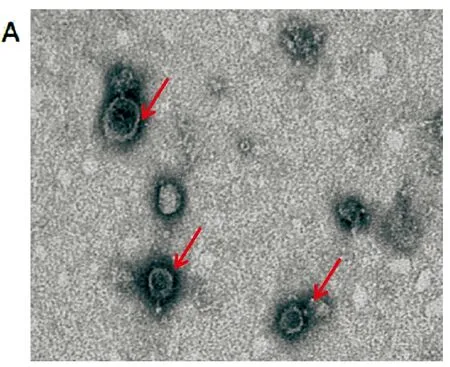
A.外泌體(圖中紅色箭頭)在透射電鏡下為橢圓形或者圓形囊泡狀;B.WB檢測exosomes標志物CD63、TSG101、HSPA8及Alix;C.NTA結果
(2)WB檢測exosomes標志物CD63、TSG101、HSPA8及Alix進行鑒定;發現HuMSC-ex表達特異性標記CD63、TSG101、HSPA8及Alix(圖1B)。
(3)采用納米顆粒示蹤(NTA)進行exosomes大小鑒定;分離的外泌體中50%的直徑小于118.1nm,90%的直徑小于163.9nm,大小符合外泌體特征(圖1C)。
2.2 MTS檢測細胞增殖變化
MTS結果顯示:LPS刺激后,HK-2細胞增殖水平明顯降低(P<0.05);人臍帶MSC細胞與HK-2細胞共培養后,HK-2細胞增殖水平明顯增加(P<0.05),表明人臍帶MSC細胞外泌體同樣可以促進HK-2細胞的增殖。見圖2。
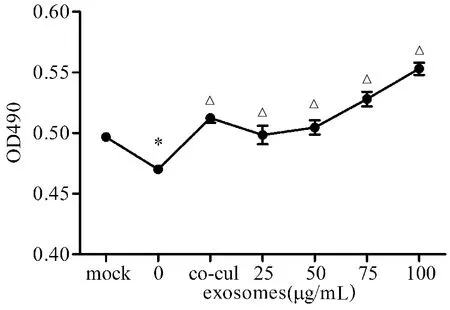
與mock組相比,*P<0.05;與0μg/mL組相比,△P<0.05,n=8
2.3 qRT-PCR和WB檢測各組TLR4的表達
qRT-PCR和WB結果顯示:給予LPS刺激后,HK-2細胞TLR4的表達水平明顯增高(P<0.05),人臍帶MSC細胞與HK-2細胞共培養后可抑制TLR4的表達(P<0.05),人臍帶MSC細胞外泌體同樣可以抑制TLR4的表達(P<0.05),而且隨著外泌體的增加其抑制作用亦增強。見圖3。
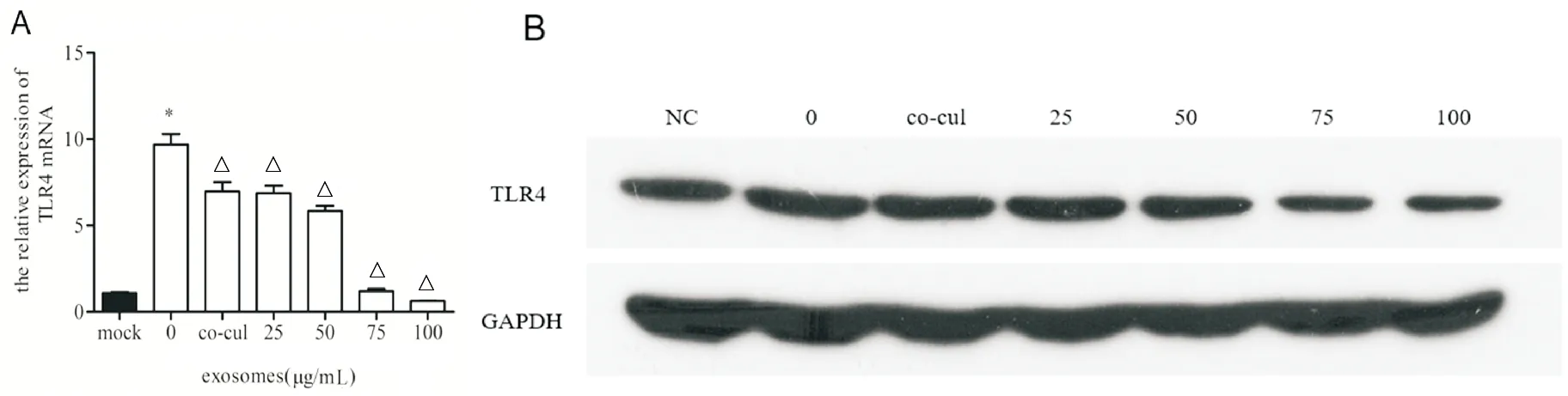
A.qPCR檢測不同處理組TLR4 mRNA的表達(與mock組相比, *P<0.05;與0μg/mL組相比,△P<0.05,n=8);B.WB檢測不同處理組TLR4蛋白的表達
2.4 Elisa檢測培養上清液中炎癥介質(IL-1β、IL-6、TNF-α)的水平
LPS刺激后,HK-2細胞的炎癥因子IL-1β、IL-6和TNF-α水平明顯升高(P<0.05),人臍帶MSC細胞與HK-2細胞共培養后,可以降低IL-1β、IL-6和TNF-α的表達(P<0.05),人臍帶MSC細胞外泌體亦可降低它們的表達(P<0.05)。見圖4。
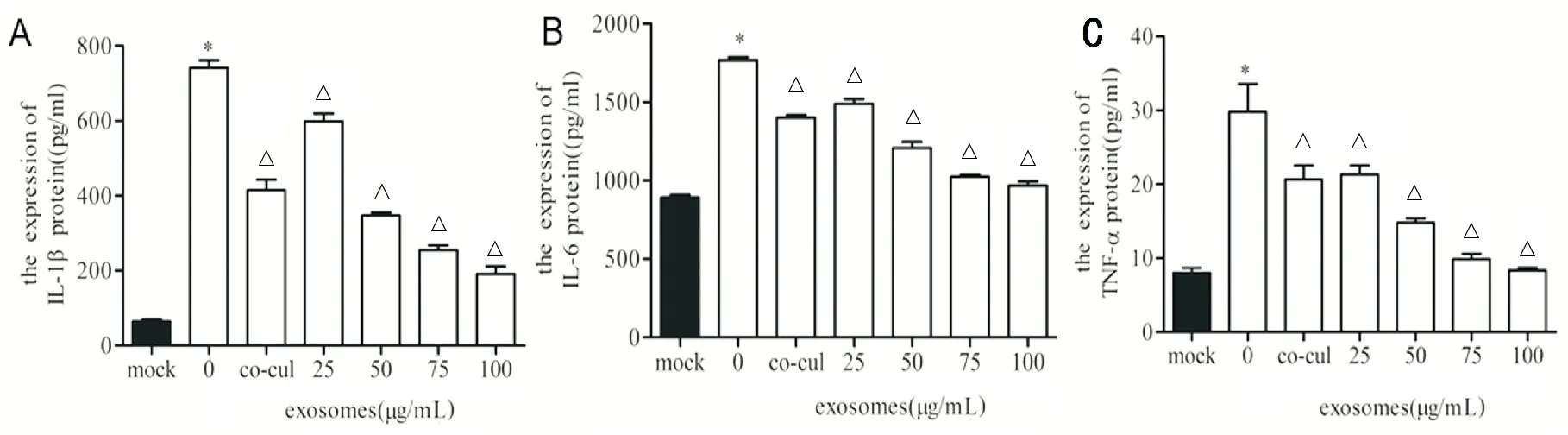
A.各組IL-1β水平;B.各組IL-6水平;C.各組TNF-α水平(與mock組相比,*P<0.05;與0μg/mL組相比,△P<0.05,n=8)
3 討 論
AKI是膿毒癥最常見的并發癥也是增加其救治難度和病死率以及影響預后的重要原因[8]。近年有研究表明[3],膿毒癥引起AKI的重要環節是LPS誘導的腎小管上皮細胞損傷,但其具體機制暫未明確。
HuMSCs是人體最重要的成體干細胞之一,其來源非常廣泛,增殖速度快,經誘導可分化為軟骨細胞、脂肪細胞以及成骨細胞等[9]。目前有學者認為間充質干細胞協調腎臟保護的作用是通過分泌大量趨化因子和細胞因子并釋放諸如外泌體等活性物質來實現的,并與其通過免疫調節、趨化、抗凋亡和血管生成等機制密切相關[10]。MSC釋放的外泌體選擇性地將含有mRNAs、microRNAs和蛋白質等具有一定特異性的物質參與蛋白水解、細胞轉運、凋亡和血管生成等途徑[11-12]。有證據表明在體內外MSC分泌的外泌體均具有與MSC相似的功能,均可降低實驗動物近端腎小管壞死、氧化應激、凋亡和體內大量管狀蛋白鑄型的形成,保護其腎功能[13]。
本研究發現:LPS抑制HK-2細胞的增殖,TNFα刺激人臍帶MSC細胞與HK-2細胞共培養,以及人臍帶MSC細胞外泌體可以修復LPS帶來的損傷。以上結果表明,HuMSC-ex的預處理可明顯降低LPS對 HK-2 細胞的損傷作用。TLR4作為重要的受體家族成員,可以通過識別LPS主要受體參與炎癥反應。通過阻斷TLR4信號轉導通路后調節其炎癥免疫反應,抑制炎癥介質表達,提高膿毒癥患者的生存率[14]。本研究結果發現LPS促進HK-2細胞TLR4的表達,人臍帶MSC細胞外泌體亦可以抑制TLR4的表達。而且研究中發現LPS促進HK-2細胞IL-1β、IL-6、TNF-α的表達,TNFα刺激人臍帶MSC細胞與HK-2細胞共培養,以及人臍帶MSC細胞外泌體會抑制LPS導致的炎癥因子表達升高。
綜上所述,在體外人臍帶間充質干細胞及其外泌體均能顯著促進LPS誘導的腎小管上皮細胞增殖;抑制LPS導致的HK-2細胞TLR4及炎癥因子表達。

