耐重金屬腸桿菌GL-2 鑒定及對小麥促生作用的研究
蔡高磊,周 煬,趙昌松,彭宣和,張 振,趙建寧
(1.農業農村部農產品質量安全環境因子控制重點實驗室,天津 300191;2.丹江口庫區十堰生態農業研究院,湖北 十堰 442000;3.農業農村部環境保護科研監測所,天津 300191)
近年來,土壤重金屬污染對生態系統和人類健康都構成嚴重威脅,日益成為嚴重的全球性環境問題。工業生產、采礦活動、農業生產中肥料和農藥的使用、廢水灌溉和廢棄物的不當處理等人類活動都與土壤中的重金屬污染有關[1-4]。重金屬是土壤中的常見污染物,也是植物和動物代謝過程中的非必需元素,特別是土壤污染中的鎘(Cd)被認為是重金屬中最具毒性的污染物之一,因此它具有高遷移率和低允許暴露限值[5,6]。傳統的重金屬處理方法如土壤沖刷、穩定劑、酸淋洗、離子交換或電化學處理對土壤修復來說既昂貴效率又低,并且往往對土壤生態系統造成負面影響[7,8]。除了重金屬毒性外,植物的生長還可能受到干旱、鹽堿化和養分缺乏等不良環境脅迫,克服環境壓力并促進植物生長對植物發揮自身性能必不可少。植物根系周圍存在大量植物根際促生菌(Plant growth-promoting rhizobacteria,PGPR),它們是一群可以產生與植物生長相關物質,例如嗜鐵素、吲哚3-乙酸(IAA)和1-氨基環丙烷-1-羧酸合成酶(1-aminocyclopropane-1-carboxylate,ACC)等來提高植物對重金屬毒性的耐受性和促進植物生物量的有益根際細菌[9-11]。研究報道,與植物相關的PGPR 通過降低土壤中的重金屬生物利用度來幫助植物生長和提高植物對重金屬的耐受性,并減少重金屬的吸收或轉移到植物的上半部分[12-15]。Madhaiyan 等[16]報道,接種內生細菌Magnaporthe oryzae和Burkholderiaspp.可以增加植株生長,減少番茄根和芽中Ni 和Cd的積累,同樣也減少了土壤中Ni 和Cd的有效性,是PGPR 菌株對重金屬的吸附和生物積累的結果。此外,細菌還可以直接與重金屬等污染物相互作用,以降低其毒性或調節其生物利用率[17]。因此,PGPR的應用是減少土壤中重金屬積累和植物生長效率的有效途徑。
本研究通過從土壤中分離一種PGPR 菌株,離體條件下篩選出具有耐重金屬和嗜鐵素活性,測定了該菌株對重金屬的最低抑制濃度,并研究了其對小麥幼苗生長性狀的影響,為該菌株在土壤中保護作物生長及應用提供理論基礎。
1 材料與方法
1.1 試驗材料
試驗土壤取自湖北省十堰市一處小麥種植地,取樣時小心將小麥拔出并收集小麥根際的土壤置于無菌袋中,注明采樣時間和地點,置于冰箱4 ℃保存備用。
LB 培養基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,瓊脂15 g,定容至1 000 mL,pH 為7.0,121 ℃滅菌20 min。
嗜鐵素培養基[18]:CAS(鉻天青)60.5 g,10 mL 三價鐵溶液(1 mmol/L FeCl3·6H2O),HDTMA(十六烷基三甲基溴化胺)72.9 g,瓊脂18 g,定容至1 000 mL,121 ℃滅菌20 min。
PDA 培養基:馬鈴薯200 g,葡萄糖20 g,瓊脂15 g,定容至1 000 mL,pH為7.0,121 ℃滅菌20 min。
Murashige 和Skoog(MS)培養基[19]。
小麥品種:鄂麥DH16,為本實驗室保存品種。
1.2 試驗方法
1.2.1 耐CdCl2的PGPR 菌株的篩選 為了獲得耐重金屬細菌,稱量10 g 根際土壤放入90 mL 無菌水中,搖床于28 ℃下180 r/min 振蕩30 min,用稀釋平板法連續將土壤混懸液稀釋成10-1~10-3g/mL,并加入含有20 mg/L CdCl2的LB 培養基中涂抹均勻,放置在恒溫培養箱中25 ℃下培養5 d。將生長出來的菌落接入LB 液體培養基中,25 ℃振蕩培養48 h,用離心機5 000 r/min 離心10 min,收集菌體,再用無菌水稀釋菌液濃度至1×107cfu/mL 接入嗜鐵素培養基中,28 ℃下恒溫培養5 d。觀察菌落周圍是否產生黃色暈圈,有黃色暈圈的是產生嗜鐵素的PGPR 菌株。根據下列公式計算嗜鐵素PGPR 菌株活性。
菌株活性=[(暈圈直徑-菌落直徑)/暈圈直徑]×100%
1.2.2 重金屬最低抑制濃度測定 為了檢測分離菌株對重金屬的抗性水平,選取生長最快、抗重金屬最強、嗜鐵素活性最高的PGPR 菌株,測定了PGPR 菌株對硫酸銅、硫酸鋅、硝酸鉛和氯化鎘的最低抑制濃度(Minimal inhibitory concentration,MIC)。采用平板稀釋法在LB 培養基上添加Cu、Zn、Pb 和Cd 不同濃度的重金屬,以菌株不能生長的最低重金屬濃度為試驗統計的生長臨界值,每個處理3 次重復。
1.2.3 PGPR 菌株的分子鑒定和生理生化特征 對篩選出的PGPR 菌株送北京擎科新業生物技術有限公 司進行16S rDNA 和gyrB 分 子鑒定,16S rDNA 引物 為5′-AGAGTTTGATCCTGGCTCAG-3′,5′-GGTTA CCTTGTTACGACTT-3′。16S rDNA PCR 擴增條件為:94 ℃3 min;94 ℃45 s,55 ℃30 s,72 ℃2 min,35 個循環;72 ℃延伸5 min,4 ℃停止。gyrB 引物為5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′,5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′,gyrB PCR擴增條件為:96 ℃5 min,96 ℃1 min,62 ℃1 min,72 ℃ 2 min,35 個循環;72 ℃延伸7 min,4 ℃停止。利用BLASTN 將獲得的序列與GenBank 數據庫中的16S rDNA 和gyrB 核苷酸序列進行比較。使用MEGA5.0 軟件進行多序列比對并構建系統進化樹。
1.2.4 PGPR 對重金屬處理下植物生長的影響 挑取PGPR 菌株單菌落放入LB 液體培養基中,28 ℃振蕩培養72 h,用離心機5 000 r/min 離心10 min,收集菌體,再用無菌水稀釋菌液濃度至1×108cfu/mL 備用。將鄂麥DH16 種子用75%乙醇消毒8 min,再用無菌水清洗3 遍,然后用無菌濾紙吸干種子表面水分,分別放入MS、MS+PGPR、MS+PGPR+Pb、MS+Pb、MS+PGPR+Cd 和MS+Cd 培養基內,Pb 和Cd的終濃度均為50 mg/L,用0.22 μm 過濾器過濾滅菌后加入MS 培養基中混勻,每瓶5 粒種子,每個處理3 次重復,5 d 后調查各處理下小麥生長情況。
1.2.5 PGPR 對植物的促生長作用 選取健康的小麥種子,先用1.2% NaOCl 溶液消毒5 min,然后用75%乙醇消毒5 min,再用無菌水清洗3 次,最后將小麥種子放入無菌濾紙的培養皿中,加入適量無菌水,25 ℃恒溫培養5 d 進行催芽,選取發芽一致的幼苗備用。每個花盆(直徑15 cm)裝有1.5 kg 土壤。試驗設計,處理1:未添加PGPR 菌株的對照土;處理2:PGPR 活菌(1×108cfu/mL)接種土壤;處理3:PGPR活菌(1×105cfu/mL)接種土壤。每盆播種3 株幼苗,每個處理重復3 次,于分蘗期調查各處理下小麥的生長狀況。
2 結果與分析
2.1 PGPR 菌株耐重金屬和嗜鐵素活性
5 株PGPR 在培養基上出現時間和嗜鐵素活性不同(表1),GL-1 到GL-5 出現時間分別為25、20、29、49、46 h,說明在LB 培養基上加了重金屬對PGPR 菌株生長有一定的抑制作用,5 株PGPR 嗜鐵素活性從31.55%到65.88%,其中GL-2 活性最高,為65.88%。因此,GL-2是篩選的最合適PGPR菌株。

表1 耐CdCl2的PGPR 菌株的生長時間和嗜鐵素活性
2.2 GL-2菌株對4種重金屬的最低抑制濃度(MIC)
平板試驗中(圖1),重金屬硫酸銅、硫酸鋅、硝酸鉛和氯化鎘對GL-2 菌株表現出不同程度的抑制作用,GL-2 對添加Cu、Zn、Pb 和Cd的LB 培養基上的最低抑制濃度(MIC)分別為200、150、650 和200 mg/L,說明GL-2 菌株對重金屬離子具有很強的耐受性,特別是對Pb的MIC 達650 mg/L。
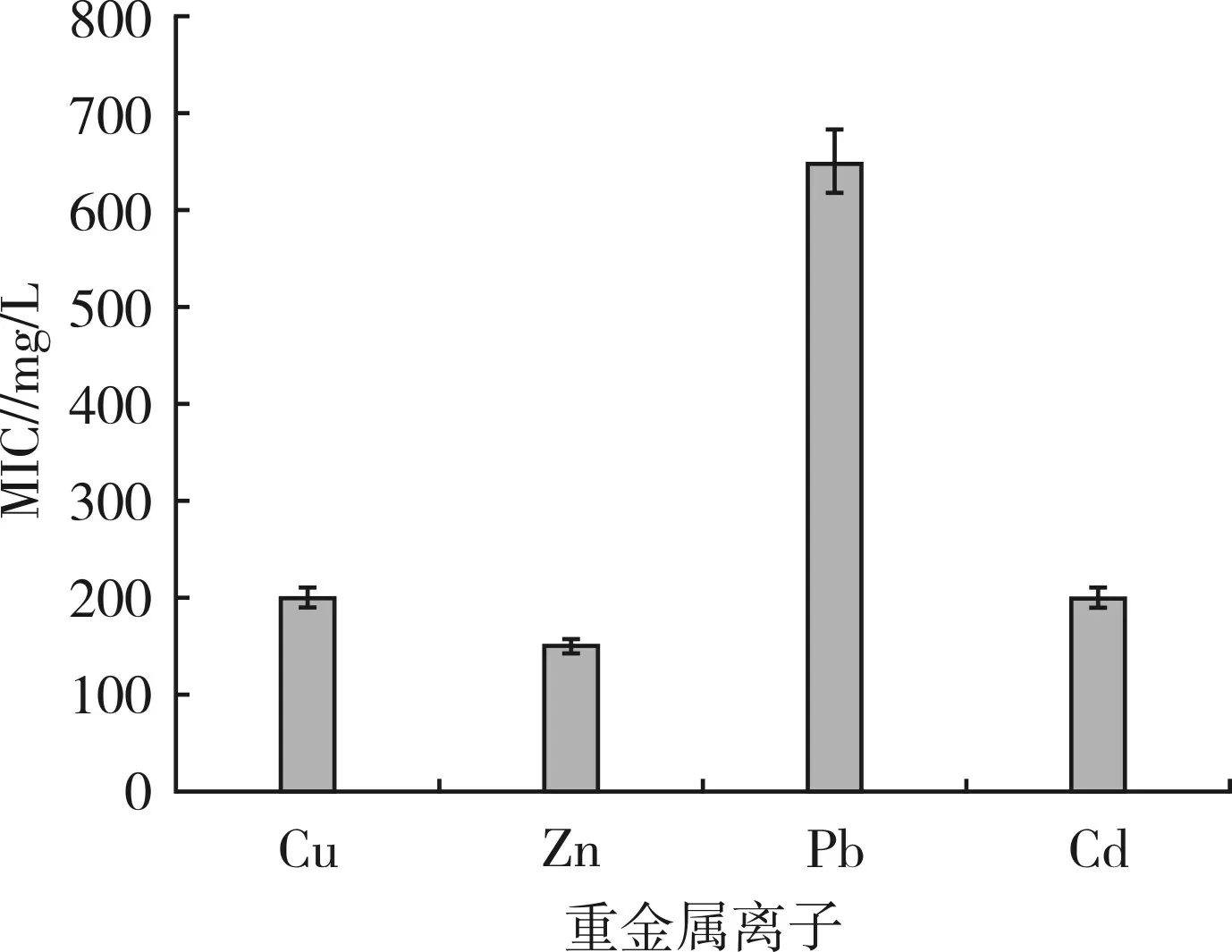
圖1 GL-2 對重金屬的最低抑制濃度
2.3 GL-2 鑒定結果
利用16S rDNA 和gyrB 基因片段進行測序,分別得到長為1 426 bp 和742 bp的核苷酸序列。系統進化樹表明(圖2 和圖3),GL-2 菌株和Enterobacterludwigii聚為一枝,與其他腸桿菌序列的相似性均低于Enterobacter ludwigii。此外,根據第九版Bergeys細菌鑒定手冊,GL-2 菌株的生理生化鑒定結果(表2)與Enterobacter ludwigii基本一致。因此,GL-2菌株為Enterobacter ludwigii,命名為Enterobacter ludwigiiGL-2。

圖2 GL-2 基于16S rDNA 序列構建的系統進化樹
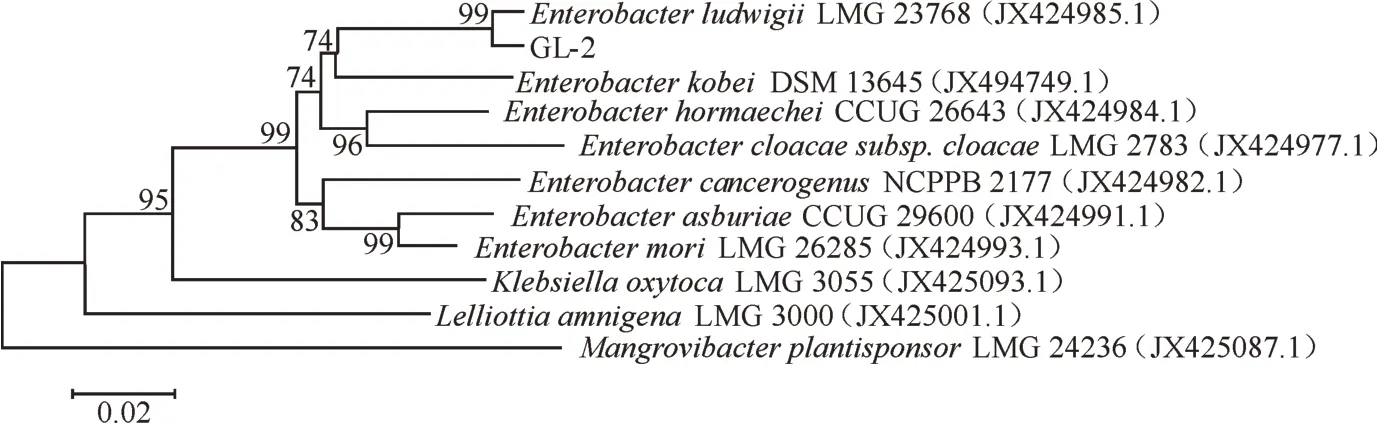
圖3 GL-2 基于gyrB 序列構建的系統進化樹
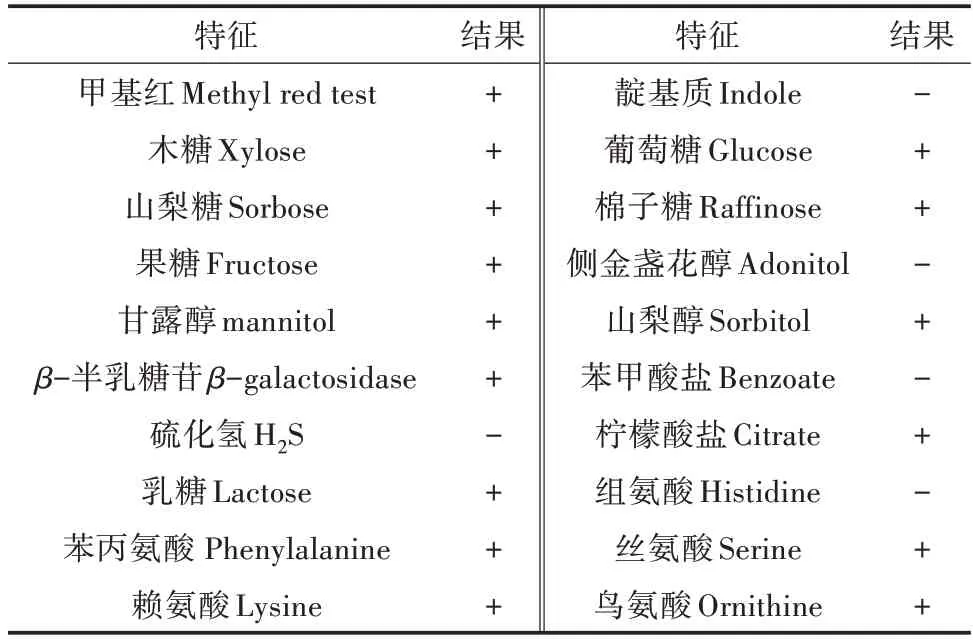
表2 GL-2 菌株的生理生化特征
2.4 GL-2 對重金屬處理下小麥生長的影響
小麥生長情況(圖4)表明,MS+PGPR 處理與MS+PGPR+Pb 處理的根長差異不顯著;但與添加Cd處理相比,株高、根長及鮮重差異均達顯著水平,說明重金屬影響了小麥的生長,加入Enterobacter ludwigiiGL-2 對小麥生長具有一定的促進作用,可以減輕重金屬對小麥生長的影響,特別是促進了小麥根長和增加了生物量。
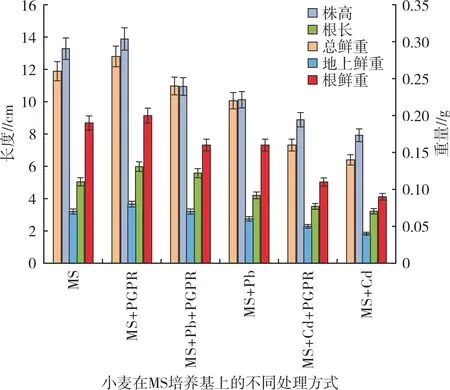
圖4 小麥生長情況
2.5 GL-2 對盆栽小麥生長的作用
盆栽試驗結果(表3)表明,3種不同處理下,小麥的株高、根長和主根數沒有明顯差異。然而PGPR活菌(1×108cfu/mL 和1×105cfu/mL)接種小麥后,小麥根鮮重、分蘗數和根干重與對照相比具有顯著差異。處理2 小麥根鮮重、分蘗數和根干重分別比對照增加了102.80%、93.17%和216.67%。處理3小麥根鮮重、分蘗數和根干重分別比對照增加了27.97%、55.28%和53.33%。PGPR 活菌在1×108cfu/mL 濃度下對小麥生長具有較強的促生效果。

表3 GL-2 對小麥的生長作用
3 討論
腸桿菌在自然界中廣泛存在,PGPR 對土壤修復已被證明是促進植物生長和保護植物免受重金屬毒性的一種經濟有效的方法[20,21]。此外,與植物相關的PGPR 細菌可能會使土壤中的重金屬產生生物球或沉淀,并通過與陰離子官能團結合而降低重金屬對生物利用率的毒性,還可以利用細胞外聚合物(多糖、蛋白質、腐殖質等)或細菌產生的鐵載體、有機酸螯合金屬離子以及熒光假單胞菌Pseudomonas fluorescensACC9、P.fluorescensACC 23、Enterobactersp.NBRI K28 SD1 和Enterobacter ludwigiiNCR3的生理機制來促進植物生長和對重金屬的吸附[1,3,22]。
本研究中,GL-2 屬于Enterobacter ludwigii,具有生長速度快、嗜鐵素活性強的特性,在重金屬MIC 試驗中,GL-2 對4 種不同重金屬具有一定的耐受性,尤其是在含有Pb的培養基中MIC 高達650 mg/L,在含有50 mg/L 重金屬Pb的MS 培養基中接種GL-2 菌株,小麥的根長和鮮重的生物量與對照無顯著性差異,說明GL-2 菌株改善了重金屬下小麥的生長環境,提高了小麥的生物量,減少了重金屬對小麥生長的影響。盆栽小麥生長研究表明,Enterobacter ludwigiiGL-2 在1×108cfu/mL 濃度下,小麥根鮮重、分蘗數和根干重與對照相比具有顯著差異,分別比對照增加了102.80%、93.17%和216.67%,對小麥的生長發育起到促生作用,這種明顯的促生作用還有可能與其篩自小麥根際土壤有關。
綜上,本試驗對篩選、鑒定的PGPR 菌株、抗重金屬能力及其對小麥施用效果的研究結果表明,PGPR 菌 株Enterobacter ludwigiiGL-2對減輕重金屬影響和小麥生長具有積極的促進作用,對于制作微生物菌肥具有潛在的應用價值。另外,植物生長也受菌株、植物特性和土壤環境等因素影響,這些都需要進一步的研究來證實。

