分子動力學模擬超高壓結合熱處理對β-乳球蛋白結構的影響
簡清梅,索化夷,張喜才,茍興能,黃業傳,*
(1.荊楚理工學院生物工程學院,湖北 荊門 448000;2.西南大學食品科學學院,重慶 400715;3.西南科技大學生命科學與工程學院,四川 綿陽 621010)
牛乳營養豐富,是深受人們喜愛的一種食物。乳制品的殺菌現仍以巴氏殺菌等熱處理為主,但加熱或多或少會降低產品的品質。隨著人們對高質量食品的需求不斷增加,希望在保證食品安全的情況下盡量減少營養損失。由此一些非熱殺菌技術,如超高壓在食品中的應用越來越受到重視,其在具有良好殺菌效果的同時使食物中小分子營養和風味物質得以較好保存,超高壓用以牛奶殺菌也有很多研究[1-2]。食物中的一些耐壓細菌在高達1 000 MPa的壓力下仍能存活,因此現在超高壓在食品殺菌的應用主要是壓力結合一定的溫度進行處理,一般溫度不超過60 ℃[3-4]。高壓結合熱處理會對大分子的食品蛋白質造成影響,一些學者就高壓熱處理結合對蛋白理化性質、蛋白結構、蛋白氧化[5-6],及對酶活性的影響[7-8]等進行了研究。
高壓處理不可避免會影響牛乳中蛋白的結構和性質,進而影響產品品質。一些學者研究了超高壓處理對牛乳中蛋白的影響,如Bogahawaththa等研究表明高壓能使乳清蛋白,特別是β-乳球蛋白和免疫球蛋白G變性,還會破壞酪蛋白膠束的結構,600 MPa以上處理時通過巰基二硫化物的形成引起乳蛋白聚集[9];Considine等也發現超高壓下β-乳球蛋白的變性或聚集主要是蛋白中二硫鍵重排引起的[10];Russo等發現壓力較低時β-乳球蛋白的結構較穩定,而3 000 bar(即300 MPa)以上的壓力會使蛋白結構逐漸展開變性[11]。但這些研究仍以常規的實驗分析方法為主,如光譜技術、波譜技術、量熱技術等,因此仍不清楚超高壓處理過程中乳蛋白結構在微觀層面的變化。分子動力學模擬現已成為研究蛋白結構的一種有效方式,成為繼實驗和理論手段后從分子水平了解和認識蛋白質世界的第三種手段,是一種具有足夠小的時間尺度和空間尺度的強大模擬技術[12]。分子動力學用于研究牛乳蛋白的報道較多,主要是牛乳中的β-乳球蛋白與一些小分子結合的動力學模擬,如柑橘黃酮[13]、辣椒素[14]、姜黃素[15]、茶多酚[16]、蘆丁[17]等。就處理方式而言,關于熱處理對蛋白影響的分子模擬較多,如一些學者研究了加熱條件下乳蛋白結構變化的分子動力學過程[18-21];而模擬超高壓對蛋白影響的研究較少,如Kurpiewska等模擬了胰島素在高壓下的結構變化[22],陳剛模擬了脂肪酶在高壓下的結構變化[12],分子動力學用于模擬牛乳蛋白在超高壓處理下的變化更是鮮有報道。
β-乳球蛋白是乳清中含量最為豐富的一種蛋白質,由于其良好的功能和營養特性,因此在食品工業中有廣泛的應用。β-乳球蛋白每個單體含有162個氨基酸,分子質量為18.4 kDa,是由8 條反向平行的β-折疊構成的桶狀結構,外側含有α-螺旋結構[23]。600 MPa被認為是能夠殺滅牛乳中絕大多數微生物的安全壓力[2],因此本研究以β-乳球蛋白為研究對象,從分子動力學角度探討300、600 MPa的壓力結合300、330 K的溫度對蛋白分子結構的影響,并與通常意義上比較劇烈的加熱溫度100 ℃(373.15 K)的熱處理進行對比,以更深入地了解高壓條件下β-乳球蛋白結構在微觀層面的變化。因分子動力學模擬得到的數據較多,為更好地反映蛋白分子結構的變化,采用方差分析-偏最小二乘回歸分析(analysis of variance-partial least squares regression,APLSR)法探討溫度和壓力對蛋白結構的影響規律。
1 材料與方法
1.1 分子動力學模擬
本研究中分子動力學模擬參考文獻[12-14,18],采用Gromacs(2019.6)軟件[24],β-乳球蛋白從RCSB PDB網站(www.rcsb.org)下載(ID號:3npo),下載后用PyMOL軟件手動除去結晶水。模擬過程中選用GROMOS54a7力場[25],將蛋白放入立方體水盒子中,水模型采用簡單點電荷(simple point charge,SPC)模型,使蛋白離盒子邊緣最短距離為1 nm,添加Na+使體系達到電中性,使用最速下降法對體系進行能量最小化[26]。然后在NVT和NPT系綜下分別進行400 ps的平衡,平衡后溫度為300 K,壓力達到預先設定的壓力值(0.1、300、600 MPa)。最后在設定的壓力和溫度下進行150 ns的分子動力學模擬,使用LINCS(linear constraint solver)算法約束所有鍵,使用PME(particle-mesh-Ewald)方法計算靜電作用,范德華相互作用使用截斷半徑為1.4 nm進行計算。選用Parrinello-Rahman壓浴方式、Isotropic控壓方式、V-rescale控溫方式。需要升溫時,溫度從300 K以10 K/ns的速度升至目標溫度(300、330、373.15 K),然后一直保持在目標溫度下。模擬步長為2 fs,每10 ps儲存1 次數據,每個處理平行模擬2 次。
模擬結束后,去除周期性邊界條件,然后使用Gromacs軟件相應的分析命令分析不同處理條件下蛋白結構的均方根誤差(root mean square deviation,RMSD)、均方根波動(root mean square fluctuation,RMSF)、回旋半徑、二級結構、溶劑可及表面積、蛋白體積和氫鍵數量的變化。其中RMSD、回旋半徑、蛋白體積均是提取全部150 ns的數據,每0.1 ns提取1 次,共1 500個數據點,以分析整個模擬過程中蛋白的結構變化情況;而蛋白二級結構、氫鍵數量、溶劑可及表面積、RMSF只分析蛋白穩定后的數據,即100 ns到150 ns的數據,共500個數據點。
1.2 APLSR分析
以7個0/1樣品變量(0.1 MPa-300 K、0.1 MPa-330 K、300 MPa-300 K、300 MPa-330 K、600 MPa-300 K、600 MPa-330 K、100 ℃(0.1 MPa-373.15 K))作為X變量,13個蛋白結構信息指標作為Y變量作PLS2分析。13個指標分別為RMSD、RMSF、回旋半徑、蛋白體積、總溶劑可及表面積、親水表面積、疏水表面積、氫鍵數量、α-螺旋數量、β-折疊數量、無規卷曲數量、轉角數量、彎曲數量,分別取100~150 ns共500個數據點的平均值,即每0.1 ns提取1 次數據。
為了更直觀地顯示壓力與溫度聯合作用對蛋白結構的影響,將100 ℃樣品去掉后,以主要設計變量(溫度:300、330 K;壓力:0.1、300、600 MPa)和6個0/1樣品變量作為X變量,上述13個蛋白結構指標為Y變量,進一步做PLS2分析。
APLSR分析采用Unscrambler V 9.7軟件,所有數據在分析前均進行標準化。
1.3 數據統計分析
實驗結果以平均值±標準差表示,分子模擬結果采用Origin 8.0軟件繪圖,APLSR分析的關系圖采用Unscrambler軟件繪制,采用SPSS軟件中的Duncan檢驗進行顯著性分析,P<0.05表示差異顯著。
2 結果與分析
2.1 高壓結合熱處理對β-乳球蛋白RMSD的影響
RMSD是衡量特定時間蛋白結構與原始構象的平均偏差,是評價模擬體系是否穩定的重要指標。由圖1可知,100 ℃的體系在100 ns后才達到平衡,而其他體系均是在75 ns以內達到平衡。從平衡以后RMSD的具體值來看,100 ℃加熱的體系RMSD遠大于其他體系,100 ns后的平均值為0.45 nm,而其他的處理組RMSD均小于0.33 nm,說明100 ℃加熱對β-乳球蛋白的結構破壞遠大于300、600 MP的壓力結合330 K的熱處理。從300 K下不同壓力來看,0.1 MPa時的RMSD最低,300、600 MP時RMSD相當,后者略高于前者,這說明壓力的增大能增加蛋白的不穩定性;陳剛報道脂肪酶在常溫下200、400、600 MPa處理時相對0.1 MPa時RMSD均有所增加[12],與本研究結論類似。330 K條件下樣品的RMSD總體上明顯高于300 K時,說明溫度對RMSD的影響顯著。從3個壓力結合330 K的結果來看,RMSD最大的是單獨330 K加熱的體系(0.33 nm),其略高于600 MPa-330 K(0.30 nm),遠大于300 MPa-330 K處理的體系(0.21 nm)。這說明壓力和加熱處理對蛋白結構的去穩定機制可能相反,即單獨的壓力或加熱都會使蛋白結構不穩定,但一定的壓力處理可以穩定由加熱導致的蛋白結構不穩定。鮮有關于高壓結合熱處理對蛋白RMSD影響的報道,Borgohain等報道了尿素可引起蛋白變性,但其對高壓變性有部分抵消作用[27],Angsupanich等報道了壓力和溫度影響魚蛋白結構的機理不同[28]。
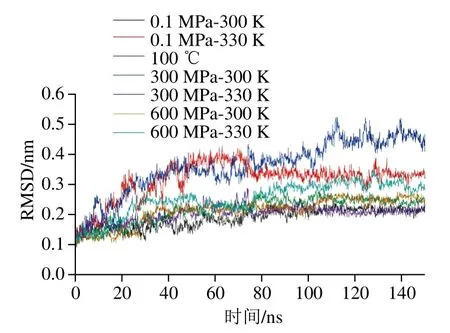
圖1 不同處理條件對β-乳球蛋白RMSD的影響Fig. 1 Effect of different treatments on the RMSD of β-lactoglobulin
2.2 高壓結合熱處理對β-乳球蛋白回旋半徑的影響
不同處理條件下蛋白回旋半徑的變化如圖2所示,回旋半徑越小表明蛋白結構越致密,反之則越膨脹。由圖2可知,各體系回旋半徑相差不大,相對而言,100 ℃的樣品和常壓下處理的2個樣品回旋半徑較大,且只有100 ℃的體系后期回旋半徑增加,而其他體系都是隨時間的延長有所減少,說明100 ℃加熱時蛋白會膨脹,而其他處理過程中蛋白或多或少都會變得更加致密。Sahihi等模擬柑橘黃酮與β-乳球蛋白間的結合時報道的回旋半徑比本研究的稍低,約1.40~1.45 nm,但Sahihi等是在常溫常壓下進行模擬[13],與本研究的模擬條件不同。

圖2 不同處理條件對β-乳球蛋白回旋半徑的影響Fig. 2 Effect of different treatments on the radius of gyration of β-lactoglobulin
2.3 高壓結合熱處理對β-乳球蛋白RMSF的影響
相比于平均構象,RMSF是蛋白中每一個氨基酸殘基的均方根位移,反映殘基的波動情況。加熱樣品在100 ns后結構才比較穩定,因此計算RMSF時均提取100~150 ns的蛋白結構。由圖3可以看出,氨基酸殘基波動較大的處理有100 ℃、常壓下330 K加熱、600 MPa-330 K樣品,這與RMSD和回旋半徑的分析結果基本一致。RMSF較大的一些殘基主要有77號賴氨酸、51號谷氨酸、63號天冬酰胺、8號賴氨酸、87號亮氨酸、112號谷氨酸、1號亮氨酸、162號異亮氨酸、159號谷氨酰胺、114號谷氨酸等,說明這些殘基在高壓處理過程中柔性較大,是導致蛋白結構不穩定的主要氨基酸。這與劉祥雨等報道的結果基本一致,他們在模擬β-乳球蛋白加熱過程中,發現35、51、87號位氨基酸波動較大[18]。
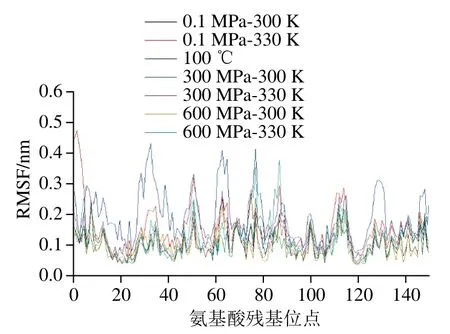
圖3 不同處理條件對β-乳球蛋白RMSF的影響Fig. 3 Effect of different treatments on the RMSF of β-lactoglobulin
2.4 高壓結合熱處理對β-乳球蛋白氫鍵數量的影響
氫鍵是穩定蛋白結構的一種重要的非共價結構力,由圖4可知,加熱或加壓處理均可減少蛋白的氫鍵數量,300 MPa處理組比常壓處理組平均少了2個氫鍵,600 MPa處理組比300 MPa處理組平均少了3個氫鍵;330 K處理組比300 K處理組的樣品平均少了1個氫鍵,而100 ℃加熱處理組氫鍵在330 K處理組的基礎上氫鍵數量又平均減少了4個左右。氫鍵是穩定蛋白質結構的主要作用力之一,因此氫鍵數量的減少會使蛋白結構穩定性降低。劉祥雨等的模擬研究表明100 ℃及以下的溫度對β-乳球蛋白的氫鍵數量影響不大,而120 ℃的加熱才會顯著減少蛋白的氫鍵數量[18],這與本研究得到的結果有所差異。

圖4 不同處理條件對β-乳球蛋白氫鍵數量的影響Fig. 4 Effect of different treatments on the number of hydrogen bonds in β-lactoglobulin
2.5 高壓結合熱處理對β-乳球蛋白體積的影響
各處理對蛋白體積的影響如圖5所示,加熱處理可以增加蛋白體積,溫度越高增加幅度越大;而壓力增加則減小蛋白體積,壓力越大則蛋白體積減小幅度也越大。因此加熱和加壓對蛋白結構的影響是不同的,加熱使蛋白膨脹,而加壓使蛋白收縮從而變得更加致密。這些結果與前面回旋半徑的結果一致。Kurpiewska等報道了胰島素在100 MPa下體積減小1.4%[22]。根據Le Chatelier原理,高壓下蛋白朝著體積減小的方向進行,主要是高壓下水分子進入疏水腔使疏水腔變形進而體積減小[29]。

圖5 不同處理條件對β-乳球蛋白體積的影響Fig. 5 Effect of different treatments on the volume of β-lactoglobulin
2.6 高壓結合熱處理對β-乳球蛋白溶劑可及表面積的影響
由表1可知,不同處理顯著影響蛋白的溶劑可及表面積。具體來看,100 ℃的加熱可顯著增加溶劑可及表面積,疏水表面積和親水表面積都顯著增加,這可能是該溫度下蛋白充分變性所致,這與劉祥雨等報道的結果[18]一致。而高壓結合300、330 K的處理相比常溫常壓組(0.1 MPa-300 K)則顯著降低了總溶劑可及表面積和疏水表面積,親水表面積除了0.1 MPa-330 K和300 MPa-300 K處理組外也顯著降低。300 MPa-300 K處理組總溶劑可及表面積及疏水表面積均降低最多,這可能與高壓下蛋白體積減小有關,而處理條件更劇烈時,如溫度增加或壓力繼續升高,可能導致部分蛋白變性聚集,使溶劑可及表面積反而有所增加。本研究中親水表面積始終大于疏水表面積,因此無論是在加熱還是高壓處理過程中,β-乳球蛋白總體上都是水溶性的。疏水表面積的減少可能是高壓下水分子滲透進入蛋白分子內部使更多的疏水區域暴露在極性水溶液中[30]。有關壓力作用下蛋白疏水性的變化有一些報道,但結果不一致,有的學者報道隨壓力的增加蛋白的疏水作用減弱[29,31],而另一些學者報道高壓下蛋白的疏水性增加[32-33]。但上述兩種報道是以表面疏水性為測定指標,采用實驗手段得出的結論,而本研究測定的指標為疏水表面積,是通過分子模擬得出的結論,兩者不能完全劃等號。

表1 不同處理條件對β-乳球蛋白溶劑可及表面積的影響Table 1 Effect of different treatments on the solvent accessible surface area of β-lactoglobulin
2.7 高壓結合熱處理對β-乳球蛋白二級結構的影響
由表2可知,與常溫常壓(0.1 MPa-300 K)處理組相比,隨壓力增加或溫度的升高,蛋白的結構也發生了明顯的變化,主要是α-螺旋和β-折疊數量減少而無規卷曲數量增加,其中100 ℃處理組樣品比所有壓力處理樣品變化更劇烈,這和前面的研究結果是一致的。劉祥雨等的模擬結果也表明加熱處理能顯著降低該蛋白的α-螺旋和β-折疊數量,而增加無規卷曲的數量[18];曹艷蕓也用實驗手段測得加熱后蛋白的部分α-螺旋和β-折疊會向無規卷曲轉變[34]。與0.1 MPa-300 K組樣品相比,各組樣品中蛋白二級結構變化最顯著的為600 MPa-330 K處理組,其無規卷曲和β-折疊數量的變化尤為突出,而彎曲和轉角數量的變化相對較小且缺少規律性。因此,相對于100 ℃的高溫處理,高壓結合一定溫度的熱處理可以較好地穩定蛋白二級結構,但600 MPa結合330 K的處理條件仍會使蛋白二級結構發生較大的改變。邱春江研究表明肌原纖維蛋白在高壓下α-螺旋數量下降[32],α-螺旋對壓力比較敏感可能是高壓下蛋白的氫鍵受到一定程度破壞,因氫鍵對α-螺旋的穩定至關重要[35];白雨鑫的研究表明500 MPa的壓力對β-乳球蛋白的二級結構影響很小[33];Chen Gang等研究發現400 MPa的壓力處理能使大豆蛋白的α-螺旋數量減少而β-折疊數量增加[31],這些差異可能緣于蛋白不一樣或測定方法不一樣,他們大都采用實驗手段測得。總的來說,若將超高壓冷殺菌技術用于牛乳制品生產能更好地保持蛋白的結構。
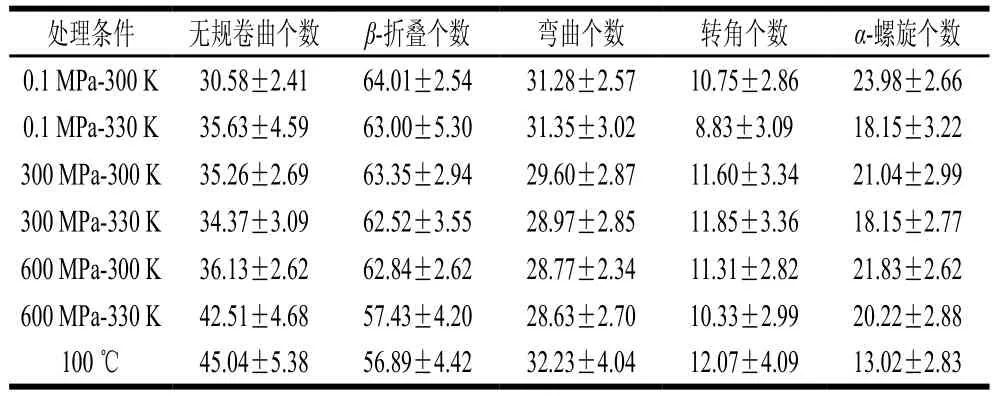
表2 不同處理條件對β-乳球蛋白二級結構的影響Table 2 Effect of different treatments on the secondary structure of β-lactoglobulin
2.8 APLSR分析的結果
前面雖然分別描述了不同處理對β-乳球蛋白13個結構指標的影響,但還是不能直觀看出溫度、壓力對蛋白結構總的影響規律;再加上模擬時間為150 ns,1 ns提取10個數據點,因此分析前面分的指標時均為500或1 500個數據點。為更好地了解高壓結合熱處理對β-乳球蛋白結構的影響,運用偏最小二乘回歸分析的PLS2程序探究溫度和壓力對蛋白結構的影響規律。
APLSR分析結果如圖6所示,X軸代表7個0/1樣品變量,Y軸代表β-乳球蛋白13個結構指標,第1、2主成分(principal component,PC)分別解釋了Y變量的58%和25%,大多數Y變量都位于r2=0.5(內圓)和r2=1(外圓)之間,具有較好的解釋效果。可以看出100 ℃處理的樣品位于載荷圖的最右端,和其他樣品距離均較遠,說明其對蛋白結構的影響不同于其他處理。具體來看,RMSD、RMSF、回旋半徑、總溶劑可及表面積、疏水表面積、親水表面積、蛋白體積等指標均在其附近,說明加熱處理會增加這些指標,導致蛋白結構的不穩定;蛋白的α-螺旋、β-折疊、氫鍵數量等指標位于載荷圖的左側,說明高壓結合一定的熱處理相比100 ℃加熱處理能更好地維持蛋白的二級結構和氫鍵。因100 ℃處理的樣品與其他樣品在蛋白結構上差異較大,以至于不同壓力間樣品在載荷圖上差異不明顯。為更好地探究壓力結合熱處理對蛋白結構的影響規律,將100 ℃處理的樣品去掉后,以6個0/1樣品變量和主要設計變量(壓力、溫度)為X軸,以蛋白結構信息變量為Y軸,再次進行APLSR分析,結果如圖7所示。

圖6 7個0/1樣品變量與蛋白結構信息的APLSR分析載荷圖Fig. 6 APLSR correlation loading plot of seven 0/1 indicator variables versus protein structural parameters
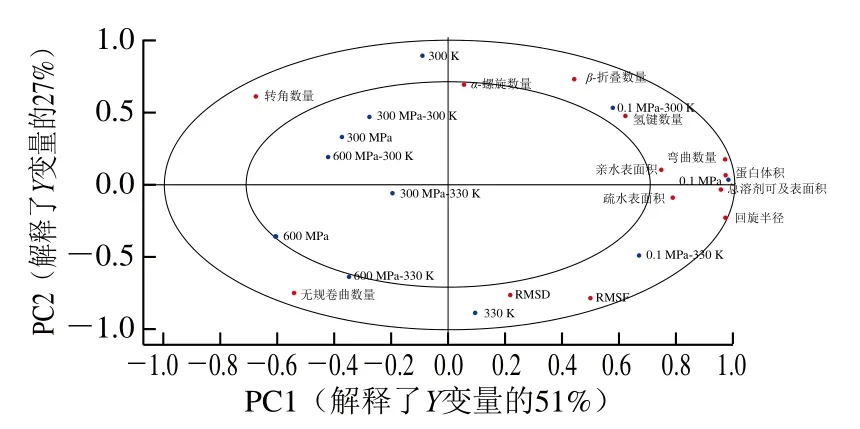
圖7 6個0/1樣品變量與蛋白結構信息的APLSR分析載荷圖Fig. 7 APLSR correlation loading plot of six 0/1 indicator variables versus protein structural parameters
由圖7可知,PC1、PC2分別解釋了Y變量的51%和27%,13個Y變量基本都位于r2=0.5(內圓)和r2=1(外圓)之間,因此能較好地反映不同處理樣品蛋白結構上的差異。不同壓力處理樣品的差異主要反映在PC1,其中常壓處理組位于載荷圖最右端,高壓處理組在載荷圖左側,300、600 MPa樣品的差異同時反映在PC2,前者位于載荷圖靠上位置,而后者在左下方。不同溫度處理樣品主要區別于PC2,其中300 K樣品位于上方,而330 K樣品位于下方。從Y變量來看,總溶劑可及表面積、疏水表面積、親水表面積、蛋白體積及回旋半徑均位于右側,與0.1 MPa樣品距離很近,說明高壓處理會顯著減少蛋白的溶劑可及表面積和體積,并使蛋白的結構更加致密,這與前面的分析結果是一致的。氫鍵數量與常溫常壓樣品(0.1 MPa-300 K)重疊在一起,說明不管是加熱還是加壓處理都會一定程度上破壞蛋白間氫鍵,從而影響蛋白的穩定性。α-螺旋數量和RMSD兩個指標主要區別于PC2,說明受溫度影響較大,溫度升高時,會使蛋白結構波動增加,并使α-螺旋數量明顯減少。另外,轉角、無規卷曲、β-折疊數量和RMSF分別位于載荷圖的遠離坐標軸的4個不同象限,說明這4個指標同時受溫度和壓力的影響,具體來看,溫度的升高和壓力的增加都會減少β-折疊數量,并相應地增加無規卷曲數量,常壓和330 K條件下蛋白氨基酸殘基數量波動最大,高壓和常溫條件下轉角數量最高。從圖7還可以看出,在330 K條件下,涉及蛋白結構穩定的3個指標RMSD、RMSF、回旋半徑均與常壓樣品距離較近(0.1 MPa-330 K),而與高壓處理樣品,特別是300 MPa樣品距離較遠(300 MPa-330 K),說明300 MPa的壓力處理能減小由于加熱導致的蛋白結構破壞,即一定的壓力處理可以保護熱處理導致的蛋白結構不穩定。
3 結 論
100 ℃加熱對β-乳球蛋白的結構破壞遠大于600 MPa結合330 K的處理,說明相比于完全的高溫,高壓結合一定溫度的聯合處理是一種較溫和的方式,蛋白的空間結構保留相對完整。與常溫常壓處理相比,高壓處理會導致蛋白的溶劑可及表面積、蛋白體積減小,而使蛋白結構更加致密;330 K的加熱處理會破壞蛋白結構,特別是使α-螺旋數量減少;壓力的升高和溫度的升高均能使蛋白間氫鍵、β-折疊數量減少,相應的無規卷曲數量增加;而氨基酸殘基波動則隨溫度升高而增加,隨壓力增加而減小。一定的壓力處理,特別是300 MPa能減緩熱處理(330 K)導致的蛋白結構波動。本研究從分子動力學角度分析了高壓結合一定溫度的熱處理對β-乳球蛋白結構的影響,為進一步了解高壓對食品蛋白的影響和促進高壓技術在含蛋白食品中的應用奠定了一定的理論基礎。

