海參多糖生物學活性及其作用機制研究進展
王靜杰,鐘 強,董春暉,李海靜,王 浩,夏秀芳
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
海參是珍貴的藥食兼用海洋動物,具有多種生物學活性成分如多糖[1]、皂苷[2]、多肽[3]、腦苷脂[4]和酚類等,其中海參多糖因其高生物學活性、低毒的特點成為新的研究熱點。自2008—2020年,在中國知網和Science Direct數據庫中分別以關鍵詞“海參多糖”和“sea cucumber polysaccharide”進行搜索,得到已發表的相關論文191 篇,主要研究內容包括海參多糖的提取純化、結構及生物學活性(圖1A)。其中,研究海參多糖提取純化的論文有20 篇,占相關論文總數的10.5%;研究其結構的論文有70 篇,占相關論文總數的36.6%;研究其生物學活性的論文有131 篇,占相關論文總數的68.6%。綜上可知,關于海參多糖的重點研究內容為其結構及生物學活性。同時,與重點研究內容相關的論文篇數呈逐年增加的趨勢(圖1B)。
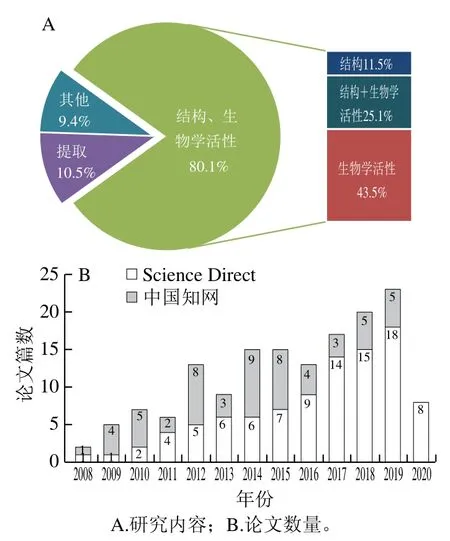
圖1 2008—2020年海參多糖研究論文數量分布Fig. 1 Distribution of papers on sea cucumber polysaccharides published during 2008-2020
海參多糖的生物學活性主要表現在抗腫瘤[5]、抗氧化[6]、抗凝血[7]及抗帕金森病[8]等方面。從化學角度分析,海參多糖的生物學活性由其結構決定。海參多糖的兩種主要形式包括海參巖藻糖基硫酸軟骨素(sea cucumber fucosyl chondroitin sulfate,SC-FCS)和海參巖藻聚糖硫酸酯(sea cucumber fucoidan,SC-FUC),兩者的結構特性如分子質量、單糖組成、一級結構及鏈構象(高級結構)間存在顯著差異。因此,需要對兩種海參多糖SC-FCS和SC-FUC的結構特性進行系統研究以明確其結構與生物學活性之間的關系,從而為開發基于SC-FCS或SC-FUC的具有特定生物學活性的保健品或藥品等提供理論依據。
由于海參多糖的結構及生物學活性多樣,且兩者間關系緊密。因此,本文旨在對海參多糖的結構特性、生物學活性、作用機制以及構效關系進行系統綜述,以期為海參多糖的精深加工及進一步商業化應用提供一定的參考。
1 海參多糖的結構特性
海參多糖的結構特性包括其分子質量、單糖組成、一級結構以及高級結構。在不同種類的海參中兩種形式的海參多糖SC-FCS和SC-FUC的結構特性間存在較大差異。
1.1 海參多糖的分子質量
SC-FCS和SC-FUC的分子質量分布范圍較廣,分別為26.4~135.8 kDa和36.8~2 000.0 kDa。海參多糖分子質量的差異取決于海參種類和多糖種類。Dong Xiaodi等[9]分別從東海海參(Acaudina molpadioidea)和黑乳參(Holothuria nobilis)內提取SC-FUC,其分子質量分別為90.8 kDa和135.8 kDa。Li Shan等[10]從革皮氏海參(Pearsonothuria graeffei)中提取SC-FCS和SC-FUC,其分子質量分別為49.1 kDa和655.0 kDa。
1.2 海參多糖的單糖組成
海參多糖的單糖組成包括其所含單糖類型及單糖間組成比例,兩種海參多糖SC-FCS和SC-FUC的單糖組成顯著不同。
1.2.1 SC-FCS的單糖組成
SC-FCS主要由D-葡萄糖醛酸(glucuronic acid,GlcA)、N-乙酰-D-半乳糖胺(N-acetyl-β-D-galactosamine,GalNAc)、巖藻糖(fucose,Fuc)和硫酸鹽組成。不同種類海參的SC-FCS單糖組成比例間存在較大差異。Chen Shiguo等[11]發現從革皮氏海參(Pearsonothuria graeffei)、挪威紅參(Stichopus tremulus)、蕩皮海參(Holothuria vagabunda)及美國肉參(Isostichopus badionotus)中提取SC-FCS,其單糖組成n(GlcA)∶n(GalNAc)∶n(Fuc)∶n(硫酸鹽)分別為1.0∶0.8∶1.5∶2.6、1.0∶0.8∶1.2∶3.0、1.0∶1.1∶0.9∶2.7和1.0∶0.7∶0.9∶3.1,其中美國肉參中SC-FCS的硫酸基含量最為豐富,抗凝血活性最高。
1.2.2 SC-FUC的單糖組成
SC-FUC是由Fuc和硫酸鹽構成的線性多糖,兩者物質的量比與海參種類有關。白腹海參(Holothuria albiventer)[12]、大西洋海參(Holothuria coluber)[7]、象牙參(Holothuria fuscopunctata)[13]、美國肉參(Isostichopus badionotus)[14]及綠刺參(Stichopus chloronotus)[15]中SC-FUC的單糖組成n(Fuc)∶n(硫酸鹽)分別為1.00∶0.83、1.00∶0.74、1.00∶1.41、1.00∶0.92和1.00∶1.30。而糙刺參(Stichopus horrens)和梅花參(Thelenota ananas)[13]中SC-FUC的n(Fuc)∶n(硫酸鹽)相近,分別為1.00∶1.14和1.00∶1.19。
1.3 海參多糖的一級結構
海參多糖一級結構的研究主要側重于其單糖間連接方式、支鏈及硫酸化模式。兩種類型海參多糖SC-FCS和SC-FUC的一級結構間具有明顯差異。
1.3.1 SC-FCS的一級結構
SC-FCS由多個重復的硫酸軟骨素型主鏈(具有硫酸基巖藻糖分支)通過α-1,3-糖苷鍵連接而成。不同SC-FCS的主鏈結構基本一致(圖2A)。然而,不同種類海參中的SC-FCS,由于其主鏈中硫酸基取代位置、硫酸基巖藻糖分支取代位置、硫酸基巖藻糖分支的硫酸化模式或硫酸化模式間的比例存在差異,導致其整體結構不盡相同。
SC-FCS的硫酸軟骨素主鏈([→GlcA→GalNAc→]n)中GalNAc單元的O4、O6或O4和O6位均可能發生硫酸基取代[16],且在不同種類海參中的取代比例不同[17]。SC-FCS中硫酸基巖藻糖分支可能與硫酸軟骨素主鏈中GlcA單元的O3位[18]、GalNAc單元的O4或O6位[19]相連。硫酸基巖藻糖分支的硫酸化模式主要有4 種,分別為α-L-Fuc3S、α-L-Fuc4S、α-L-Fuc2S4S和α-L-Fuc3S4S(S為硫酸基團)。其中,α-L-Fuc4S與多糖的抗氧化作用密切相關[20],而α-L-Fuc2S4S與多糖的抗凝血作用密切相關[9]。洞穴海參(Massinium magnum)[21]和墨西哥海參(Holothuria mexicana)[18]中SC-FCS的巖藻糖分支硫酸化模式不同,分別為α-L-Fuc3S4S和α-L-Fuc4S、α-LFuc2S4S、α-L-Fuc3S4S。而與巖藻糖分支硫酸化模式相同的SC-FCS,其硫酸化模式間的比例也有差異。從白斑海參(Holothuria polii)[22]及地中海瓜參(Cucumaria syracusana)[23]中提取得到的巖藻糖基硫酸軟骨素的硫酸化模式一致,均為α-L-Fuc2S4S和α-L-Fuc3S4S,但兩者所占比例不同,在白斑海參(Holothuria polii)中α-LFuc2S4S和α-L-Fuc3S4S分別為46.0%和54.0%,在地中海瓜參中分別為57.5%和42.5%。
1.3.2 SC-FUC的一級結構
SC-FUC是由多個硫酸基巖藻糖重復單元通過α-1,3-糖苷鍵或α-1,4-糖苷鍵連接而成的線性多糖,其結構如圖2B所示。迄今為止,從不同種類海參中提取的SC-FUC的一級結構均不同,它們具有不同的硫酸基巖藻糖重復單元、連接方式或硫酸化模式[13]。
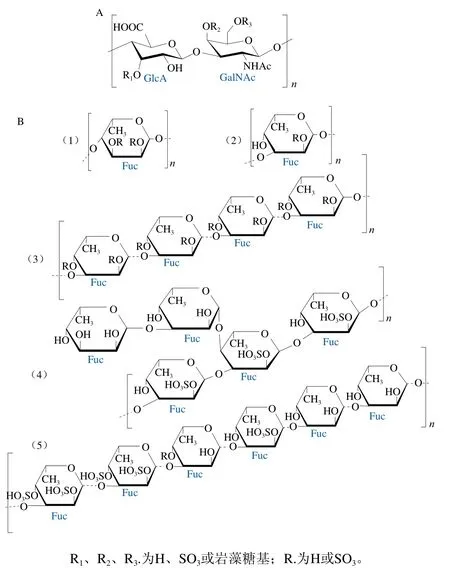
圖2 SC-FCS(A)[26]和SC-FUC(B)[12-13,15,24,31]的結構式Fig. 2 Structures of sea cucumber fucosyl chondroitin sulfate (A)[26]and sea cucumber fucoidan (B)[12-13,15,24,31]
SC-FUC的硫酸基巖藻糖重復單元包括4 種,分別為單巖藻糖重復單元、四巖藻糖重復單元、五巖藻糖重復單元和六巖藻糖重復單元。Shang Feineng等[13]發現糙刺參中SC-FUC由單巖藻糖重復單元構成,Yu Long等[24]發現海地瓜(Acaudina molpadioides)中的SC-FUC由四巖藻糖重復單元構成,Kariya等[25]發現刺參(Stichopus japonicas)中的SC-FUC由五巖藻糖重復單元構成,而Cai Ying等[12]發現白腹海參中的SC-FUC由六巖藻糖重復單元構成。SC-FUC中硫酸基巖藻糖有α-1,3-糖苷鍵連接和α-1,4-糖苷鍵兩種連接方式。SC-FUC中硫酸基巖藻糖的硫酸化模式有4 種,分別為α-L-Fuc2S、α-L-Fuc3S、α-L-Fuc4S和α-L-Fuc2S4S,可能發生于每個巖藻糖基。
表1和表2分別總結了不同種屬海參中SC-FCS和SCFUC的分子質量、單糖組成及一級結構。
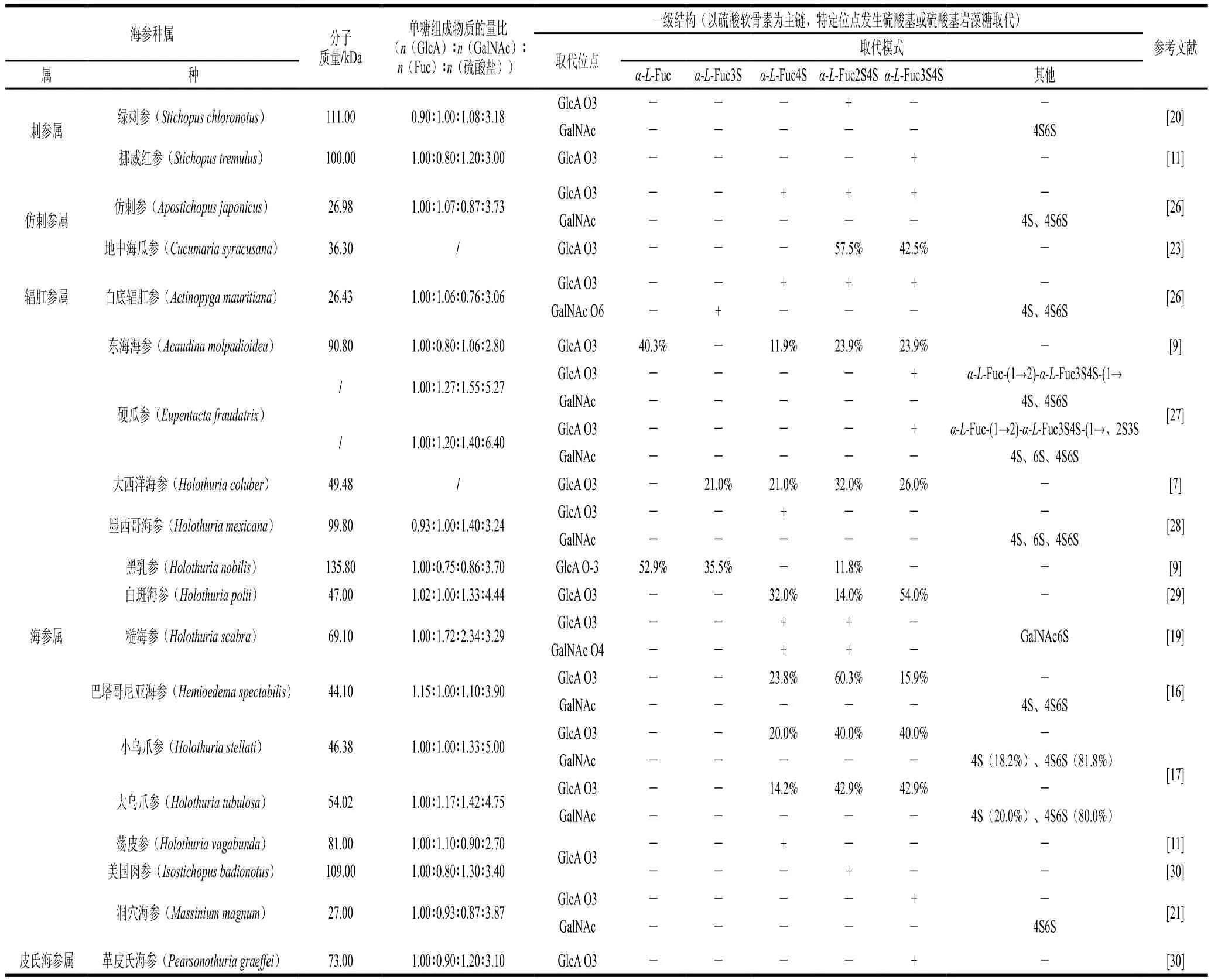
表1 SC-FCS的結構特征總結Table 1 Summary of structural features of sea cucumber fucosyl chondroitin sulfate
1.4 海參多糖的鏈構象
1.4.1 SC-FCS的鏈構象
SC-FCS具有隨機螺旋或剛性棒狀鏈構象,其鏈構象由多種因素(分子質量、硫酸鹽含量、海參種類及鹽溶液濃度)綜合決定。Mou Jiaojiao等[35]發現墨西哥海參(Holothuria mexicana)和仿刺參(Apostichopus japonicus)中多糖fCS-Hm與fCS-Aj具有相似的分子質量,其中fCS-Hm的硫酸鹽含量相對較低,鏈構象更為延展。Li Shan等[10]發現雖然美國肉參(Isostichopus badionotus)多糖fCS-Ib較革皮氏海參(Pearsonothuria graeffei)多糖fCS-Pg具有更高的分子質量和硫酸鹽含量,但是兩者具有相似的隨機螺旋鏈構象。表明除分子質量和硫酸鹽含量外,還有其他影響SC-FCS鏈構象的關鍵因素。海參種類不同,SC-FCS的構象不同。由于多糖在低離子強度溶液中溶解時會發生聚集,因此,鹽溶液的濃度也會影響其構象。仿刺參(Apostichopus japonicus)、美國肉參(Isostichopus badionotus)和革皮氏海參(Pearsonothuria graeffei)中的多糖fCS-Aj(0.15 mol/L NaCl、pH 7.4)[36]、fCS-Ib(0.2 mol/L NaCl)和fCS-Pg(0.2 mol/L NaCl)[18]具有隨機螺旋鏈構象;梅花參(Thelenota ananas)中的fCS-Ta(0.1 mol/L NaCl、pH 7.4)[37]在隨機螺旋和剛性棒狀之間具有鏈構象;綠刺參中的多糖fCS-Sc(0.02 mol/L磷酸鹽緩沖液)[38]具有剛性棒狀鏈構象。
1.4.2 SC-FUC的鏈構象
SC-FUC在NaCl溶液[33]或磷酸鹽緩沖液[15]中均呈現出柔性的隨機螺旋鏈構象。海參種類的不同導致SC-FUC的柔性存在差異。Xu Xiaoqi等[36]發現海參多糖FUC-Aj比FUC-Ib和FUC-Am具有柔性更高的隨機螺旋構象。與FUC-Am相比,雖然FUC-Ib在C2位置上增加了一個硫酸基團,但它仍然表現出與FUC-Am相似的柔性,表明硫酸化模式對鏈的柔性影響有限。Li Qiang等[15]發現來自綠刺參的FUC-Sc與來自仿刺參的FUC-Aj相比,其鏈構象具有更高的柔性。
2 海參多糖的生物學活性
海參多糖的主要生物學活性包括抗腫瘤、抗凝血、抗氧化和抗帕金森病,研究其活性效果及作用機制對于海參多糖的應用具有指導意義。同時,海參多糖的硫酸基巖藻糖分支、硫酸基含量、分子質量及硫酸化模式等結構特性與其生物學活性密切相關,兩者間關系的研究對于相關藥物的開發至關重要。然而,目前的構效關系研究主要針對于海參多糖的抗腫瘤、抗凝血及抗氧化活性,對于其抗帕金森活性與結構之間關系的研究較少。因此,本文將對海參多糖上述4 種主要生物學活性的效果及作用機制,以及抗腫瘤、抗凝血和抗氧化活性與結構間的構效關系進行介紹。
2.1 海參多糖的抗腫瘤活性
2.1.1 海參多糖的抗腫瘤活性效果
海參多糖SC-FCS和SC-FUC在抗肺癌、胰腺癌、乳腺癌、胃癌、腎癌、宮頸腺癌、肝癌、結腸腺癌等方面具有較好的活性。其中,SC-FCS的抗腫瘤活性高于SCFUC,這與SC-FCS具有硫酸基巖藻糖分支有關。張珣[39]從冰島刺參、東海海參和梅花參中提取多糖SC-FUC并將其作用于腫瘤小鼠,發現3 種海參提取多糖SC-FUC抑瘤率分別為27.45%、21.65%和15.61%。李輝[40]發現SC-FCS可以顯著抑制荷瘤小鼠腫瘤的生長,其平均抑制率為31.5%;同時,SC-FCS可以顯著減少肺表面轉移灶結節數量,平均抑制率為47.5%。Zou Shanmei等[41]發現海參多糖對正常小鼠的半數致死劑量(half maximal inhibitory concentration,IC50)均大于10 000 mg/kgmb,根據急性毒性分類標準認為海參多糖是完全安全的。
2.1.2 海參多糖的抗腫瘤作用機制
海參多糖直接作用于腫瘤組織(包括腫瘤細胞及腫瘤間質)或免疫細胞,通過抑制腫瘤細胞增殖、阻滯腫瘤細胞周期及核酸生成、抑制新生血管和阻滯腫瘤細胞轉移以及激活免疫調節反應發揮其抗腫瘤作用(圖3)。
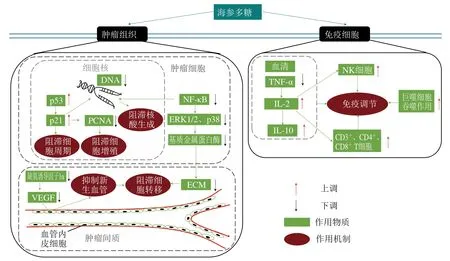
圖3 海參多糖的抗腫瘤作用機制Fig. 3 Antitumor mechanism of sea cucumber polysaccharides
2.1.2.1 阻滯細胞增殖
細胞增殖異常是腫瘤發生的主要特征,抑制腫瘤細胞的過度增殖是一種有效的治療途徑。p21作為細胞內的一種腫瘤抑制蛋白,海參多糖通過升高其表達水平,促進其與增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)的結合,從而對腫瘤細胞的生長產生抑制作用。Song Yang等[42]發現海參多糖能降低肝癌病灶數量、縮小最大癌結節的體積,其機制可能與其降低PCNA數量、升高p21的水平有關。
2.1.2.2 阻滯細胞周期及核酸生成
由于腫瘤細胞的生長周期不受控制,導致其細胞形態、功能和代謝異常,進而破壞正常組織器官的結構并影響其功能。Liu Xiaoxiao等[43]發現海參多糖可以增加抑癌基因p53和p21基因的表達,阻滯細胞周期。薛魁金[44]發現海參多糖能夠促進胰腺癌細胞SWl990凋亡,并將細胞周期阻滯在G0/G1期,進而抑制其生長增殖。同時,海參多糖可明顯抑制腫瘤細胞DNA的合成,從而達到抑制腫瘤生長的目的。
2.1.2.3 抑制血管新生和阻滯腫瘤細胞轉移
腫瘤細胞轉移會增強腫瘤對機體的損害作用,是腫瘤治療失敗的主要原因。Liu Xiaoxiao等[43]發現海參多糖可以下調核因子κB(nuclear factor κB,NF-κB)、細胞外信號調節激酶1/2(extracellular signal-regulated protein kinase 1/2,ERK1/2)、p38及基質金屬蛋白酶9的表達水平,減少細胞外基質(extracellular matrix,ECM)的降解,阻滯腫瘤細胞轉移。此外,新血管生成也是腫瘤細胞轉移的關鍵步驟之一,海參多糖通過降低血管內皮生長因子(vascular endothelial growth factor,VEGF)水平抑制新血管生成,進而阻滯腫瘤細胞轉移。
2.1.2.4 免疫調節
海參多糖可以通過激活多種免疫細胞(自然殺傷(natural killer,NK)細胞、巨噬細胞和T淋巴細胞等)的調節作用發揮其抗腫瘤活性。作為抵抗腫瘤發展的第一道免疫防線,NK細胞可快速識別和裂解多種腫瘤細胞,在腫瘤細胞的免疫監視中發揮著重要作用,海參多糖可增強其活性。同時,海參多糖可以通過提高巨噬細胞的吞噬功能發揮其抗腫瘤作用。此外,海參多糖通過增強腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、降低T細胞生長因子白細胞介素2(interleukin 2,IL-2)的表達,上調分化簇(cluster of differentiation,CD)3+、CD4+和CD8+T細胞的水平,在抗腫瘤免疫調節中發揮重要作用。Song Yang等[42]發現低劑量的海參多糖可增加肝癌大鼠血清IL-2水平,降低TNF-α水平,高劑量的海參多糖通過增強NK細胞的殺傷作用,上調CD3+、CD4+和CD8+T細胞的表達水平,進而有效抑制肝癌細胞的生長。
2.1.3 海參多糖抗腫瘤活性與結構的關系
2.1.3.1 硫酸基巖藻糖支鏈及硫酸基含量
海參多糖的抗腫瘤活性與其硫酸基巖藻糖支鏈和硫酸基含量密切相關。SC-FCS中硫酸巖藻糖支鏈的存在使其具有較SC-FUC更高的抗腫瘤活性。Ustyuzhanina等[16]發現具有硫酸巖藻糖支鏈的海參多糖SC-FCS,其抗腫瘤活性高于線性多糖。同時,海參多糖硫酸基含量越高,其抗腫瘤活性越高。張珣[39]從冰島刺參、東海海參和梅花參中提取SC-FUC,發現3 種SC-FUC的硫酸基含量分別為29.31%、26.79%和23.42%,且其抗腫瘤活性與其硫酸基含量呈正相關。
2.1.3.2 分子質量
海參多糖的分子質量對其抗腫瘤活性具有顯著影響,與天然海參多糖相比,解聚后的低分子質量多糖表現出增強的生物學活性。這可能有兩方面的原因:一方面,分子質量減小導致多糖構象發生轉變,使其具有更大的延展趨勢且更為堅硬,從而具有更高的抗腫瘤活性[45];另一方面,低分子質量多糖的擴展構象可能會產生更多的活性位點,從而有助于增加其抗腫瘤活性。Li Junhui等[46]發現解聚多糖的分子質量較天然多糖低,其具有更好的抗腫瘤增殖作用及抗腫瘤細胞遷移效果。
2.2 海參多糖的抗凝血活性
2.2.1 海參多糖的抗凝血活性效果
人體內凝血系統發生紊亂將出現凝血異常,最終導致血管堵塞,形成缺鐵性心臟病等心腦血管類疾病,危害人體健康[47]。研究表明海參多糖具有較強的抗凝血活性,同種海參中SC-FCS的抗凝血活性高于SCFUC[7]。不同種海參中SC-FCS的抗凝血活性有所差異。Chen Shiguo等[11]通過活化部分凝血活酶時間(activated partial thromboplastin time,APTT)法測定美國肉參、革皮氏海參、挪威紅參和蕩皮海參中多糖的抗凝血生物效價,發現fCS-Ib和fCS-St的效價分別為135 IU/mg和183 IU/mg,與傳統抗凝劑肝素(效價為150 IU/mg)相當,而fCS-Pg和fCS-Hv的效價(分別為35 IU/mg和42 IU/mg)低于肝素。
2.2.2 海參多糖的抗凝血作用機制
海參多糖通過激活血漿中抗凝血酶(antithrombin,AT)或肝素輔助因子II(heparin cofactor,HCII)的表達,從而抑制內源性和外源性凝血途徑中的凝血因子(IIa和Xase)活性,發揮其抗凝血作用。APTT和凝血酶時間(thrombin time,TT)分別代表多糖通過凝血級聯的內源性和外源性途徑抑制血液凝固。Li Junhui等[48]發現海參多糖以劑量依賴的方式延長APTT和TT,表明其對內源性和外源性凝血途徑均具有抑制作用。AT和HCII是血漿中的抗凝蛋白酶,通過封閉凝血因子的活性中心使其滅活起到抗凝血作用。Chen Shiguo等[14]發現海參多糖可通過AT/HCII滅活凝血因子IIa。內源性凝血因子Xase是抑制內源性凝血途徑的最后一個靶酶,已成為開發具有潛在生理和治療應用的安全抗凝劑的主要靶點[49]。海參多糖衍生的寡糖可有效抑制Xase,從而達到抗凝血作用[50]。海參多糖的抗凝血作用機制如圖4所示。
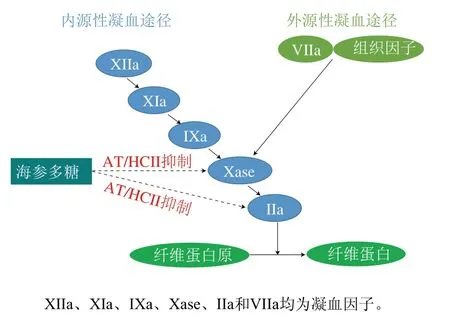
圖4 海參多糖的抗凝血作用機制Fig. 4 Anti-coagulation mechanism of sea cucumber polysaccharides
2.2.3 海參多糖抗凝血活性與結構的關系
2.2.3.1 硫酸化巖藻糖分支及硫酸化模式
硫酸化巖藻糖分支及硫酸化模式是SC-FCS的典型結構特征。其中,硫酸化巖藻糖分支是SC-FCS具有抗凝活性的關鍵因素,因為巖藻糖分支的部分釋放或脫硫均會極大地降低其延長凝血時間的作用[51]。同時,巖藻糖分支的硫酸化模式也對其抗凝血活性具有較大影響,具有α-L-Fuc2S4S硫酸化模式的SC-FCS抗凝血活性較高,這可能是因為具有此硫酸化模式的多糖更滿足與凝血酶結合的結構要求[52]。Chen Shiguo等[30]發現海參多糖fCS-Ib(α-L-Fuc2S4S)較fCS-Pg(α-L-Fuc3S4S)具有更高的抗凝血活性。
2.2.3.2 硫酸基含量
海參多糖SC-FCS和SC-FUC的硫酸基含量越高,其可能產生更高密度的負電荷序列,進而增強多糖的抗凝活性[53]。Dong Xiaodi等[9]發現硫酸基含量更高的SC-FUC其抗凝血活性更高。同時,當多糖的硫酸基含量達到或超過一定量時,不同的硫酸化模式不會影響多糖的抗凝血活性,表明硫酸基含量是抗凝血活性的決定性因素。Liu Xiaoxiao等[54]發現盡管兩種海參中SC-FCS的硫酸化模式不同,但其抗凝血作用相似。
2.2.3.3 分子質量
海參多糖分子質量對其抗凝血活性也有較大影響。天然海參多糖由于分子質量較大,極易引起血小板凝集,因此通常將其解聚為低聚糖。海參寡糖片段可以選擇性地靶向內源性凝血途徑,同時適度激活血小板凝集,具有更強且更安全的抗凝血活性。低聚糖的抗凝血活性隨分子質量的降低而降低[55]。Yan Lufeng等[56]發現在3.0~12.0 kDa分子質量范圍內,海參寡糖片段具有較好且較為安全的抗凝血活性,可以選擇在此分子質量范圍內研制抗凝藥物。
2.3 海參多糖的抗氧化活性
2.3.1 海參多糖的抗氧化活性效果
研究表明海參多糖具有良好的抗氧化活性。SC-FUC對超氧陰離子自由基的抑制作用優于傳統抗氧化劑VC。Yu Long等[57]發現海參多糖FUC-Ta對的抑制作用(IC50為(17.46±0.14)μg/mL)顯著高于VC(IC50為(132.64±2.73)μg/mL)。Mou Jiaojiao等[20]發現來源于3 種海參的SC-FCS(fCS-Sc、fCS-Am和fCS-Aj)在質量濃度4 mg/mL時表現出顯著的1,1-二苯基-2-三硝基苯肼自由基清除活性,三者清除率分別為68.3%、65.9%和48.1%。
2.3.2 海參多糖的抗氧化作用機制
海參多糖通過激活Nrf2/Keap1信號通路顯著提高內源性抗氧化酶(如過氧化氫酶(catalase,CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide diamutase,SOD))活力,清除活性氧(reactive oxygen species,ROS)自由基,從而降低脂質過氧化代表產物丙二醛(malondialdehyde,MDA)含量,表現出較高的抗氧化活性。海參多糖的抗氧化作用機制如圖5所示。
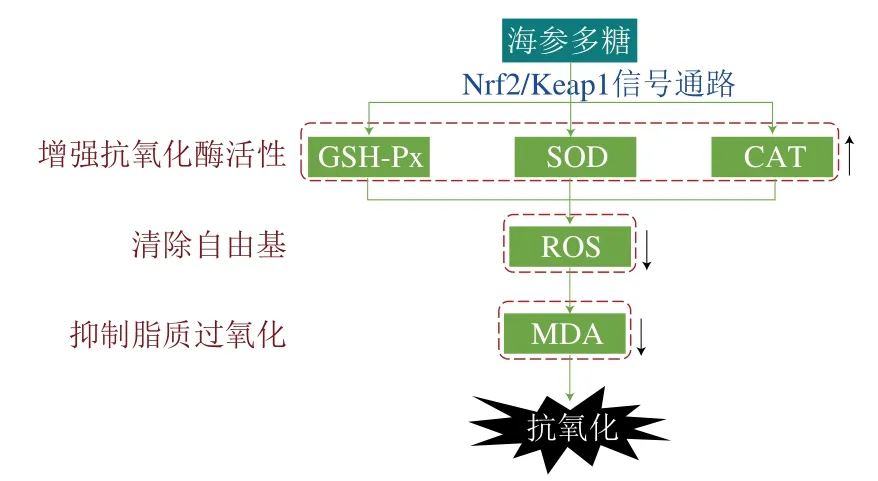
圖5 海參多糖的抗氧化作用機制Fig. 5 Antioxidant mechanism of sea cucumber polysaccharides
2.3.3 海參多糖抗氧化活性與結構的關系
2.3.3.1 硫酸化模式
海參多糖的硫酸化模式與其抗氧化活性密切相關。具有α-L-Fuc4S分支的SC-FCS具有更高的抗氧化活性。Mou Jiaojiao等[20]研究3 種不同SC-FCS(fCS-Aj、fCSAm、fCS-Sc)的抗氧化活性,發現分支硫酸化模式為α-L-Fuc3S4S的fCS-Aj抗氧化活性最弱,而分支硫酸化模式為α-L-Fuc4S的fCS-Am抗氧化活性最強。具有α-LFuc2S的SC-FUC抗氧化活性更高。FUC-Ib[14]與FUC-Ta[57]的結構相似,僅在特定殘基中具有額外的α-L-Fuc2S,而其對生成的抑制作用比FUC-Ib高約50%。
2.3.3.2 分子質量
海參多糖的分子質量對其抗氧化活性具有一定影響。多糖分子質量減小可能降低其抗氧化活性。Mou Jiaojiao等[58]將墨西哥海參(Holothuria mexicana)多糖降解得到低分子質量多糖,并比較兩者的抗氧化活性,發現所得低分子質量多糖的自由基清除能力較原多糖較有所降低。
2.4 海參多糖的抗帕金森病活性
2.4.1 海參多糖的抗帕金森病活性效果
帕金森病是第二大老年神經退行性疾病,嚴重影響老年人的生活質量。研究表明海參多糖具有抗帕金森病活性。Cui Chao等[8]使用6-羥基多巴胺(6-hydroxydopamine,6-OHDA)誘導人神經上皮瘤細胞SH-SY5Y作為帕金森病細胞模型,研究仿刺參多糖(Stichopus japonicaspolysaccharide,SJP)對SH-SY5Y細胞的影響,結果發現SJP可以保護SH-SY5Y細胞免受6-OHDA誘導損傷,表明SJP可以作為治療帕金森病的候選藥物。
2.4.2 海參多糖的抗帕金森病作用機制
海參多糖的抗帕金森病作用機制與其減輕氧化應激、干擾線粒體功能障礙及抑制細胞凋亡密切相關。
2.4.2.1 減輕氧化應激
海參多糖可顯著增強細胞內SOD活力,減少MDA和ROS生成,從而減輕細胞氧化應激,表現出抗帕金森病活性。
2.4.2.2 干擾線粒體功能障礙
海參多糖可以通過兩種途徑抑制線粒體內細胞色素c(cytochrome c,Cyt c)的釋放,干擾線粒體功能障礙,從而達到抗帕金森病效果。一種是通過降低細胞因子p53的活性,減少促凋亡蛋白Bax表達并增加抗凋亡蛋白Bcl-2表達,從而抑制線粒體Cyt c的釋放;另一種是通過降低線粒體膜電位的崩解,抑制線粒體內Cyt c釋放。
2.4.2.3 抑制細胞凋亡
海參多糖可以通過4 種途徑抑制細胞凋亡,發揮抗帕金森病作用。1)海參多糖抑制線粒體Cytc的釋放,從而減少細胞凋亡因子Caspase-9及Caspase-3的形成,抑制細胞凋亡;2)海參多糖通過抑制細胞周期蛋白D3的表達,將細胞周期阻滯于G1/S期,抑制細胞凋亡;3)海參多糖可以通過激活在細胞凋亡中起關鍵作用的p38/c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)-絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷酯酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinases B,Akt)途徑,抑制細胞凋亡;4)海參多糖通過抑制NF-κB的激活,從而阻止細胞內誘導型一氧化氮合酶(induced nitric oxide synthase,iNOS)上調和NO釋放,調節帕金森病多巴胺能神經元的毒性,抑制細胞凋亡。
海參多糖的抗帕金森病作用機制如圖6所示。
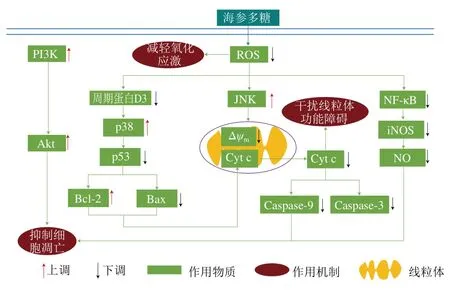
圖6 海參多糖的抗帕金森作用機制[8]Fig. 6 Anti-Parkinson mechanism of sea cucumber polysaccharides[8]
2.5 海參多糖的其他生物學活性
除抗腫瘤、抗凝血、抗氧化和抗帕金森病外,海參多糖還具有降血脂、抗炎、抗胰島素抵抗及抑制破骨細胞生成等生物學活性。
海參多糖通過降低小鼠體質量和血糖水平,提高胰島素敏感性,從而降低小鼠血脂水平[59]。Li Shan等[60]發現以α-L-Fuc4S為主要分支的海參多糖具有較強的降血脂作用。海參多糖通過調節糖代謝相關酶活性,促進肝糖原合成,同時調節血清炎性細胞因子及其mRNA在肝臟的表達,表現出較強的抗炎活性[59]。海參多糖可以在輔助性減輕炎癥反應[59]、降低血糖水平[61]或改變腸道微生物群[62]的基礎上,改善機體的胰島素抵抗作用。此外,海參多糖具有較好的抑制破骨細胞生成的能力。Kariya等[25]發現刺參中的兩種多糖在50 μg/mL質量濃度下,對破骨細胞生成的抑制率均大于95%。
3 結 語
由于海參多糖無毒性,結構獨特且具有抗腫瘤、抗凝血、抗氧化等多種生物學活性,其在保健食品、化妝品和制藥等領域存在廣闊的應用前景。目前,海參多糖的一級結構、主要生物學活性及作用機制已被廣泛研究,這對于海參多糖進一步開發應用具有重要的意義。然而,就目前的研究工作而言,海參多糖高級結構相關研究較少,導致其高級結構與生物學活性之間的構效關系尚未明確。為了更有效地開發利用海參多糖,今后可通過X射線衍射、圓二色光譜和原子力顯微鏡等技術對其高級結構進行研究,并在此基礎上,從分子水平深入探究海參多糖構效關系,進而有針對性地開發相關功能性保健食品或藥品。

