結直腸癌術后病人發生營養不良影響因素分析及風險預測模型構建
王 倩,王素云,蔣 巖,谷桂芳,王 燁
據統計,結直腸癌目前在中國人群惡性腫瘤中排第5位[1],手術是目前治療結直腸癌的主要手段,術后病人胃腸功能紊亂發生率高,極易造成營養不良,營養不良是由于攝取食物不能滿足機體需要,或機體消耗增加,食物消化、吸收、利用障礙,以致不能維持正常代謝,消耗自身組織 。研究顯示結直腸癌病人12%~76%存在營養不良,腫瘤自身的消耗與手術后的創傷可進一步引起營養不良,進而導致病人住院時間延長,費用負擔加大,縮短了病人生存期限[2-3]。因此,本研究旨在查找結直腸癌術后發生營養不良的危險因素,以期為高危病人提供及時的治療與護理,提高其生活質量,降低其營養不良發生率。
1 對象與方法
1.1 研究對象 選取2019年1月—2021年1月在山東大學齊魯醫院(青島)普外科住院的363例結直腸癌手術病人為研究對象。病人主觀全面評價(Patient-Generated Subjective Global Assessment,PG-SGA)分評判病人營養狀態。其中術后發生營養不良組121例,營養正常組242例。納入標準:①符合《中華醫學會腫瘤學分會.中國結直腸癌診療規范(2017年版)》[4]中關于結直腸癌的診斷標準且術后病理檢查確診者;②意識清楚,言語功能正常,能夠完成問卷調查;③知情同意。排除標準:①病情危重,合并嚴重的心、腦、腎臟等疾病;②術前存在營養不良;③治療期間出現其他嚴重的應激事件。
樣本量計算:n=[μα/2(2pq)1/2+μβ(p0q0+p1q1) 1/2]2/(p1-p0)2,q0=1-p0,q1=1-p1,p=(p0+p1)/2,q=1-p,p1=p0OR/(1-p0+p0OR),再根據病例組與對照組病例數為1∶C(1∶2)公式:n≈n(1+C)/2C。為提高檢驗效率,本研究采用最小的OR值和最適宜的p0進行樣本量的估算,計算得出n=112,需要病例組112,對照組224例,本研究中實際調查病例組121例,對照組242例,共計363例,符合樣本量的要求。
1.2 研究方法 由經過培訓的調查員對符合入選標準的住院病人進行問卷調查和病歷查閱結合方式。調查內容包括病人臨床資料、醫院焦慮抑郁量表、匹茲堡睡眠質量指數量表、Barthel指數和營養風險篩查量表。發放的問卷均標明編碼以確保回收無遺漏。問卷由調查員收回后當場進行核對,對漏答、錯答、可疑問卷及時糾正。
1.2.1 臨床資料調查表 為自行設計問卷,包括病人性別、年齡、文化程度、手術方式、腫瘤分期等。
1.2.2 PG-SGA 該量表是腫瘤病人營養評估工具[5]。其敏感度和特異性都較高,根據PG-SGA評估總分,其中0~1分為營養正常,2~9分為輕度或可疑營養不良,>9分為重度營養不良,得分越高說明營養不良程度越重。
1.2.3 Barthel指數(the Barthelindex of ADL)[6]以吃飯、穿衣、修飾、如廁、洗澡、大便控制、小便控制、轉移(床到輪椅)、上樓梯、活動(步行)為評價項目,總分為100分。≤40分為重度功能障礙,日常生活大部分需要他人幫助,41~60分為中度功能障礙,生活需要極大幫助,61~99分為輕度功能障礙,基本能夠獨立完成日常活動,100分為生活完全自理。
1.2.4 醫院焦慮抑郁量表(Hospital Anxiety and Depression Scale,HAD)[7]包括焦慮和抑郁兩個分量表,共計14個條目。每條按0~3級評分,分別計算焦慮、抑郁的分值,得分以8分為界。
1.2.5 營養風險篩查(Nutrition Risk Screening,NRS2002)[8]在病人入院24 h內完成評估,由疾病狀態、營養受損情況和年齡3部分組成,≥3分表示存在營養風險,<3分表示無營養風險。
1.2.6 匹茲堡睡眠質量指數量表(Pittsburgh Sleep Quality Index,PSQI)[9]包括有自評條目19個和他評條目5個,每個條目按0~3分等級計分,分別為睡眠質量、入睡時間、睡眠時間、睡眠效率等7個維度,得分越高說明睡眠質量越差。
1.3 統計學方法 采用 SPSS 22.0 軟件進行統計分析,單因素采用χ2檢驗,多因素采用Logistics回歸分析,采用R(R4.0.3)軟件包和rms程序包構建列線圖模型,Bootstrap法進行內部驗證,一致性指數(C-index)、校正曲線、ROC曲線評估模型預測能力。
2 結果
2.1 結直腸癌術后發生營養不良的單因素分析 結果顯示,年齡、腹部手術史、自理能力、睡眠、癌因性疲乏程度、是否存在焦慮抑郁、吸煙史、BMI、NRS2002結果、有無糖尿病、手術方式、腫瘤分期、術后有無造瘺及白蛋白是病人術后發生營養不良的影響因素(P<0.05)。見表1。
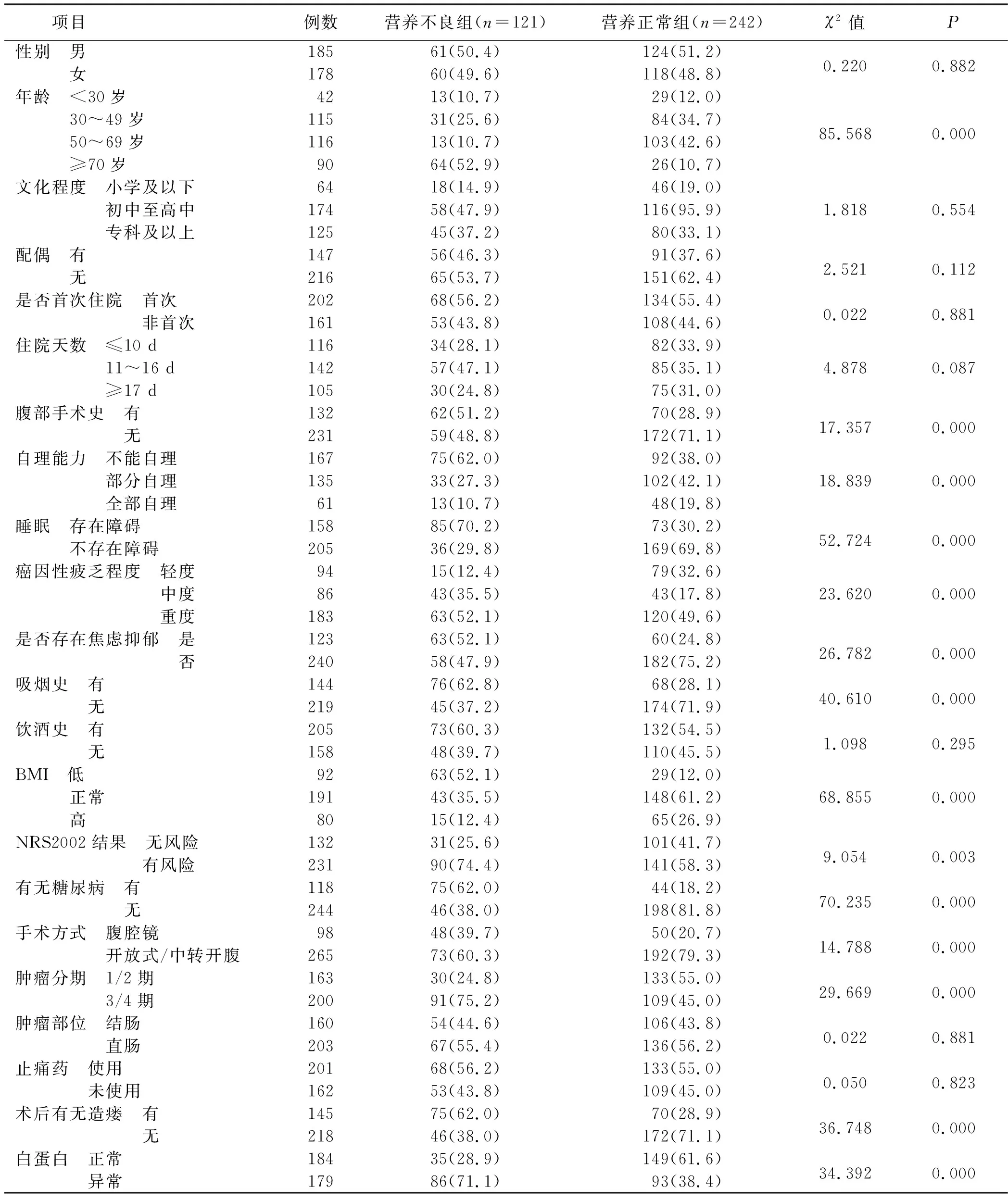
表1 結直腸癌術后病人發生營養不良的單因素分析 單位:例(%)
2.2 結直腸癌術后發生營養不良的多因素分析 在單因素分析的基礎上,以是否發生營養不良為因變量,以單因素分析中有統計學意義的變量為自變量,進行二元Logistics回歸分析。結果顯示,年齡、睡眠、吸煙史、BMI、NRS2002結果、有無糖尿病、手術方式、腫瘤分期、術后有無造瘺及白蛋白是病人術后發生營養不良的影響因素(P<0.05)。見表2。

表2 結直腸癌術后發生營養不良的多因素分析
2.3 預測結直腸癌術后病人發生營養不良的列線圖風險模型的建立 基于年齡、睡眠、吸煙史、BMI、NRS2002結果、有無糖尿病、手術方式、腫瘤分期、術后有無造瘺及白蛋白等因素建立結直腸癌術后病人發生營養不良的列線圖模型(見圖1)。使用Bootstrap驗證該模型,結果顯示:校正曲線與理想曲線擬合良好(見圖2);C-index指數為0.956,ROC曲線下面積(見圖3)為0.956,敏感度為0.876,特異度為0.917,本研究預測能力較強。
3 討論
本次研究結果顯示年齡、睡眠、吸煙史、BMI、NRS2002結果、有無糖尿病、手術方式、腫瘤分期、術后有無造瘺及白蛋白是病人術后發生營養不良的影響因素。年齡越大發生營養不良風險越高,與多數研究[10-11]結果類似。可能因為老年人攝食相對減少、基礎代謝率降低、消化吸收功能減弱、肌肉減少癥等因素有關,大手術后極易出現負氮平衡,發生營養不良。睡眠是人類不可缺少的一項生理功能,其中慢波睡眠有利于機體體力及精神的恢復,快波睡眠可促進腦內蛋白合成[12-13],促進神經系統的發育,慢性失眠病人的血清腦源性神經營養因子(BDNF)和膠質源性神經營養因子(GDNF)水平較正常人降低,抑制神經元生長、發育及功能完整性,影響機體免疫,不利于胃腸功能恢復而造成營養障礙[14]。吸煙可致COPD穩定期病人血清白細胞介素(IL)-6、IL-18、Clara細胞分泌蛋白(CC16)水平降低,能增加COPD病人發生營養不良的風險[15]。戒煙戒酒有利于加速手術后恢復。一項探討消化系統惡性腫瘤營養風險危險因素研究[16]結果顯示BMI對存在營養風險均具有較好的檢驗效能,可作為判斷此類病人發生營養風險的獨立危險因素。
BMI偏低者會導致病人免疫力下降,造成骨質疏松及胃下垂等危害,影響胃腸道正常吸收營養物質功能,極大增加術后病人發生營養不良風險。NRS 2002對結直腸癌病人全面篩查與評估,有助于及時、有效提高營養風險或營養不良的檢出率[17]。因此術前評估顯示存在營養風險的病人術后發生營養不良概率高。結直腸癌合并糖尿病病人手術容易出現很多的并發癥,影響手術后的愈合,血糖水平高影響傷口愈合,消化道術后病人血糖水平高,傷口愈合延遲,營養供給難度增加,術后創傷等因素導致血糖波動幅度較大[18],造成病人營養不良。開腹手術及腫瘤三四期病人病情較嚴重,營養風險及并發癥發生率高,與Nishimura等[19]研究結果一致。腹腔鏡手術切口較小,術中對機體周圍正常組織傷害程度小,降低手術創傷,術后病人恢復快。晚期腫瘤病人常出現體重丟失,死亡率增高[19-20]。術后有造口的病人一方面由于病理原因,造口的存在影響了正常消化吸收,改變了病人正常經口進食方式,多數病人不適應,術后未能得到及時的營養供給;另一方面造口容易發生滲漏,病人極易產生焦慮抑郁等不良情緒[21],病人病恥感加重,身體及心理的雙重不適使得營養攝入不足,消化吸收功能降低,營養障礙發生率增高。白蛋白是人體血漿中最主要的蛋白質,維持機體營養與滲透壓水平,因此白蛋白異常者發生營養風險高[22]。
(所有作者均聲明不存在利益沖突。)

