用人工哺乳新生仔豬進行臨床分離PEDV-XS12 的LD50 測定
王 劍,徐慧明,門程芳,徐一凡,于瑞嵩,董世娟,謝春芳,李 震
(上海市農業科學院畜牧獸醫研究所,上海市農業遺傳育種重點實驗室,上海 201106)
豬流行性腹瀉(Porcine Epidemic Diarrhea,PED)是由豬流行性腹瀉病毒(Porcine Epidemic Diarrhea Virus,PEDV)引起的一種高發病率、高死亡率的接觸性腸道傳染疾病[1-4]。 在我國,由于常年保持較高的生豬存欄量,因此,豬群腹瀉病常年頻發。 其中,PEDV 的感染在我國豬群腹瀉病中占主導地位[5-9],造成巨大的經濟損失。 2010—2013 年,PED 在我國、亞洲其他國家和美國相繼大規模暴發[10-19]。 當前,對該病進行控制的有效手段只有通過免疫妊娠母豬,使初生仔豬通過母乳而獲得免疫,但母豬抗體水平與仔豬保護的相關性研究目前還比較缺乏,其中原因之一就是既沒有統一的攻毒模型,也沒有大家公認的PEDV毒株用于建立攻毒模型。 半數致死量(Median Lethal Dose,LD50)原指在規定時間內,通過指定途徑,使一半受試動物死亡的有害物質、有毒物質或游離輻射的最小劑量[20-22]。 LD50的單位常用受試物質質量與受試動物質量之比表示[23-24],比如mg∕kg 或copies∕mL。 LD50是評價藥物優劣的重要參數,是衡量藥物及一切與人類或動物體接觸物質的安全標尺,對重復給藥試驗的劑量設置和藥物臨床試驗的起始劑量、最小有效劑量等指標的選擇具有重要參考價值。 如今,LD50已經廣泛應用于醫學、獸醫學、藥學等生命科學研究領域,是新藥非臨床安全性評價的重要指標[25-26],對后續新藥臨床試驗至關重要。
豬流行性腹瀉是一種侵害初生仔豬重要豬病,呈世界流行[1-3]。 疫苗是該病的唯一防控辦法,但目前PEDV 疫苗研制仍困難重重,缺少穩定可靠、可用于評估PED 疫苗的LD50攻毒模型是困難之一。 然而,國內外尚沒有公開發表與PEDV 有關的LD50試驗數據。 本研究對PEDV 腸毒株進行鑒定并擴增,利用qPCR對擴增后的PEDV 進行含量鑒定。 因目前未免疫PEDV 豬場很少,故采用人工飼喂,使用未吃初乳3 d 內的新生仔豬。 受試動物經口服途徑攻毒,并對其采食量、體重、體溫等生理指標進行24 h、為期7 d 的觀察與記錄。 通過改進寇氏法和Bliss 法計算PEDV-ZJXS12 LD50、LD0、LD100、i等。 本研究的方法及結果可為建立PEDV 新生仔豬的攻毒模型提供參考依據,對其他冠狀病毒疫苗的攻毒模型同樣具有參考價值。
1 材料與方法
1.1 毒株及實驗動物
PEDV 毒株:源自實驗室保存的經哺乳期仔豬接種擴增的流行性腸毒,后經基因進化樹、基因遺傳進化和基因同源性分析[27]。 分析結果表明,該毒株為流行毒株,在本研究中命名為PEDV-XS12 毒株。
實驗動物:PEDV-XS12 腸毒增殖的動物購自隆宇科技農業發展有限公司試驗用豬犬飼養中心,合格證編號:201827470。 LD50試驗動物購自哈爾濱周邊地區,體重(1.48 ±0.15)kg,公母各半,其父本均為‘杜洛克’,母本為‘大白’或‘長白’。 上述實驗動物均為未吃初乳的PEDVAg-∕Ab-新生1 日齡健康仔豬。
1.2 PEDV-XS12 富集與定量
1.2.1 PEDV-XS12 富集
無菌環境下,小腸組織勻漿液經0.9%氯化鈉注射用水稀釋至無肉眼可見組織的病毒液,4 ℃備用。
普通級環境下,對若干頭 PEDVAg-∕Ab-新生 1 日齡健康仔豬進行人工預飼 1 d,隨后以 1 ×106copies∕mL、5 mL∕kg 病毒濃度經口灌服仔豬(灌服前須停飼1 次)。 待仔豬進入 PED 臨床明顯期初期,即食欲下降并出現首次腹瀉時,立刻麻醉、剖殺,取小腸。 無菌環境下,將上述樣品勻漿并經0.45 μm、0.22 μm 一次性濾器過濾,-80 ℃保存,待測。
1.2.2 病料PEDV RT-PCR 鑒定
通過檢索美國國立生物技術信息中心(National Center for Biotechnology Information,NCBI)基因庫設計相關引物(表1)分別對 FMDV、TGEV、PCV2、CSFV、PPV、PRV、PDCoV、SSⅡ、PEDV 這 9 種病毒進行鑒定,排除試驗動物被其他疾病感染、致死的可能性。

表1 豬傳染性疾病引物Table 1 The list of primers of swine infectious diseases for RT-PCR
1.2.3 PEDV-XS12 qPCR 定量
引物與探針設計:利用MegAlign 軟件對NCBI 數據庫下載的多條PEDV-M 基因進行同源性分析,Primer Premier 軟件設計引物與熒光探針(表2),并由生工生物工程(上海)股份有限公司合成。 PEDV-M陽性標準品制備:首先,病毒勻漿液經核酸提取、cDNA 制備及擴增、1%凝膠電泳鑒定;其次,鑒定無誤后,分別將上述產物進行膠回收、連接與轉化(pMD?18-T Vector);最后,質粒提取、定量,并將其換算成拷貝數。 標準曲線制備:對上述反轉錄后的cDNA 樣品進行10 倍稀釋,上機檢測。

表2 PEDV-M 基因引物針序列Table 2 The sequences of primers and probe for PEDV-M
1.3 PEDV-XS12 攻毒
LD50試驗均在中國農業科學院哈爾濱獸醫研究所動物福利倫理委員會(Institutional Animal Care and Use Committee,IACUC)的嚴格指導下進行操作,IACUC 編號:HVRI-IACUC-2018-016。 實驗動物使用許可證編號:SYXK(黑)-2017-009。
1.3.1 最小致死劑量與最大耐受劑量
普通級環境下,通過UDP、FDP 分別估算出最小致死劑量(Minimum Lethal Dose,LD100)、最大耐受劑量(Maximum Tolerable Dose,LD0)。
1.3.2 PEDV-XS12 LD50
分組:PEDV-XS12 LD100、PEDV-XS12 LD0實驗動物均為 10 頭∕組,其余各組為 8 頭∕組,共 6 組。 受試動物采用人工飼喂,每次飼喂間隔3 h,預飼24 h,試驗周期7 d。 飼養環境均為生物安全等級(Biological Safety Level,BSL)-3 級,環境溫度30 ℃、濕度50%—60%、光照12 h 的屏障系統。
攻毒與臨床觀察:依據估算結果,對LD100和LD0的濃度做出預判,并計算出相鄰兩組劑量間的組距(Interval,i)、各組間濃度(表3)。 最終,以5 mL∕kg 病毒液經口灌服仔豬(灌服前須停飼1 次)。 試驗期間密切觀察仔豬臨床癥狀、記錄仔豬體溫、體重、采食量等各項體征指標(表4)。

表3 LD50分組計算明細Table 3 The list of PEDV concentration and interval for LD50

表4 LD50體征指標記錄Table 4 The list of pathological parameters for LD50 observation
2 結果與分析
2.1 PEDV-XS12 病料 RT-PCR 鑒定
通過RT-PCR 技術,排除受試動物臨床常見傳染疾病。 由圖1 可知,在擴增的前8 種傳染病中,樣品的結果均為陰性。 根據PEDV 檢測結果顯示,其M基因片段大小為468 bp,樣品與陽性對照條帶一致,水平位置略低于500 bp Marker,陰性對照無條帶。 因此,判斷該樣品只含有PEDV 流行毒株,即PEDV-XS12的核酸。
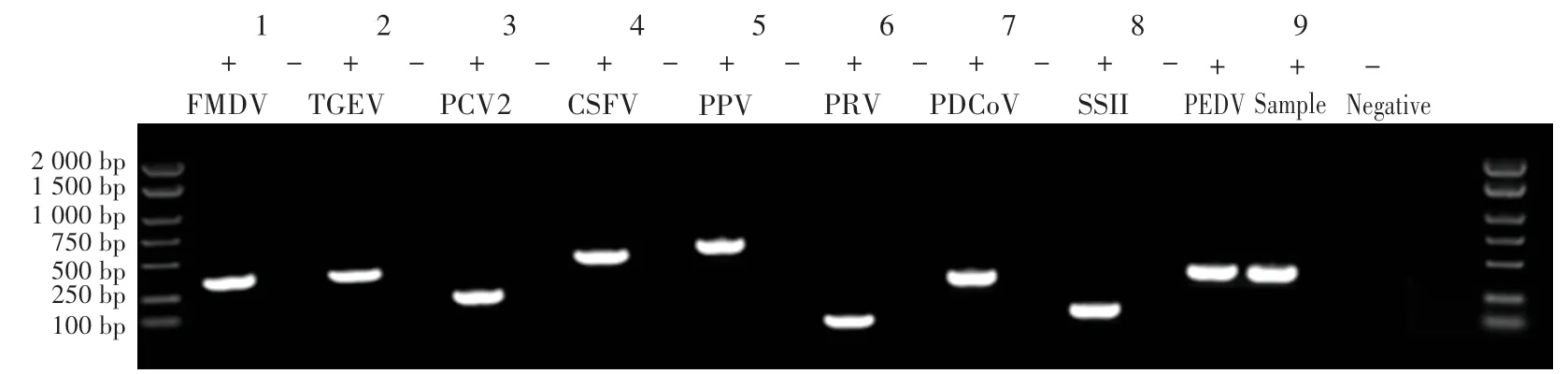
圖1 1%瓊脂糖凝膠電泳篩選結果Fig.1 The result of 1% agarose gel electrophoresis
2.2 病料PEDV-XS12 qPCR 載量檢測
由圖2 可知,PEDV qPCR 斜率為-0.030,擴增效率為113.8%。 用微量分光光度計測定質粒OD260值,并通過質粒濃度換算公式計算拷貝數(圖2、圖3)。
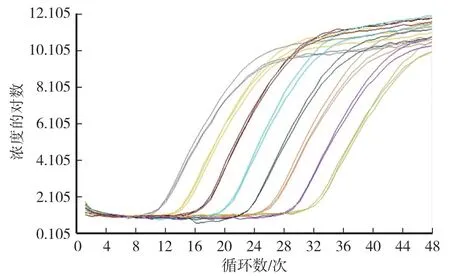
圖2 PEDV qPCR 標準曲線Fig.2 The standard curve of PEDV qPCR

圖3 目的基因PEDV-M 擴增曲線Fig.3 The result of amplification curve for PEDV-M gene
2.3 PEDV-XS12 LD50對仔豬體征的影響
2.3.1 PEDV-XS12 LD100對仔豬的影響
以200 copies∕mL、5 mL∕kg 的劑量對受試動物口服攻毒,通過動態監測受試動物的采食量、體重、體溫、24 h 排泄量(糞和尿)、死亡頭數,初步判斷PEDV-XS12 LD100濃度。 如圖4a 所示,口服攻毒1 d 與對照組相比,所有受試動物采食人工乳量均大幅提高(P<0.01),其中,有6 頭仔豬達到147.6 mL∕d。 24 h排泄量雖然也相應升高(P<0.01),達到80.9 mL∕d,但有5 頭低于該組的均值(圖4 d)。 攻毒2 d 與對照組相比,受試動物的采食量均值雖仍維持在高水平(P<0.01),但平均體重卻沒有增長,且平均24 h 排泄量和平均體溫分別出現增加和下降趨勢(P<0.01),其中平均體溫為36.64 ℃,較對照組體溫下降1.2 ℃(圖4c—d)。 攻毒后3—7 d,受試動物進入感染的臨床明顯期,受試動物的各體征指標波動較大,死亡頭數增加。 其中,隨著攻毒后時間的延續,其平均采食量與平均24 h 排泄量呈負相關,與平均體重和平均體溫趨勢分別呈正相關。
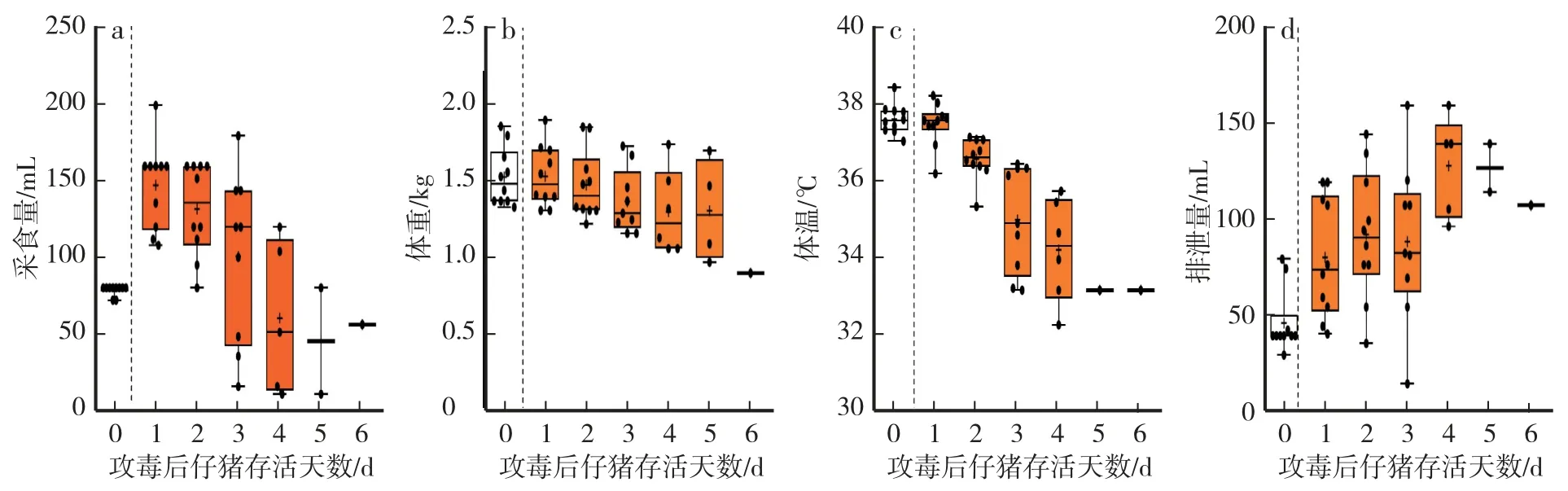
圖4 仔豬PEDV-XS12 LD100的體征指標Fig.4 Physiological parameters of piglets challenged with 1 dosage of LD100 of PEDV-XS12
截至第6 天,所有受試動物100%死亡,PEDV-XS12 LD50死亡時間為59—133.5 h,平均死亡時間為83 h。
2.3.2 PEDV-XS12 LD0對仔豬的影響
PEDV-XS12 LD100的合理濃度為 200 copies∕mL,本組別以上述濃度的 1∕10(20 copies∕mL)、5 mL∕kg 的劑量對受試動物口服攻毒。 通過動態監測受試動物的采食量、體重、體溫、24 h 排泄量、死亡頭數體征指標,初步判斷PEDV-XS12 LD0濃度。 口服攻毒后1 d,平均體溫為38.7 ℃,較對照組升高0.6 ℃,而平均24 h 排泄量則與對照組持平(P>0.05),并且數據離散度小于PEDV-XS12 LD100(圖5c—d)。 采食方面,該組平均采食量于攻毒后3 d 達到峰值(222.75 mL∕d)。 攻毒期間,受試動物僅在攻毒后2—3 d 分別出現死亡。 由于多數受試動物存活,因此平均24 h 排泄量在攻毒后7 d 達到峰值。
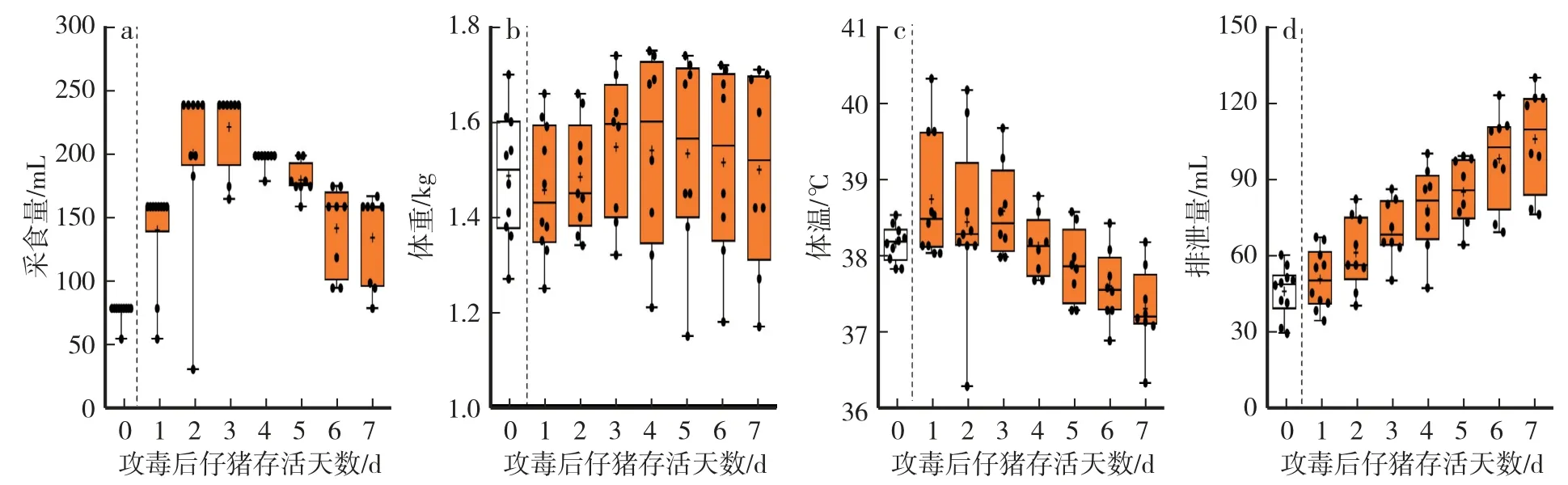
圖5 仔豬PEDV-XS12 LD0 的體征指標Fig.5 Physiological parameters of piglets challenged with 1 dosage of LD0 of PEDV-XS12
截至試驗結束,8 頭仔豬存活。 據此,PEDV-XS12 LD0死亡時間為48—72 h,平均死亡時間為56.75 h。
2.3.3 PEDV-XS12 LD80對仔豬的影響
依據PEDV-XS12 LD100和PEDV-XS12 LD0的濃度,并結合組別計算出平均i=0.63,得到PEDV-XS12 LD80的合理濃度為126 copies∕mL、5 mL∕kg 的劑量,進一步判斷 PEDV-XS12 LD80濃度。 口服攻毒后1 d,受試動物所有體征指標均升高,平均體重和平均體溫直接達到峰值(圖6b—c)。 攻毒后2 d,受試動物平均采食量達到峰值(120 mL∕d)。 至此,除平均24 h 排泄量以外,平均采食量、體重和體溫均呈下降趨勢(圖6d),其中平均體溫為37.9 ℃,較對照組下降0.6 ℃,較攻毒后1 d 平均體溫下降1.1 ℃。 通過與PEDVXS12 LD100相關體征指標對比發現,兩組的平均體重、體溫均在攻毒后1 d 達到峰值,此后二者均呈下降趨勢。 表明高濃度PEDV-XS12 的致病力可能與受試動物的體重與體溫存在相關性。
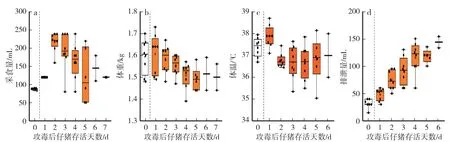
圖6 仔豬PEDV-XS12 LD80的體征指標Fig.6 Physiological parameters of piglets challenged with 1 dosage of LD80 of PEDV-XS12
截至試驗結束,受試動物死亡6 頭,PEDV-XS12 LD80死亡時間為96—120 h,平均死亡時間為118.2 h。
2.3.4 PEDV-XS12 LD60對仔豬的影響
通過i=0.63 所得出的PEDV-XS12 LD80死亡頭數少于PEDV-XS12 LD100。 因此,繼續通過相同的i算出 PEDV-XS12 LD60的合理濃度,即 79 copies∕mL、5 mL∕kg 的劑量,進而判斷 PEDV-XS12 LD60的濃度。 口服攻毒后1 d,受試動物平均采食量迅速增加(P<0.01),達到160 mL∕d(圖7a),平均體重、體溫均達到峰值(圖7b—c),其中平均體溫為37.6 ℃。 隨后,受試動物平均采食量不斷升高,并于攻毒后6 d 達到峰值(240 mL∕d)。
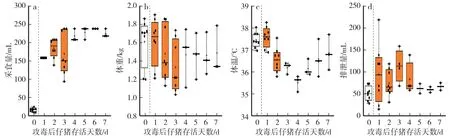
圖7 仔豬PEDV-XS12 LD60的體征指標Fig.7 Physiological parameters of piglets challenged with 1 dosage of LD60 of PEDV-XS12
截至攻毒后7 d,共5 頭受試動物死亡,PEDV-XS12 LD60死亡時間為33—106 h,平均死亡時間為60.1 h。
2.3.5 PEDV-XS12 LD40對仔豬的影響
通過i=0.63,計算出PEDV-XS12 LD40的合理濃度為50 copies∕mL、5 mL∕kg 的劑量,繼續對受試動物口服攻毒,通過監測受試動物的采食量、體重、體溫、24 h 排泄量、死亡頭數體征指標,判斷PEDV-XS12 LD40的劑量。 受試動物在口服攻毒前,各體征指標正常。 口服攻毒1 d 時,受試動物的平均采食量顯著提高(160 mL∕d) (P<0.01) (圖8a)。 受試動物平均采食量在攻毒后 6 d 達到峰值(252 mL∕d),該指標與平均24 h 排泄量的趨勢一致(呈正相關),與試驗時間呈負相關(圖8a—d)。 與之相反,平均體重與體溫呈下降趨勢,與試驗時間呈負相關。
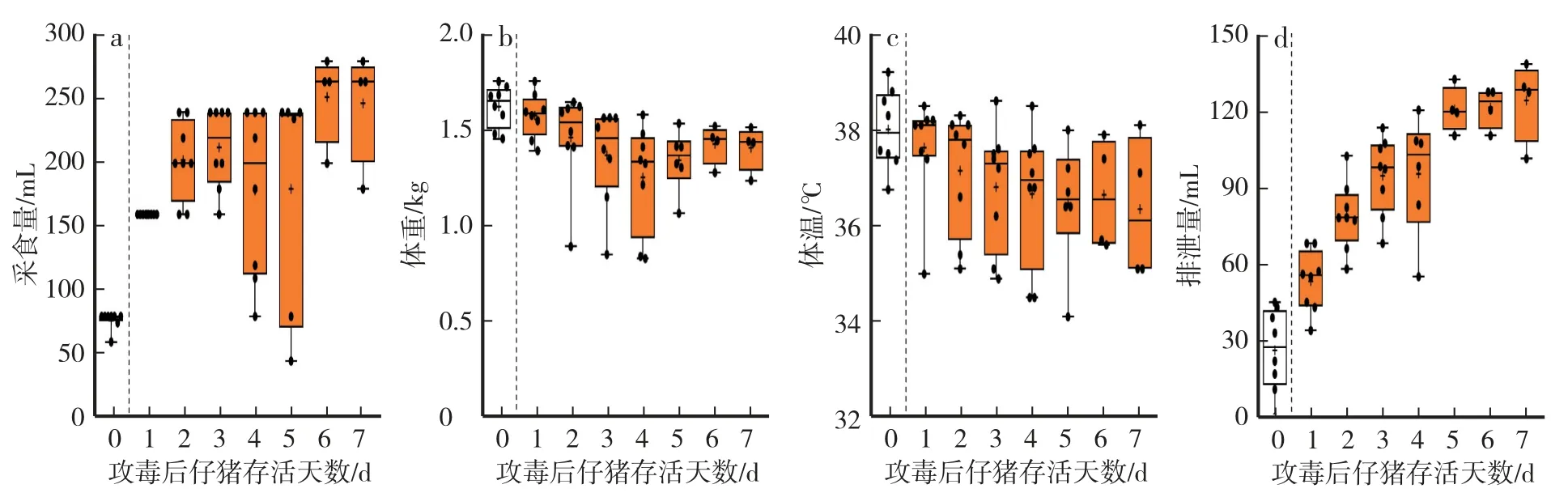
圖8 仔豬PEDV-XS12 LD40的體征指標Fig.8 Physiological parameters of piglets challenged with 1 dosage of LD40 of PEDV-XS12
試驗結束時,受試動物共死亡4 頭,攻毒后平均48 h 進入臨床明顯期,PEDV-XS12 LD40死亡時間為42—130.5 h,平均死亡時間為73.1 h。2.3.6 PEDV-XS12 LD20對仔豬的影響
通過i=0.63,計算出 PEDV-XS12 LD20的合理濃度為31 copies∕mL、5 mL∕kg 的劑量。 對受試動物口服攻毒,最后判斷PEDV-XS12 LD20的劑量。 攻毒48 h 內,受試動物的平均采食量基本持平(P>0.05),在攻毒3 d 時達到峰值(211.43 mL∕d) (圖9a—b)。 隨后 4 d,平均采食量保持在 200 mL∕d。 攻毒期間,該組平均體重、體溫趨勢保持一致,與時間呈負相關。 平均24 h 排泄量與其余各組趨勢基本一致,表明腹瀉的程度可能與感染后受試動物的死亡時間有關。
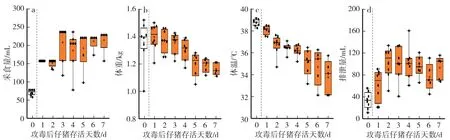
圖9 仔豬PEDV-XS12 LD20的體征指標Fig.9 Physiological parameters of piglets challenged with 1 dosage of LD20 of PEDV-XS12
試驗結束時,共3 頭受試動物死亡。
2.3.7 PEDV-XS12 LD50結果
各組受試動物死亡率分別是:LD100=10∕10、LD80=6∕10、LD60=5∕10、LD40=4∕10、LD20=3∕10、LD0=2∕10。 采用改進寇氏法和Bliss 法,將上述各組的死亡頭數、總頭數進行回歸分析。 最終,得到PEDV-XS12 LD50為48.044 copies∕mL,95%置信區間為29.053—72.071,i=0.63。 該結果符合正態分布。
3 討論
PED 作為一種高發病率、高死亡率的接觸性腸道傳染疾病[4],對我國大陸地區生豬養殖業造成巨大危害。 對妊娠母豬進行免疫,提高其泌乳期乳汁中特異性抗體的含量,增強哺乳仔豬被動免疫效果,方可控制PED 疫情。 然而,因受技術原理以及研制過程等多方面影響,新疫苗效果是未知的,臨床應用前需要經過嚴格的動物模型來評價。 因當前沒有PEDV 流行強毒株的LD50數據,尚無通用的PEDV 攻毒模型,這給新疫苗研制和評價造成技術障礙。
為了填補該研究的空白,本研究選用父本為杜洛克,母本為長白∕大白所繁育的3 d 未吃初乳的三元雜仔豬為實驗動物,通過口服途徑以5 mL∕kg 的PEDV-XS12 灌服,進行LD50模型的測定。 目前,我國大部分豬場均存在PEDV 感染的現象,感染原因除與生豬養殖密度高、養殖技術欠發達等有關外,PEDV 在臨床上的致病力也是重要因素之一。 本試驗結果表明,PEDV-XS12 只需要48 copies∕mL,5 mL∕kg 的劑量即可導致平均體重1.5 kg 的人工哺乳仔豬發病死亡過半,該結果間接反映出我國的PEDV 仍屬于強流行毒株的范疇,提示飼養人員應全面加強母豬在妊娠后期的產房消毒工作。 腹瀉是PED 的主要臨床癥狀,在我國大陸地區,PED 患病豬只除符合PEDV 感染特點外,其體內往往含有其他腸道病毒,比如:TGEV、PDCoV 和PRV,形成符合感染。 因此,除平均排泄量指標外,本研究還對受試動物的平均采食量、體重、體溫等進行24 h 動態監測。 在平均排泄量方面,用一定劑量(LD40、LD20、LD0)的PEDV-XS12 感染受試動物后,雖然試驗周期內的排泄量總體下降,每日排泄量增加趨勢緩慢,但不同劑量組間的平均排泄量卻沒有相關性,說明僅憑腹瀉量單個指標并不能準確反映出患病豬只的感染程度和預后。 在臨床中,采食量是飼養人員評判動物生理機能是否健康的主要標準之一,在發現動物采食量下降時,其疾病早已進入臨床明顯期,這對預防 PED 極為不利。 受試動物感染 PEDV-XS12 期間,采食量(LD80、LD60、LD40、LD20、LD0)遠高于對照組,除了排泄量以外,其他指標均與PEDV-XS12 載量和時間呈負相關。 由于PEDV-XS12 主要侵襲小腸部位,受試動物仍有食欲,因此采食量與排泄量呈正相關。 本研究根據臨床觀察發現,體溫是判斷受試動物是否感染PEDV-XS12 的主要指標,再結合體重與糞便形態指標,可以準確判斷出感染階段是前驅期還是臨床明顯期,這對仔豬感染PED 后的臨床判斷具有重要的指導作用。
研究者從不同角度對LD50的測算方法進行設計與改進,截至目前,針對不同受試物質和受試對象,LD50的測算方法多達十幾種[26,28-31]。 LD50的計算方法分為兩類:一類是傳統方法,比如霍恩氏法、寇氏法、改進寇氏法、Bliss 法等;另一類則是改進方法,比如UDP、FDP 等[32-33]。 盡管LD50測算方法經過幾十年研究已有許多重要進展,但目前還無法提出一種任何條件下都能令人滿意的方法。 因此,本研究首先采用UDP 對PEDV-XS12 LD100進行估算。 UDP 又被稱為序貫法,是由Dixon 和Mood 于1948 年首次提出,后經Bruce 利用優選法對其進行了改進[34],即以受試動物死亡為目的,用最少的受試動物測算出LD100。 本試驗首先針對受試動物隨機設計多個劑量點,每次只攻毒1 頭仔豬。 然后,根據攻毒后仔豬的反應決定下一個攻毒劑量。 若仔豬存活,攻毒劑量則提高,若仔豬出現死亡或瀕死,攻毒劑量則降低。 最后,逐漸縮小病毒濃度范圍,進行正式試驗的驗證。 在測算PEDV-XS12 LD0時,本研究采用FDP。 FDP 是1984 年由英國毒理協會提出的[35],與UDP 不同的是,該方法設有固定劑量和多個組別,并且不以受試動物死亡為目的,而是以攻毒后受試動物的毒性癥狀來判斷受試物質的毒力。 FDP 分為預試驗和正式試驗兩部分。本研究在預試驗中,對PEDV-XS12 LD100病毒原液進行倍比稀釋,各劑量組別分別攻毒1 頭仔豬,并觀察攻毒后仔豬發病癥狀,用以篩選出既有毒性又不死亡的候選劑量。 正式試驗則用候選劑量對仔豬攻毒,每個候選劑量組有4 頭仔豬,攻毒后7 d 內無仔豬死亡的劑量即為PEDV-XS12 LD0。
為了求出PEDV-XS12 對仔豬的 LD50,對其設置了4 個濃度組,并通過 PEDV-XS12 LD100和 PEDVXS12 LD0的病毒載量計算出i,即兩組病毒載量之間的比值,并根據i調整各組攻毒劑量。 在分組方面,采用了改進寇氏法,即在試驗設計中同時滿足以下四種條件:最低劑量組的反應率≤20%,最高劑量組≥80%;反應率大致呈正態分布;劑量必須按等比級數分布;各組受試動物數量相等[36]。 最后,通過Bliss 法對攻毒7 d 后,各組仔豬總頭數、仔豬存活頭數和死亡頭數進行回歸分析,得到最終的PEDV-XS12 LD50為48.044 copies∕mL。 Bliss 法又稱加權幾率單位法,利用對數劑量與反應率的轉換數呈直線關系而設計,通過對幾率單位期望值的反復校正及加權處理,求出回歸直線方程。 在眾多LD50計算方法中,該方法最為精確、可靠,可以獲得LD5—LD95全部參數[37-41];同時,該方法也是新藥審批辦法中所推薦使用的。

