鼻咽癌自適應放療中應用RegGAN模型將錐形束CT圖像轉換為偽CT圖像的可行性▲
劉 培 朱超華 孔令軻 廖超龍 陸合明
(1 右江民族醫學院,廣西百色市 533000,電子郵箱:1095839675@qq.com;2 廣西壯族自治區人民醫院放療科,南寧市 530021;3 Manteia數據科技有限公司,福建省廈門市 361008)
在鼻咽癌調強放療的過程中,一般需要完成30~35次的放射治療,共需要6~7周。其間患者的體型和腫瘤組織可能會發生較大的變化,這可影響精確放療的實施,而自適應放療是較為推薦的一種解決方案[1]。然而,就目前的技術方案,自適應放療需要重新進行CT定位、靶區勾畫和放療計劃設計,耗時較長。錐形束CT(cone beam CT,CBCT)通常用于調強放療前的圖像引導和位置校正,但是CBCT與計劃CT的CT值存在差異,不能直接用于放療計劃的設計[2]。如果能夠將CBCT轉換成精確的偽CT,利用此圖像在線評估多次治療后患者的劑量,乃至直接調整放療計劃,將使得在線自適應放療成為可能[3]。本研究采用基于配準對抗神經網絡的RegGAN模型[4],將CBCT圖像轉換為偽CT圖像,并對圖像質量進行評估,探討將該圖像作為鼻咽癌自適應放療參考圖像的可行性。
1 資料與方法
1.1 臨床資料 納入2020年3~5月在廣西壯族自治區人民醫院完成放射治療的60例鼻咽癌患者。納入標準:(1)經病理證實為鼻咽未分化非角化型癌;(2)根據美國癌癥聯合委員會第8版分期標準[5],分期為T1~T4期;(3)鼻咽癌初治患者。排除標準:臨床信息、放療影像和隨訪記錄的數據不全,或者失訪。回顧60例患者第1次用于圖像引導放療的CBCT圖像和計劃CT圖像,其中47例作為訓練集,13例作為測試集。訓練集中男性30例、女性17例,年齡29~75(51.47±12.0)歲;測試集中男性11例、女性2例,年齡41~72(54±10.47)歲。
1.2 CT圖像掃描 使用西門子大孔徑CT模擬定位機(型號:SOMATOM Sensation Open)進行掃描。患者取仰臥位,用熱塑面膜固定患者頭頸肩,掃描范圍從顱頂至胸骨角水平。掃描參數如下:120 kV,250 mAs,視野 500 mm×500 mm,層厚2 mm。予患者注射碘克沙醇造影劑95 mL延遲55 s后行圖像采集。使用Elekta Synergy 醫用直線加速器上的XVI影像系統采集CBCT圖像,參數設置如下:掃描起始-終止角度為320°~160°,電壓100 kV,366幀,總電流36.6 mAs,準直器S20,過濾器F0,轉換為層厚2 mm的斷層CT。
1.3 圖像數據預處理 (1)圖像CT值范圍處理:CBCT和計劃CT的CT值在骨密度較高的部分和某些較低的部分容易出現分布不匹配,這種圖像的體素分布會影響訓練的結果。因此,需要對數據先進行裁剪,將CBCT和計劃CT的CT值裁剪到-1 000~800 HU范圍內,以防止部分骨頭的超高CT值對訓練產生影響,然后歸一化到[-1,1]。(2)CBCT和計劃CT圖像尺寸大小的匹配:本研究中采集的CBCT圖像尺寸大小為[270,270],計劃CT圖像尺寸大小為[512,512],這導致圖像在空間位置上沒辦法對齊,無法進行訓練和測試。因此,通過重新采樣的方式來改變CBCT和CT的空間尺寸,將兩種圖像尺寸縮放到一致的尺寸[270,270],如圖1所示。
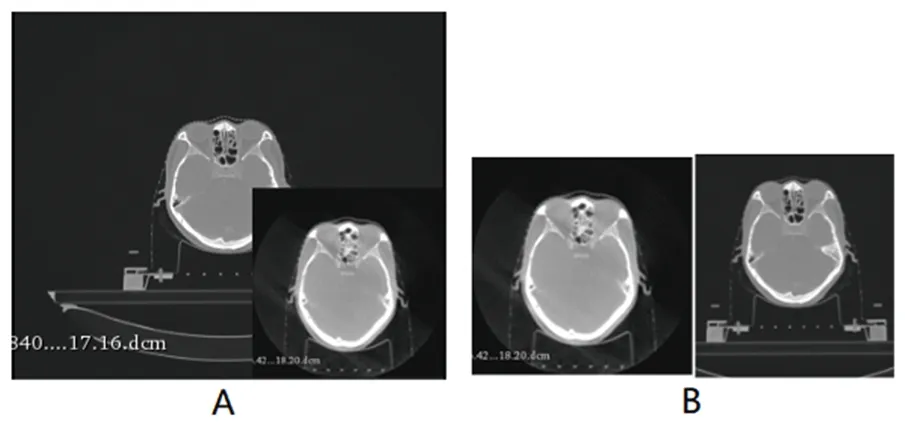
圖1 重新采樣前后的CBCT和計劃CT圖像注:A為原始的CBCT和計劃CT圖像;B為重新采樣后的CBCT和計劃CT圖像
具體的圖像轉換流程如圖2所示。
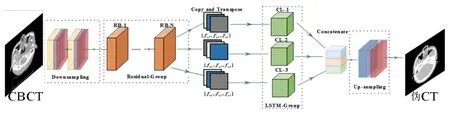
圖2 圖像轉換流程
1.5 模型結構與訓練 為了評估RegGAN圖像轉換模型精度,選用Pix2Pix模型[6]和Cycle-consistency[7]模型作為參考模型,在相同的訓練集上進行模型訓練,并使用同組測試集進行圖像轉換。為了提高對比的有效性,均采用相同的生成器和辨別器,對同批數據進行了模型訓練。3種轉換模型的網絡結構如圖3所示。
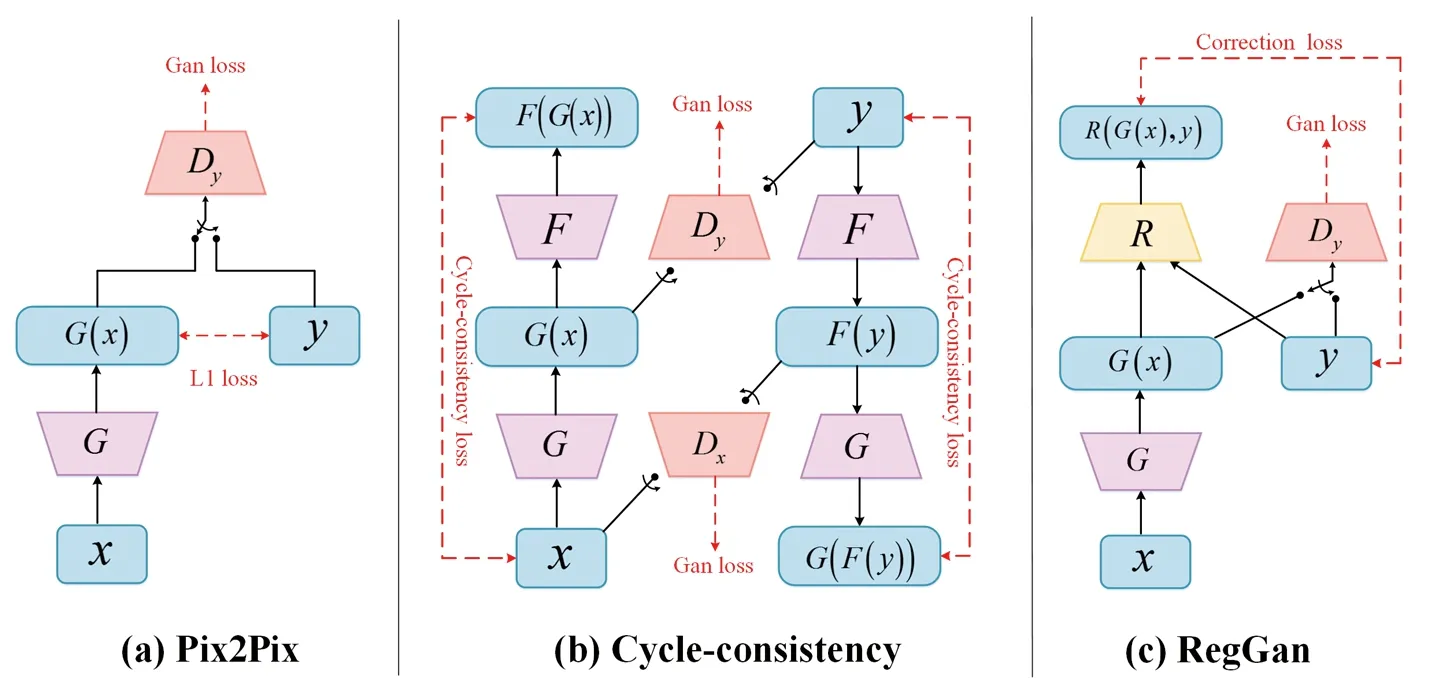
圖3 Pix2Pix、Cycle-consistency和RegGan 3種圖像轉換模型的網絡結構
1.6 圖像轉換精度的評價指標 在測試集上,針對3種模型使用相同的訓練策略和超參數獲得偽CT圖像。采用平均絕對誤差(mean absolute error,MAE)、峰值信噪比(peak signal-to-noise ratio,PSNR)和結構相似性(structural similarity,SSIM)來評價圖像轉換精度(轉換圖像質量)。
1.7 統計學分析 采用SPSS19.0進行統計學處理。計量資料以(x±s)表示,采用Levene法檢驗組間方差齊性,再采用方差分析檢驗各組樣本之間是否存在差異,事后多重比較選用Bonferroni法,以P<0.05表示差異具有統計學意義。
2 結 果
2.1 3種模型生成的偽CT圖像質量的比較 由于本身數據存在未對齊的噪聲,因此Pix2Pix模型在生成結果時出現高密度區域信息丟失,并且其生成的偽CT與計劃CT之間的CT值分布差別較大;Cycle-consistency模型屬于無監督方法,偽CT與計劃CT的差異表現為在邊界和CT值陡降區域產生失真;RegGAN所呈現的結果最好,具體表現在生成出來的偽CT圖像具備更多的紋理細節信息。3種模型最終轉換的偽CT圖像細節如圖4所示。
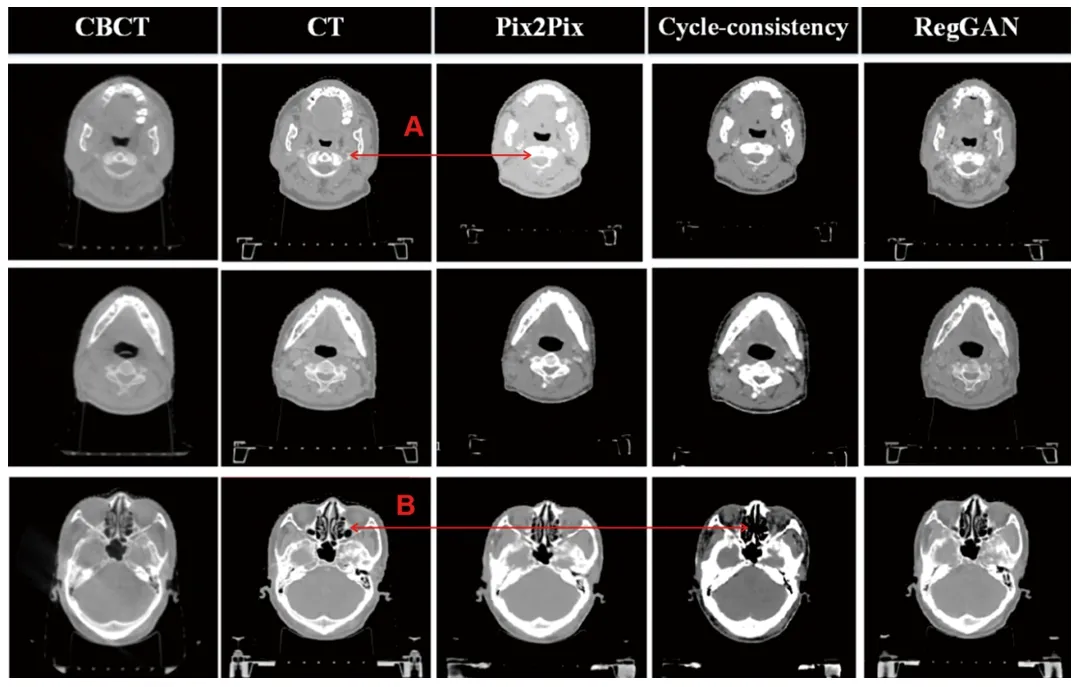
圖4 原始CBCT、計劃CT、Pix2Pix模型、Cycle-consistency模型、RegGAN模型生成的偽CT圖像質量對比注:Pix2Pix模型轉換的偽CT和計劃CT的差異表現為所示高密度區域信息丟失(A);Cycle-consistency模型轉換的偽CT和計劃CT的差異表現為所示在邊界和CT值陡降區域產生失真(B)。
2.2 3種模型的圖像轉換精度的比較 在13例病例的測試數據集中,分別使用MAE、PSNR和SSIM指標,對圖像轉換精度進行評價。3種轉換模型的MAE、PSNR和SSIM指標比較,差異具有統計學意義(均P<0.05),其中RegGAN模型的MAE最小,PSNR和SSIM最大(均P<0.05),見表1。

表1 3種轉換模型的MAE、PSNR、SSIM的比較(x±s)
3 討 論
實現在線自適應放療是當前關注的熱點,目前已經有多項研究將多模態影像應用于自適應放療中。例如,亓孟科等[8]探討了基于MRI圖像的在線偽CT生成方案。但是由于成像時間長、價格昂貴等特性,MRI圖像引導放療的使用范圍受到限制[9]。當前主流的方案是,采用CBCT圖像引導放療[10]。采用合適的方法將CBCT圖像轉換為偽CT,應用于自適應放療,則是當前研究的熱點之一[10-11]。
基于深度學習的CBCT圖像轉換為偽CT,是常用的方案[12-13]。但通常會面臨一些困境:有監督的深度學習訓練的前提是CBCT和計劃CT在空間中每個體素都需要對齊,但成像的時差、擺位誤差、患者的呼吸運動等因素會導致很難獲得真正意義上的每個體素完全對齊的數據[11]。而無監督的深度學習對數據的要求會降低,同時生成圖像的質量也會降低。因此本研究探討了一種新的深度學習方法—配準對抗神經網絡,其既可以降低對數據對齊程度的要求還可以保持高質量的生成結果。
基于有監督的Pix2Pix模型[6]和基于無監督的Cycle-consistency模型[7]是目前主要的兩種多模態圖像轉換模型,但是兩者在實際應用中都不夠理想,Pix2Pix模型雖然有著杰出的性能,但對于數據的依賴程度較高,它的訓練有賴于成對且體素對齊的數據,而由于解剖結構的變化,難獲得這種理想的數據。而Cycle-consistency模型雖然可以很好地作用在未對齊的數據上,但因為其在訓練過程中存在最優解不唯一的問題會導致訓練不穩定,應用于臨床中可出現不確定性。
本研究引入的基于配準對抗神經網絡的圖像轉換模型RegGAN[4],它將生成器與一個額外的配準網絡進行聯合訓練來自適應擬合未對齊的體素分布,從而尋找出圖像生成和圖像配準任務的共同的最優目標解,通過這種方式顯著提升了圖像的轉換質量。本研究結果顯示,3種轉換模型中,RegGAN模型的MAE最小,PSNR和SSIM最大(均P<0.05),這說明與Pix2Pix和Cycle-consistency模型相比,經RegGAN模型轉換的偽CT具有更好的圖像質量。全科潤等[14]利用39例鼻咽癌患者進行Cycle-consistency模型訓練,對9例患者的CBCT圖像進行轉換驗證后發現,該模型能有效地修正 CBCT 圖像的CT值,轉換生成的偽CT圖像的CT值和平滑度與計劃CT相似,可應用于劑量計算。而RegGAN模型圖像轉換精度優于Cycle-consistency模型,因此可以預見CBCT圖像的RegGAN模型轉換會有更高的Gamma 驗證通過率。
雖然本研究提出的圖像轉換模型可較為精確地將CBCT圖像轉換為偽CT,但是仍然存在以下幾個方面的問題:(1)轉換圖像尺寸。本研究采集的CBCT圖像大小為[270,270],為保證圖像尺寸的一致,將計劃CT圖像大小降低了一半,導致信息的丟失。下一步的工作考慮增加CBCT圖像的采集尺寸,以期獲得更詳細的影像信息。(2)圖像質量評價。與當前較常用Pix2Pix和Cycle-consistency模型相比,RegGAN轉換模型在圖像轉換質量方面具有一定的優勢,但是并未經過實際放療劑量學的對比,在臨床效用方面還需要進一步驗證[15]。在今后的研究中,將在轉換所得到的偽CT圖像上進行劑量分布對照分析,通過Gamma 驗證通過率和劑量學對比,評估RegGAN模型轉換為偽CT在實際應用中的可行性。
綜上所述,將鼻咽癌患者的CBCT圖像轉換為偽CT圖像時,RegGAN模型在轉換圖像的質量方面具有較大的優勢,初步滿足劑量計算的要求。這為將CBCT圖像轉換為偽CT圖像以作為鼻咽癌自適應放療的參考圖像奠定了基礎。

