1例PD-1抑制劑致多內分泌腺綜合征的不良反應分析
談儀炯,方芳,劉芳*,王育璠*(.上海交通大學附屬第一人民醫院臨床藥學科,上海 00080;.上海交通大學附屬第一人民醫院內分泌代謝科,上海 00080)
程序性死亡受體1(PD-1)抑制劑是一種免疫檢查點抑制劑(immune checkpoint inhibitor,ICI)。隨著臨床研究的深入,PD-1抑制劑的運用越來越廣泛,目前已經在黑素瘤、腎細胞癌、非小細胞肺癌、頭頸部癌、尿路上皮癌、霍奇金淋巴瘤等多種腫瘤中顯示了良好的療效。然而這類藥物在調控免疫應答殺傷腫瘤的同時也會使免疫細胞過度活化,導致皮膚、胃腸、肝臟、內分泌等多個系統受累[1-2],引起免疫相關不良反應(immune-related adverse events,irAEs)。目前,國內PD-1抑制劑致多內分泌腺綜合征的不良反應報道較少,本文通過對1例應用 PD-1 抑制劑后出現1型糖尿病和甲狀腺功能減退的病例進行分析討論,提高臨床對該類不良反應的認識,保證患者用藥安全。
1 病例資料
患者,男,68歲,2017年3月體檢發現左鎖骨上淋巴結,病理提示轉移分化差的癌可能。其后多次PET-CT提示右肺中葉、下葉肺門區腫塊伴葡萄糖代謝增高,全身多發轉移性淋巴結。分別 于2019年5月17日、6月7日、7月7日、7月31日、8月23日、9月26日、11月26日行信迪利單抗200 mg(廠家:信達生物制藥有限公司,批號:P1908015)聯合白蛋白型紫杉醇300 mg治療(共計7次),治療期間未出現明顯不良反應。患者分別于2020年8月2日、9月15日、10月29日、12月22日及2021年1月12日行信迪利單抗200 mg(批號:P2006018)聯合安羅替尼10 mg治療。患者訴2020年11月30日出現口干癥狀,12月1日至門診就診,查糖化血紅蛋白(HbA1c)5.7%,微量法空腹血糖(FBG)5.46 mmol·L-1。血清游離三碘甲腺原氨酸(FT3)1.27 pmol·L-1,血清游離甲狀腺素(FT4)4.12 pmol·L-1,血清促甲狀腺激素(TSH)61.5 uIU·mL-1。促甲狀腺激素受體抗體(TRAb)、甲狀腺球蛋白抗體(TGAb)、甲狀腺過氧化物酶抗體(TPOAb)均陰性。予左甲狀腺素片75 μg qd替代治療。2021年1月15日,患者口干癥狀明顯加重,伴有多飲多尿,查FBG 17.7 mmol·L-1↑,考慮為藥物引起的自身免疫反應,暫停信迪利單抗及安羅替尼治療。2月2日門診查FBG 17.2 mmol·L-1↑,予德谷胰島素14 U皮下注射控制血糖,2月3日改為德谷胰島素早18 U-晚12 U皮下注射,為求進一步治療,2月4日收住內分泌科病房,入院隨機血糖為9.2 mmol·L-1。患者既往患有高脂血癥20余年,口服非諾貝特降脂治療,近兩年停用,未予復查。確認家族腫瘤史,父親因直腸癌去世,母親因淋巴癌去世。
體格檢查:體溫36.4℃,心率80次·min-1,呼吸18次·min-1,血壓146/99 mmHg(1 mmHg=0.133 kPa)。身高162 cm,體質量55 kg,體質指數21 kg·m-2。神志清楚,回答切題,全身皮膚黏膜未見異常,無肝掌,全身淺表淋巴結無腫大。余未見明顯異常。
入院后(2月4日)行實驗室及影像學檢查,血常規:白細胞數 3.31×109·L-1↓,中性粒細胞 2.25×109·L-1,血 紅 蛋 白 122.0 g·L-1↓,血小板總數 153×109·L-1。甲狀腺功能:FT3 3.88 pmol·L-1↓,FT4 11.21 pmol·L-1↓,TSH 39.04 uIU·mL-1,TRAb、TGAb、TPOAb均 陰 性。性激素:促黃體生成素(LH)12.78 IU·L-1↑,促卵泡生成激素(FSH)23.48 IU·L-1↑,孕酮0.85 ng·mL-1,雌二醇23.46 pg·mL-1,血清泌乳素4.21 ng·mL-1,睪酮411.52 ng·dL-1。饅頭餐試驗結果見表1。HbA1c 8.8%↑,胰島細胞抗體(ICA)41.5 IU·mL-1↑(參考范圍0~20 IU·mL-1),胰島素自身抗體(IAA)及谷氨酸脫羧酶抗體(GADA)均陰性。尿白蛋白/尿肌酐83.82 μg·mg-1↑。腎上腺功能正常,余未見明顯異常。
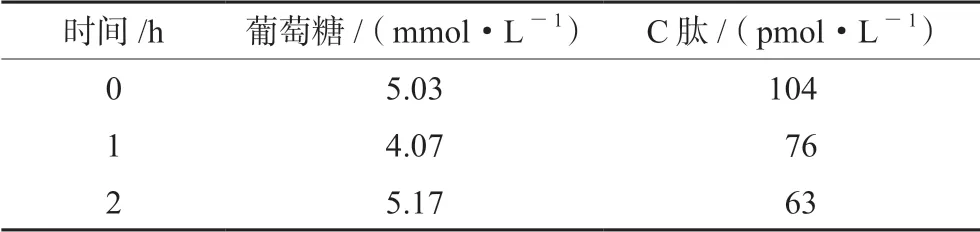
表1 饅頭餐試驗
診療經過:入院后完善相關檢查,結合病史及胰島細胞功能及胰島相關抗體,考慮診斷為其他類型糖尿病。入院后更換治療方案為阿卡波糖100 mg tid口服聯合門冬胰島素4U-3U-3U三餐前皮下注射、德谷胰島素12 U睡前皮下注射。空腹血糖波動在5.4~8 mmol·L-1,餐后血糖波動在6.8~10 mmol·L-1。入院后完善糖尿病并發癥檢查,患者24 h尿生化提示微量蛋白尿,24 h尿蛋白總量0.38 g,血肌酐正常,結合患者眼底正常,考慮糖尿病為PD-1抑制劑引起可能大。患者數月前出現甲狀腺功能減退,入院時每日服用左甲狀腺素片75 μg,本次入院TSH 39.04 uIU·mL-1↑,加量至125 μg qd替代治療。出院后3月5日復查FT3 4.93 pmol·L-1,FT4 13.64 pmol·L-1,TSH 5.77 uIU·mL-1,甲狀腺功能基本恢復正常,血糖控制平穩,繼續予阿卡波糖100 mg tid聯合胰島素皮下強化治療。
2 討論
2.1 不良反應相關性分析
PD-1抑制劑引起的irAEs可能累及多個內分泌系統,包括甲狀腺、腎上腺、垂體及胰腺內分泌等。其中累及甲狀腺系統的最為常見[3-4]。本病例中患者在使用信迪利單抗數個療程后(半年左右)多個內分泌腺受到影響,主要表現為嚴重的甲狀腺功能減退和血糖的異常升高。使用諾氏評估量表對藥品不良反應關聯性進行評價,評分為7分,關聯性為很可能有關,具體評分見表2。
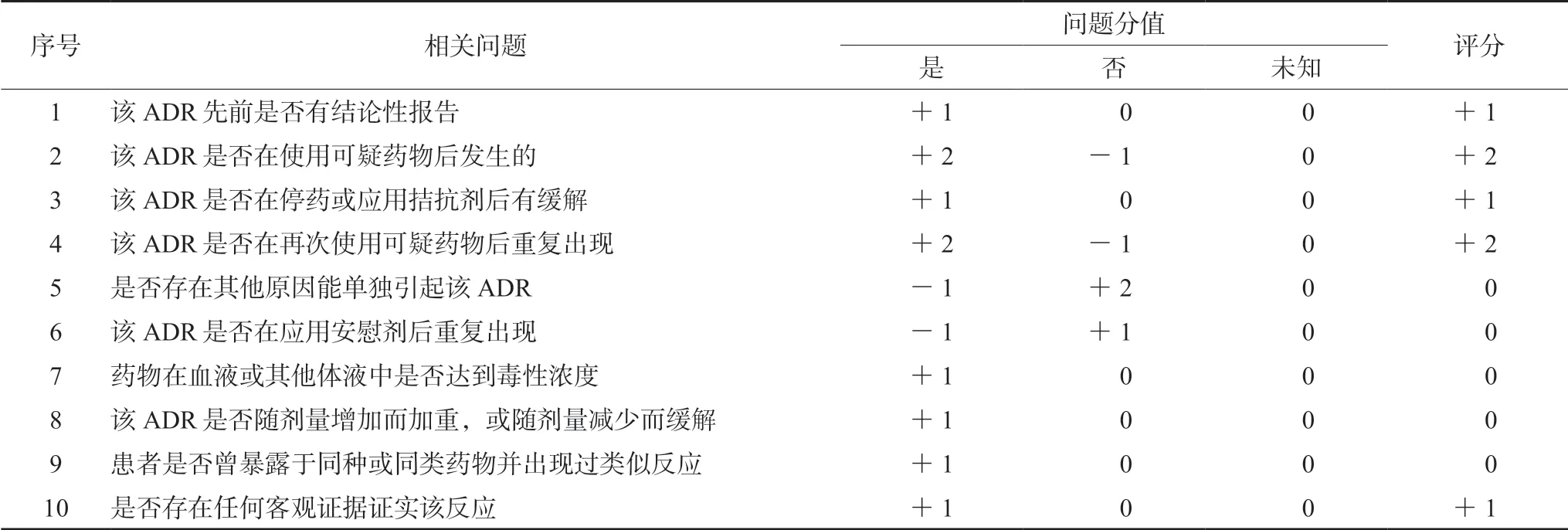
表2 諾氏藥品不良反應評估量表
2.2 PD-1抑制劑引起的甲狀腺疾病
本例患者在使用PD-1抑制劑后出現了嚴重的甲狀腺功能減退,最終使用每日125 μg左甲狀腺素片替代治療。接受免疫治療后的患者易發生甲狀腺功能的異常,包括甲狀腺功能亢進、甲狀腺功能減退以及甲狀腺炎[5-6]。相關文獻報道,這些疾病的發生可能與藥物對甲狀腺的破壞有關[7]。程序性死亡受體-配體1(1PD-L1)除了在腫瘤細胞表面高表達外,在甲狀腺等其他組織中也有一定的表達,PD-L1的存在抑制了T細胞的過度表達,起到了免疫抑制的重要作用。PD-1抑制劑在治療腫瘤的同時,甲狀腺等正常外周組織的 PD-1/PD-L1 信號通路同樣被阻斷,此時的T細胞過度表達導致了免疫失衡,從而出現irAEs[8]。
2.3 PD-1抑制劑引起的1型糖尿病
本例患者在使用PD-1抑制劑半年后出現了明顯的口干癥狀,當時查HbA1c 5.7%。一個半月后口干癥狀明顯加重,伴有多飲多尿,復查空腹血糖為17.7 mmol·L-1,而住院后的饅頭餐試驗結果提示,患者的胰島功能基本衰竭,結合ICA抗體陽性,考慮為PD-1抑制劑引起的1型糖尿病。PD-1抑制劑導致的1型糖尿病與胰島自身抗體的關系并不明確。有文獻報道約半數病例存在胰島自身抗體[9],與抗體陰性者相比胰島自身抗體陽性者發病時間更短,出現糖尿病酮癥酸中毒的比例更高[10]。
PD-1抑制劑相關1型糖尿病發病機制尚不明確。有研究報道某些HLA基因型如HLA-DQ2和HLA-DQ8與1型糖尿病易感性增加有關[11]。同經典的1型糖尿病一樣,PD-1抑制劑引起的1型糖尿病不能逆轉,需要胰島素皮下強化治療,若血糖高引起酮癥酸中毒,則需要小劑量胰島素靜脈滴注,及時糾正電解質紊亂。
2.4 PD-1抑制劑致多內分泌腺綜合征臨床處理及啟示
PD-1抑制劑引起的irAEs 較獨特,主要是對自身組織產生免疫損傷,通常治療中度或重度irAEs需要中斷PD-1抑制劑治療,并使用糖皮質激素進行免疫抑制[12]。但內分泌系統相關的irAEs,如甲狀腺疾病和1型糖尿病一般不需要使用。糖皮質激素為升糖激素,刺激肝糖原異生,抑制外周組織對葡萄糖的攝取和利用,增加肝糖原合成,對胰高糖素、腎上腺素、生長激素的升糖效應有“允許”和“協同”作用。因此對于PD-1抑制劑引起的1型糖尿病,使用糖皮質激素反而會使血糖升高,病情加重。本病例中,患者使用PD-1抑制劑后導致了甲狀腺功能減退和1型糖尿病,考慮為藥物引起的多內分泌腺綜合征。臨床在使用免疫檢查點抑制劑時應注意以下幾點:① 藥物導致一種內分泌腺體損傷時,應考慮其他腺體累及的可能,及時評估其他內分泌腺體;② 使用過程中注意監測血糖和評估甲狀腺功能,必要時對腎上腺功能、性腺功能進行評估;③ 關注患者的臨床癥狀,出現口干、多飲、惡心、乏力、納差等不良反應時應予重視,分析原因并給予及時處理。
3 小結
PD-1抑制劑由于療效良好和不良反應少受到了臨床醫師和患者的青睞,但在使用過程中部分患者也會出現一些irAEs,建議在治療過程中常規監測血糖及甲狀腺功能。盡管PD-1抑制劑導致的1型糖尿病相對少見,但是其進展迅速、病情兇險。若不及時就醫或延誤診治可能危及患者生命。而甲狀腺功能的監測有利于識別PD-1抑制劑引起的甲狀腺疾病,盡早進行干預。

