干擾素λ聯合順鉑介導STAT信號通路對乳腺癌細胞抗增殖作用的研究
彭鑫宇,劉佳妮,楊 陽,李小龍
0 引言
乳腺癌是女性常見的惡性腫瘤之一,其發病率約占全球女性癌癥的24.2%,嚴重威脅女性的生命健康[1]。目前,化療仍是乳腺癌的重要治療方法。順鉑是臨床應用最為廣泛的化療藥物,其通過抑制DNA復制、RNA及蛋白質的合成,破壞腫瘤細胞膜,最終導致腫瘤細胞死亡,抑制腫瘤的發生發展[2]。臨床研究顯示,晚期乳腺癌患者身體基礎差,且順鉑等化療藥物對患者機體影響較大[3]。因此,尋找有效且不良反應較小的治療手段是目前臨床研究的關鍵。干擾素-λ(Interferon-λ,IFN-λ)是Ⅲ型干擾素,其成員包括IFN-λ1、IFN-λ2與IFN-λ3,具有抗病毒、抗增殖、抗腫瘤和免疫調節等功能。李剛等[4]研究發現,IFN-λ與肝癌的發生發展相關;Lasfar等[5]研究顯示,過表達IFN-λ可抑制黑色素瘤細胞轉移。這些研究表明,IFN-λ具有抑癌因子作用。IFN-λ通過激發多級磷酸化并激活酪氨酸激酶2(Tyrosine kinase 2,TYK2)和JAK激酶1(Janus Kinase 1,JAK1)轉導信號,使信號轉導子和轉錄激活子1與2(Signal transducer and activator of transcription 1/2,STAT1/2)的酪氨酸殘基磷酸化,而啟動信號級聯反應,促使干擾素刺激基因3的形成,進入細胞核啟動相應的基因轉錄,從而抑制病毒復制與細胞分裂增殖、產生抗病毒、調節機體免疫等[6]。研究發現,IFN-λ通過激活STAT信號通路發揮其抗腫瘤生物學功能[7-8],提示IFN-λ的抗腫瘤機制與STAT信號通路相關。IFN-λ協同順鉑可抑制食管癌細胞的增殖,提示IFN-λ聯合順鉑可能具有調控腫瘤惡性生物學行為的功能[9]。因此,本研究通過探究IFN-λ聯合順鉑(Cisplatin,CDDP)對乳腺癌細胞增殖、凋亡及周期的影響,闡明IFN-λ聯合CDDP的抗腫瘤機制,以期為IFN-λ在乳腺癌的治療研究提供參考依據。
1 材料與方法
1.1 主要試劑 人乳腺癌細胞系MDA-MB-231購自中國科學院細胞庫;DMEM培養基、胰酶與胎牛血清購自中國賽默飛世爾科技有限公司;CDDP與干擾素-λ購自美國 R&D 公司,BCA蛋白定量試劑盒、蛋白提取試劑盒購自中國康維世紀生物科技有限公司;CCK8試劑盒購自武漢默沙克生物科技有限公司;細胞周期檢測試劑盒與細胞凋亡檢測試劑盒購自碧云天生物科技有限公司;p-STAT1、p-STAT2、STAT1、STAT2及山羊抗鼠二抗購自美國Cell Signaling Technology公司;STAT信號通路抑制劑HY-B0069購自美國MCE公司。
1.2 細胞培養及處理 MDA-MB-231細胞用含10%胎牛血清的DMEM培養基置于37 ℃、5% CO2的培養箱培養。收集對數生長期的MDA-MB-231細胞,進行實驗。實驗分為5組:①對照組:DMEM培養基培養24 h;②干擾素-λ組(IFN-λ組):含干擾素-λ(30 ng/ml)的DMEM培養基培養24 h;③CDDP組:含CDDP(0.3 μM)的DMEM培養基培養24 h;④干擾素-λ+CDDP組(IFN-λ+CDDP組):含干擾素-λ(30 ng/ml)與含CDDP(0.3 μM)的DMEM培養基培養24 h;⑤干擾素-λ+CDDP+HY-B0069組(IFN-λ+CDDP+HY-B0069組):含干擾素-λ(30 ng/ml)、CDDP(0.3 μM)及5 μM的STAT信號通路抑制劑HY-B0069的DMEM培養基培養24 h。
1.3 CCK8法檢測MDA-MB-231細胞的存活率 收集對數生長期的MDA-MB-231細胞,將細胞濃度調整為1.5×103個/100 μl,接種于96孔板內,培養24 h。根據上述分組加入對應藥物,作用于MDA-MB-231細胞,每組均設置3個平行孔,在37 ℃、5%CO2的培養箱培養。取出96孔板,每孔加入 10 μl的CCK-8,37 ℃孵育2 h,于460 nm波長處檢測吸光度值(OD值),以不予任何處理的空白對照組的活力為100%,計算細胞增殖率。
1.4 流式細胞術檢測MDA-MB-231細胞的凋亡與周期變化 將各組MDA-MB-231細胞利用胰酶消化,離心收集于離心管內,將細胞在預冷磷酸鹽緩沖鹽水(PBS)中洗滌2次,避光下加入5 μl FITC annexin V和5 μl碘化丙鈉(PI),靜置15 min,加入400 μl Binding Buffer,混勻后放置于冰上,樣品在1 h內用流式細胞儀檢測細胞凋亡情況。收集各組MDA-MB-231細胞,細胞數目調整為1×106個/ml,PBS洗滌2次,2 500 r/min離心5 min,盡可能去除上清,逐滴加入-20 ℃預冷的70%乙醇1 ml固定細胞,邊加邊振蕩,4 ℃固定30 min以上。使用PBS洗滌2次,2 000 r/min離心5 min,棄上清,加入50 μl 100 μg/ml的RNase,37 ℃孵育30 min,加入200 μl 50 μg/ml的碘化丙啶(PI),充分振蕩,孵育15 min后,使用流式細胞儀檢測分析細胞周期。
1.5 Western blot檢測p-STAT1、p-STAT2、STAT1及STAT2蛋白表達 采用遇冷的含有蛋白酶抑制劑的RIPA緩沖液提取各組MDA-MB-231細胞蛋白,采用BCA蛋白定量試劑盒測定蛋白濃度,具體操作步驟根據說明書進行。SDS-PAGE凝膠電泳分離等量蛋白,濕轉法將凝膠中的蛋白質轉至PVDF膜。5%脫脂牛奶室溫封閉2 h后,于4 ℃下與大鼠抗人抗體p-STAT1、p-STAT2、STAT1及STAT2(1∶1 500)孵育過夜,用TBST洗膜5 min×3次,加入HRP標記的山羊抗鼠二抗(1∶1 000)37 ℃孵育1 h,用TBST洗膜5 min×3次,采用ECL顯影,凝膠成像儀曝光拍照。
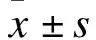
2 結果
2.1 干擾素λ與CDDP對MDA-MB-231細胞的協同抗增殖作用 CCK8法實驗結果顯示,與對照組相比,IFN-λ組、CDDP組和IFN-λ+CDDP組作用MDA-MB-231細胞的存活率顯著降低,差異具有統計學意義(P<0.05);與IFN-λ組和CDDP組相比,IFN-λ+CDDP組MDA-MB-231細胞存活率顯著降低,差異具有統計學意義(P<0.05)。見圖1。

圖1 干擾素λ與CDDP對MDA-MB-231細胞的協同抗增殖作用
2.2 干擾素λ聯合CDDP對MDA-MB-231細胞凋亡的影響 流式細胞術實驗結果顯示,與對照組相比,IFN-λ組、CDDP組及IFN-λ+CDDP組的MDA-MB-231細胞凋亡能力均升高。與IFN-λ組與CDDP組相比,IFN-λ+CDDP組的MDA-MB-231細胞凋亡能力升高。見圖2。

圖2 干擾素λ聯合CDDP對MDA-MB-231細胞凋亡的影響
2.3 干擾素λ聯合CDDP對MDA-MB-231細胞周期的影響 流式細胞術實驗結果顯示,與對照組相比,IFN-λ組、CDDP組及IFN-λ+CDDP組的MDA-MB-231細胞G1期占比升高;與IFN-λ組和CDDP組相比,IFN-λ+CDDP組MDA-MB-231細胞G1期占比升高。見圖3。

圖3 干擾素λ聯合CDDP對MDA-MB-231細胞周期的影響
2.4 干擾素λ聯合CDDP對MDA-MB-231細胞STAT信號通路的影響 Western blot實驗結果顯示,與對照組相比,IFN-λ組、CDDP組及IFN-λ+CDDP組MDA-MB-231細胞的p-STAT1與p-STAT2蛋白表達升高,差異具有統計學意義(P<0.05);與IFN-λ組和CDDP組相比,IFN-λ+CDDP組MDA-MB-231細胞的p-STAT1與p-STAT2蛋白表達升高,差異具有統計學意義(P<0.05)。見圖4。

圖4 干擾素λ聯合CDDP對MDA-MB-231細胞STAT信號通路的影響
2.5 STAT信號通路抑制劑HY-B0069對干擾素λ聯合CDDP作用MDA-MB-231細胞的影響 CCK8法實驗結果顯示,與對照組或HY-B0069組相比,IFN-λ+CDDP組,IFN-λ+CDDP+HY-B0069組的MDA-MB-231細胞的存活率顯著降低(P<0.05),前兩組無明顯差異(P>0.05);而與IFN-λ+CDDP組相比,IFN-λ+CDDP+HY-B0069組細胞存活率明顯升高(P<0.05);流式細胞術實驗結果顯示,與對照組或HY-B0069組相比,IFN-λ+CDDP組,IFN-λ+CDDP+HY-B0069組的MDA-MB-231細胞的凋亡率顯著升高,且G1期細胞占比增加,前兩組無明顯差異;而與IFN-λ+CDDP組相比,IFN-λ+CDDP+HY-B0069組細胞凋亡率與G1期細胞比例均明顯降低。見圖5。

圖5 STAT信號通路抑制劑HY-B0069對干擾素λ聯合CDDP作用MDA-MB-231細胞的影響
3 討論
乳腺癌作為一種高度異質性腫瘤,是女性癌癥相關死亡的第二大原因[10-11]。近年隨著腫瘤免疫研究的發展,免疫治療已成為繼手術、放化療之后的新的治療手段[12]。腫瘤免疫治療主要針對機體的免疫系統,借助免疫系統的力量抑制腫瘤進展。腫瘤免疫治療包括單克隆抗體與小分子化合物、靶向治療、腫瘤疫苗及細胞因子治療等[13]。細胞因子是由免疫細胞(巨噬細胞、NK細胞、T細胞等)和非免疫細胞(內皮細胞、表皮細胞、纖維母細胞等)經刺激而合成分泌的具有廣泛生物學活性的小分子蛋白[14]。楊媚[15]的研究顯示,干擾素誘導跨膜蛋白3的表達,進而影響乳腺癌細胞增殖。Lasfar等[5]研究顯示,IFN-λ一方面可誘導黑色素瘤細胞表面MHC I類表達,提高NK/NK T細胞的殺瘤活性,另一方面可抑制腫瘤在體內的轉移,這提示IFN-λ具有抑制腫瘤發生發展的功能。
IFN-λ是Ⅱ型細胞因子家族成員之一,與Ⅰ型IFN的基因及結構不同,IFN-λ由IFN-λ1(IL-29)、IFN-λ2(IL-28A)和IFN-λ3(IL-28B)3個亞型組成,通過與其受體結合,調控STAT信號通路,形成干擾素刺激調節因子進入細胞核,啟動相應基因的轉錄及表達,影響腫瘤進展[16]。近年研究發現,IFN與化療藥物聯合影響腫瘤的惡性生物學行為。Li等[17]研究發現,IFN-MBP通過激活細胞周期阻滯和細胞凋亡通路基因p53、p21、CDK2、cyclin A、caspase 9、Bcl-2和Bax,可增強多柔比星乳腺癌化療的療效。Legrier 等[18]研究發現,IFN-γ與順鉑聯合可誘導乳腺癌細胞凋亡。李競等[9]研究發現,IFN-λ聯合順鉑通過激活凋亡的線粒體通路及死亡受體通路,且下調凋亡抑制基因Survivin表達,增加腫瘤細胞對順鉑及阿霉素的藥物敏感性。本研究發現,IFN-λ與CDDP聯合應用,可進一步抑制乳腺癌細胞MDA-MB-231細胞增殖活性,促進細胞凋亡,使細胞停滯于G1期,表明CDDP可提高IFN-λ對MDA-MB-231細胞惡性生物學行為的抑制。
近年研究顯示,IFN-λ可以在多種腫瘤細胞中激活信號通路,例如Burkitt′s淋巴瘤[19]、乳腺癌[20]、肝癌[21]及肺癌[22]。Niwa等[23]研究發現,IFN-λ可誘導上皮細胞STAT1/STAT2信號通路的激活。Li等[24]研究發現,STAT1激活的程度隨IFN-λ刺激強度的增加而增強。這些研究提示,IFN-λ的抑癌機制可能與STAT通路相關。此外,Yamauchi等[25]研究發現,IFN-λ誘導ISGs表達,激活Caspase3和Caspase7并促進凋亡,可能與STAT通路持續激活相關;陳元巖等[26]研究發現,華蟾素通過抑制STAT通路活化,抑制胃癌腫瘤細胞增殖和誘導細胞凋亡,這說明,STAT信號通路參與腫瘤細胞增殖與凋亡的調控。本研究發現,IFN-λ聯合CDDP可激活MDA-MB-231細胞的STAT信號通路,且STAT信號通路抑制劑可影響IFN-λ聯合CDDP對MDA-MB-231細胞增殖、凋亡及周期的作用,表明IFN-λ聯合CDDP影響MDA-MB-231細胞的抗增殖作用,可能與激活STAT信號通路相關。
綜上所述,IFN-λ聯合CDDP可顯著抑制乳腺癌細胞的增殖活性,促進細胞凋亡,使細胞停滯于G1期,這可能與STAT信號通路相關。本研究為IFN-λ聯合化療藥物治療乳腺癌的研究提供新的思路。

