基于MRI影像組學及ATN分類系統的列線圖預測輕度認知障礙進展
宋嬈,吳小佳,李傳明,劉歡,郭大靜,湯琳
阿爾茨海默病(Alzheimer disease,AD)是癡呆最常見的原因,通常隱匿起病,患者會逐漸出現記力減退和認知功能障礙等,隨著疾病進展上述表現逐漸加重。由于絕大多數患者在出現典型的臨床癥狀時,其神經病理改變已存在多年,因而AD的早期診斷尤為重要[1]。2018年,美國國家老年研究所和阿爾茨海默病協會創建了新的AD研究框架,旨在通過“ATN”生物標記物從生物學上定義AD,其中A代表β淀粉樣蛋白沉積、T代表tau蛋白沉積,N代表神經變性[2]。只要同時具備A和T的證據(即A+和T+),不管臨床癥狀有無,都可以診斷為AD。不難看出,ATN標準的提出將AD的早期診斷大大提前,有助于在AD臨床前期階段采取干預措施,延緩病情進展[3-5]。
一項針對認知正常(cognitively normal,CN)個體的長期認知軌跡的研究發現,基線為A+T+N+的CN個體在隨訪過程中認知功能下降的風險最高,且遠遠高于A+T+N-組,這可能提示N指標對于預測認知進展有重要作用[6]。以往的研究中僅使用單個指標來評估N,如海馬體積或平均皮層厚度[7-9],忽略了許多重要的腦區。作為一門新學科,影像組學可以實現從全腦提取大量高通量成像特征,并對特征進行量化分析和模型構建,從而間接反映腦內病變與病理的潛在關聯,有助于提高診斷及預后評估的準確性[10-12]。
輕度認知障礙(mild cognitive impairment,MCI)被認為是正常衰老與AD之間的中間階段,是有可能發展為AD的潛在目標人群。據估計,每年有10%~20%的MCI患者轉化為癡呆患者[13]。因此,準確預測MCI是否以及何時會進展為AD至關重要。本文運用影像組學方法來評估N指標,探討基線ATN分類狀態聯合臨床危險因素對MCI患者認知障礙進展的預測價值,并構建列線圖預測模型,用于個性化評估MCI患者的認知進展情況。
材料與方法
1.臨床資料
自阿爾茨海默病神經影像學計劃(ADNI)數據庫(http://www.loni.usc.edu/du)納入472例受試者的數據,包括認知正常(CN)被試147例、MC1患者197例和AD患者128例。在5年的隨訪時間內,MCI患者中有100例進展為癡呆,其余97例認知功能保持穩定,記錄MCI患者認知障礙進展(從MCI進展為癡呆)的時間以及認知狀態保持穩定的時間。CN被試在基線及整個隨訪期內均保持為CN。所有受試者均有完整的基線臨床和實驗室檢查資料。主要指標:年齡、性別、受教育年限、體質指數(body mass index,BMI)、載脂蛋白Eε4(apolipoprotein ε4,APOEε4)等位基因(采用聚合酶鏈反應-限制性片段多態性方法進行APOE基因分型)、Fazekas分級(用于評價腦白質病變的嚴重程度,包括側腦室旁白質和腦深部白質,分為0~3級)、CSF淀粉樣蛋白Aβ42水平、CSF磷酸化tau(P-tau)水平、簡易智力狀態量表(Mini-Mental State Examination,MMSE)評分、阿爾茨海默病評估量表(Alzheimer's Disease Assessment Scale-Cognitive subscale,ADAS-Cog)11和13評分、臨床癡呆評定量表(Clinical Dementia Rating,CDR)評分、臨床活動調查問卷(Functional Activities Questionnaire,FAQ)得分、臨床活動調查問卷(Geriatric Depression Scale,GDS)得分、雷伊聽覺詞語即刻測試(Rey Auditory Verbal Learning Test- immediate,RAVLT-I)得分、RAVLT學習(learning)測試(RAVLT-L)得分、RAVLT 遺忘(forgetting)測試(RAVLT-F)得分、雷伊聽覺詞語每項遺忘(percent forgetting)測試(RAVLT-PF)得分及動物詞匯流暢性測試(Animal Fluency Test,AFT)得分。
T1WI采用三維磁化準備快速梯度回波(magne-tization-prepared rapid gradient-echo,MPRAGE)序列或等效序列獲得。其中,261例受試者使用Siemens Trio Tim 3.0T磁共振掃描儀進行全腦掃描,掃描參數:TR 2300 ms,TE 3.0 ms,TI 900 ms,翻轉角9°,層厚1.2 mm,矩陣240×256;128 例受試者使用GE 3.0T磁共振掃描儀,掃描參數:TR 7.0 ms,TE 2.8 ms,TI 400 ms,翻轉角11°,層厚1.2 mm,矩陣256×256;83例受試者使用Philips Intera 3.0T磁共振掃描儀,掃描參數:TR 6.8 ms,TE 3.1 ms,TI 0 ms,翻轉角9°,層厚1.2 mm,矩陣256×256。所有受試者掃描參數的相關信息于2020年經批準后在ADNI官方網站下載獲得。
2.影像組學特征的提取
本研究中僅基于T1WI序列進行影像組學特征的提取。使用FreeSurfer 6.0軟件(http://surfer.nmr.harvard.edu)對每例受試者的T1WI圖像進行預處理及自動分割。主要過程包括頭動校正,去除非腦組織、坐標變換、灰白質分割、皮質表面模型重建、區域標記、配準和統計分析。基于Destrieux Atlas圖譜,提取全腦148個皮層腦區的表面積、平均厚度、厚度標準差、積分校正高斯曲率、積分校正平均曲率、內在曲率指數、折疊指數和體積;基于Desikan Killiany圖譜,提取14個皮質下結構的體積,包括雙側丘腦、尾狀核、殼核、蒼白球、海馬、杏仁核和伏隔核。最終,我們共提取1198(148×8+14=1198)個影像組學特征。
3.建立和評價影像組學模型
在CN及AD患者中,首先通過Mann-WhitneyU檢驗去除非顯著性特征,采用Spearman秩相關分析去除冗余特征,閾值取0.9。接著,采用最小絕對收縮與選擇算子(least absolute shrinkage and selection operator,LASSO)、逐步回歸分析及赤池信息準則法(Akaike information criterion,AIC)來確定最佳影像組學特征(圖1)。最后,采用多元Logistic回歸分析建立影像組學標簽。采用受試者操作特性(receiver operating characteristic,ROC)曲線分析CSF Aβ42(即A)、CSF P-tau(即T)和影像組學標簽(即N)在鑒別CN和AD中的診斷效能,計算曲線下面積(area under the curve,AUC)、敏感度和特異度,并確定3者的閾值作為A、T、N的陽性分界值。

圖1 采用LASSO回歸和5折交叉驗證法篩選影像組學特征。a)影像組學特征的LASSO系數分析;b)每次折疊的均方誤差曲線。 圖2 影像組學特征及其回歸系數值柱形圖,以左側海馬旁回的平均皮層厚度的回歸系數較大。 圖3 基于聯合模型預測概率的中位數作為臨界值對MCI患者進行Kaplan-Meier分析,Kaplan-Meier曲線顯示隨著生存時間延長,高風險組患者的生存率呈明顯下降趨勢。a)訓練集;b)驗證集。
4.MCI人群的ATN分類
根據上述過程獲得的陽性分界值,確定每例MCI患者A、T、N的陽性(+)和陰性(-),根據ATN結果(A、T、N結果的組合形式),將MCI患者分成8個亞組。
5.篩選認知障礙進展相關臨床危險因子
采用分層隨機抽樣方法將MCI患者按照7:3的比例分為訓練集例和驗證集。在訓練集中,以結局和時間作為cox回歸模型的因變量(認知障礙進展則賦值為1,保持穩定賦值為0;記錄MCI患者認知障礙進展時間及認知狀態保持穩定的時間,以月為單位),以Fazekas分級、年齡、性別、受教育年限、飲酒史、BMI、APOEε4等位基因及11項量表(ADAS-Cog11、ADAS-Cog13、CDR、FAQ、GDS、MMSE、RAVLT-I、RAVLT-L、RAVLT-F、RAVLT-PF和AFT)評分為自變量,進行單變量(P<0.001)和多變量(P<0.05)Cox回歸分析,以獲得與認知障礙進展相關的臨床危險因子。
6.疾病進展的預測模型
在訓練集,分別采用單因素和多因素Cox比例風險回歸分析,建立基于單獨ATN分類及聯合ATN分類與臨床危險因子的預測模型,并在驗證集中進行驗證。采用一致性指數(concordance index,C-index)對模型的預測效能進行評估。此外,選取訓練集中基于聯合模型預測概率的中位數作為臨界值進行Kaplan-Meier(KM)生存曲線分析,并基于此臨界值將MCI患者分為低風險進展組和高風險進展組,并采用對數秩檢驗(log-rank test)比較兩組認知障礙進展情況的差異。在多因素Cox比例風險模型的基礎上,構建聯合ATN分類和臨床危險因子的列線圖,采用校準曲線(calibration curve)評價列線圖的擬合度。
7.統計分析
使用SPSS 24.0軟件進行統計學分析。分類變量用頻數(百分比)來描述,呈正態分布的連續變量采用均值(標準差)來描述,呈非正態分布的連續變量采用中位數(上、下四分位數)來描述。對連續變量的多組間比較采用單因素方差分析或Kruskal-WallisH檢驗,多重兩兩比較采用Tukey或Nemenyi檢驗。對分類變量采用卡方檢驗或Fisher精確檢驗,并采用Bonferroni方法進行兩兩組間比較。以P<0.05為差異具有統計學意義。
結 果
1.一般臨床資料
AD、MCI和CN組的臨床資料及組間比較結果見表1。基線時,三組之間教育年限、BMI、APOEε4基因、CSF Aβ42和P-tau水平以及所有認知量表評分的差異均有統計學意義(P<0.05)。進一步組間多重兩兩比較,CN組與AD組之間受教育年限以及MCI組與AD組之間BMI的差異具有統計學意義(P<0.05);APOEε4基因的組間差異均有統計學意義(P<0.05);AD組、MCI組和CN組的CSF Aβ42水平依次增高,組間差異均有統計學意義(P<0.05);AD組、MCI組及CN組的CSF P-tau水平依次減低,組間差異均有統計學意義(P<0.05);除外GDS評分和RAVLT-F評分,其余認知量表評分的組間差異均有統計學意義(P<0.05)。

表1 不同認知狀態被試的臨床資料及組間比較結果
2.影像組學標簽的構建
經特征篩選后,最終共獲得15個最佳影像組學特征用于建立組學標簽,各個影像組學特征的名稱和回歸系數見圖2,以左側海馬旁回的平均皮層厚度的權重較大。
A、T、N三個指標鑒別CN與AD的效能指標見表2。

表2 ATN指標鑒別CN與AD的診斷效能
根據ROC曲線結果,CSF Aβ42≤952 pg/mL為A+,CSF P-tau >24.38 pg/mL為T+,影像組學標簽值>0.4561為N+。
3.MCI患者ATN各亞組的分布情況
根據A、T、N的閾值,本研究中MCI患者的ATN結果分為8種類型(亞組),占比最大的是A-T-N-組42例(21.3%),其次是A+T+N-組39例(19.8%)和A+T+N+39例(19.8%),其它各亞組分別為A-T+N-組18例(9.1%)、A+T-N-組17例(8.6%)、A+T-N+組16例(8.1%)、A-T-N+組13例(6.6%)和A-T+N+組13例(6.6%)。
4.MCI患者認知障礙進展相關臨床危險因子
單因素和多因素Cox回歸分析結果見表3。單因素Cox回歸分析結果顯示,APOEε4等位基因、ADAS-Cog11評分、ADAS-Cog13評分、FAQ評分、MMSE評分、RAVLT-I評分、RAVLT-L評分、RAVLT-PF及AFT評分是認知障礙進展的危險因素。多因素Cox回歸分析結果顯示,APOEε4等位基因、FAQ評分和AFT評分是認知障礙進展的危險因素。

表3 訓練集中各項臨床特征與認知障礙進展相關性的單因素和多因素Cox回歸分析結果
5.預測模型的效能
基于ATN分類的認知障礙進展預測模型及ATN分類結合3個臨床危險因子的聯合預測模型在訓練集的C-index分別為0.849(95%CI:0.786~0.912)和 0.972(95%CI:0.661~0.782),在驗證集分別為0.849(95%CI:0.754~0.944)和0.906(95%CI:0.661~0.782)。
聯合預測模型在訓練集及驗證集的KM生存曲線分析結果見圖3。將模型預測認知障礙進展概率的中位數0.02作為區分低風險和高風險進展組的臨界值,在訓練集中,高風險和低風險進展組的中位生存時間分別為36和60個月,兩組間差異有統計學意義(Log-rank test,P<0.0001);在驗證集中,高風險和低風險進展組的中位生存時間分別為48和60個月,兩組間兩組間差異無統計學意義(P=0.052)。基于ATN分類和臨床危險因子繪制個體化預測MCI患者1、3、5年認知進展風險的列線圖(圖4),其校準曲線(圖5)顯示在訓練集和驗證集中列線圖預測結果與實際觀察結果之間差異無統計學意義(P=0.119、0.778),模型擬合效果較好。
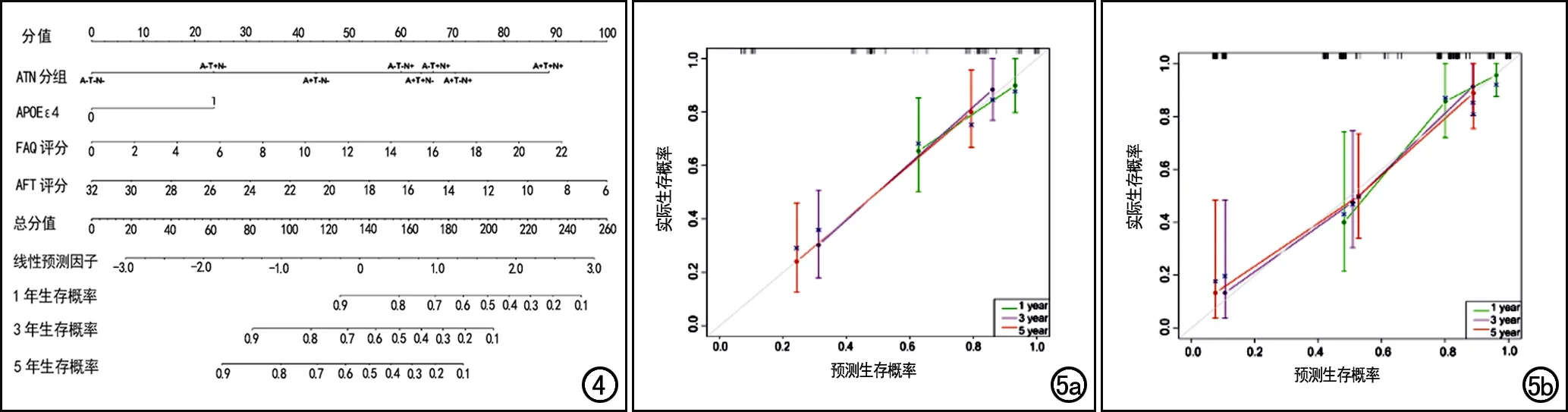
圖4 基于ATN分類和臨床危險因子繪制個體化預測MCI患者1、3、5年認知進展風險的列線圖。圖5 列線圖模型評估MCI認知進展的校準曲線,對角線(灰色)代表理想曲線,綠色、紫色及紅色實線分別代表1、3、5年的實際預測曲線,理想曲線與實際預測曲線越靠近,預測效果越好。a)訓練集;b)驗證集。
討 論
本研究基于全腦的影像組學特征建立了AD的診斷模型,獲得較高的診斷效能,并將其首次應用于對AD患者神經退行性變(N指標)進行評價;此外,我們聯合基線ATN分類狀態和認知障礙進展相關臨床特征來構建預測模型,并繪制可視化列線圖,有效地評估了MCI患者未來5年內認知進展的風險。
AD患者的神經損傷廣泛發生于皮層和皮層下區域,MRI上腦萎縮可以反映神經退行性變的程度。Lehmann等[14]報道了AD患者雙側后扣帶回、楔前葉和后頂葉的皮質厚度減小。皮層下區域如殼核、丘腦和基底節區也表現出與認知障礙相關的萎縮改變[15]。在本研究中,我們基于全腦影像組學特征建立的影像組學模型能有效區分CN和AD患者(AUC=0.998)。相較于既往研究中采用海馬體積或平均皮層厚度的方法[7],本研究中獲得的影像組學模型表現出更高的敏感度和特異度。通過全面捕捉腦結構的變化特征,影像組學方法實現了對神經退行性變的更準確和更敏感的評估,有助于進一步豐富ATN分類系統。
在本研究中,我們基于腦脊液和影像學標志物對MCI患者進行分組,并觀察各組患者5年內的認知進展情況。其中,CSF內異常淀粉樣蛋白和P-tau蛋白沉積及有神經退行性變(A+T+N+)的患者進展風險最高。在一項將ATN分類系統應用于認知功能正常個體的研究中發現,在長期縱向隨訪中,只有A+T+N+組中患者的認知能力下降程度始終大于A-T-N-組。[6]。另一項對主觀認知下降(subjective cognitive decline,SCD)人群的研究結果顯示,在5年隨訪期內,A+T+N+組患者的臨床進展率最高,表現為從SCD進展到MCI再到AD[16]。這些結果可能表明,3種生物標志物同時異常對癡呆前階段AD患者認知功能損害逐步進展具有重要提示作用。有趣的是,我們發現A+T-N+、A-T-N+、A-T+N+與A+T+N-組具有相似的進展風險,他們的進展風險僅次于A+T+N+組。由此我們推測,當MCI患者不滿足ATN框架下的AD診斷標準(即A+T+N+或A+T+N-)時,N+的出現可能預示未來進展的高風險。
Meta分析結果顯示神經心理學量表評分是MCI進展的可靠且必要的預測指標[17]。本研究結果顯示基線狀態具有較高FAQ評分和較低AFT評分的MCI患者表現出更高的進展風險。Huang等[18]發現,基線FAQ評分表現出比影像學特征和腦脊液生物標志物更強的預測能力,是很好的進展預測因子。此外,我們觀察到基線時MCI患者中APOEε4等位基因攜帶者的比例介于認知正常的老年人與AD患者之間,差異具有統計學意義,且APOEε4等位基因與MCI進展密切相關。APOEε4等位基因是公認的AD易感因子,APOEε4等位基因的存在可使MCI的發生風險增加1.4倍[19],攜帶APOEε4等位基因的MCI患者未來5年內進展為AD的風險明顯高于未攜帶者[20]。因此,本研究建立的預測模型中納入的臨床預測因子具有較高的普遍應用價值。
本研究初步探索了基于MRI的影像組學模型、ATN分類結果聯合臨床危險因子的列線圖預測模型對MCI患者TTP的預測價值。通過將各危險指標的貢獻率以線段的長短表示,列線圖直觀簡潔地展示了不同ATN組合患者未來1、3和5年出現進展的概率,具有很強的可視性和臨床實用性。本研究結果顯示該模型具有較好的預測效能,在訓練集和驗證集中的C-index分別為0.927和0.906。校正曲線表明對于估計MCI患者1、3和5年的生存率,列線圖估計值與實際值之間有較好的一致性。
本研究存在一定局限性:第一,本研究仍處于初級探索階段,基于MRI影像組學的ATN分類系統能否廣泛的運用于不同認知狀態的人群中尚需進一步研究。第二,列線圖預測模型的建立是基于ADNI數據庫的一項回顧性分析,受到納入和排除標準的限制,樣本量較小,其預測性能有待于未來在多數據庫及大樣本研究中進一步驗證。

