北方粳稻抗稻瘟病分子育種策略及展望
馬作斌康厚祥鄭文靜
(遼寧省水稻研究所,遼寧 沈陽 110101)
由稻瘟病菌(Magnaportheoryzae) 引起的稻瘟病是一種世界性的稻作病害,在世界各水稻產區每年都有不同程度的發生[1]。該病發生時產量一般減少10%~20%,較嚴重的地區可達40%~50%,局部區域甚至顆粒無收[2~3]。我國北方粳稻年栽培面積在460萬hm2以上,占全國粳稻生產面積的近60%。近20年來,盡管在高產育種上有巨大突破,但由于稻瘟病菌復雜多變,且品種抗譜狹窄,加之品種單一化大面積種植,導致很多育成的超級稻品種推廣幾年即喪失了抗性。因此,提高品種對稻瘟病的抗性、增強其抗病的持久性仍然是北方粳稻育種和生產上亟待解決的重要問題。稻瘟病病程長,發病因素復雜,大量化學藥劑的使用不僅會對環境造成污染、危害人類健康,由此帶來的大量的人工和物質投入也不利于農業的可持續發展,選育攜帶抗稻瘟病基因的品種是防控稻瘟病最為經濟有效的途徑[4]。但在育種實踐中,育種家們往往以常規育種為主。尤其在我國北方,育成的粳稻品種抗稻瘟病基因較少,抗性強、抗譜廣的主效抗稻瘟病基因在育種中應用不夠,導致很多品系在參加水稻品種區域試驗時經常由于稻瘟病抗性弱而被“一票否決”。而在育種過程中從育種路線設計時就應注重引入抗病基因,如此不僅可提高品種選育的效率,其對于降低稻瘟病大發生的風險、減少化學農藥的施用及保障國家糧食安全等均具重要意義。本文圍繞育種中常見的問題及困難,針對性提出了抗稻瘟病水稻新品種選育及抗病性改良的策略,為育種家提供參考。
1 稻瘟病菌的侵染過程
稻瘟病菌主要通過氣流、雨水傳播,病原菌以分生孢子的形式感染水稻,分生孢子可借助風雨傳播到寄主細胞上,其頂端在潮濕的環境中可產生粘液,并在基質的表面形成薄而粘的墊層,以非特異性的方式將分生孢子附著在被蠟覆蓋的寄主表面。分生孢子與寄主接觸后的30 min即開始萌發產生芽管,2~4 h后芽管頂端腫脹和彎曲形成附著胞,附著胞擴張、黑化后形成侵染釘,通過該結構穿透宿主表面并將附著胞內容物傳遞到寄主細胞[5]。侵染釘穿透寄主后頂部膨大形成初級侵染菌絲,進一步通過不斷的分化形成球根狀的有分支的次級侵染菌絲。而后通過胞間連絲向臨近的植物細胞擴展[6]。稻瘟病菌的侵染是一個半活體的營養寄生過程,在侵染的早期階段,次級侵染菌絲通過產生效應子(Effectors)攝取植物細胞中的營養,隨著侵染的不斷進行,侵染后期稻瘟病菌會破壞植物組織來獲得養分。病害發展的最終稻瘟病菌從患病的水稻組織中產生分生孢子。分生孢子在稻草和殘茬中越冬后,循環往復。在合適的環境條件下,一個單一的侵染周期可以在7 d左右完成。
2 病害發生程度的影響因素
水稻的整個生育期均有可能發生稻瘟病,根據稻瘟病菌侵染部位可將稻瘟病劃分為苗瘟、葉瘟、節瘟、穗頸瘟和谷粒瘟等類型[8]。稻瘟病的發病程度與品種抗病性、種植區域、稻田環境、田間稻瘟病菌的密度以及環境溫濕度等均密切相關[9]。首先,溫濕度條件及田間病原菌的孢子濃度是決定病原菌是否可完成初侵染的關鍵因素。在水稻生產田中,每天傍晚至次日上午是水稻組織上具霧露的時間,但不同省份、不同地區的霧露時間長短差異很大。一般情況下,空氣濕度大、田間水層較深、光照不足、風較小(如周圍有山峰遮擋)的稻區霧露時間更長,也更易發生稻瘟病[10~11]。稻瘟病菌侵入細胞時必須突破水稻組織的細胞壁屏障,因此,其易于在分生活躍(較幼嫩)的部位侵入,而一旦水稻的組織老化,胼胝質和木質素等聚合物沉積,可使細胞壁對病原真菌附著胞入侵過程中產生的機械壓力更具有抵抗能力[12]。田間常常發現,氮肥施入較多的地方稻瘟病重,其原因就是植物組織在氮肥過量時更為幼嫩,因此其基礎防御系統也更容易被病原菌攻破。病原菌侵入細胞后是否可在胞內繁殖及擴展,取決于水稻品種是否攜帶可識別該病原的抗稻瘟病基因,如可識別,將誘發一系列抗病反應,進而將病菌限定在被侵入的細胞中,不形成病斑或只有針狀褐點。否則,病原菌將通過胞間連絲向鄰近細胞擴展,形成病斑。
3 水稻對稻瘟病的抗性機制
水稻在與病原菌長期協同進化過程中形成了多種免疫系統抵抗病原物的入侵。目前研究較透徹的有兩個層面,即病原相關分子模式(pathogen-associated molecular patterns,PAMPs)誘導的免疫反應(PAMP-triggered immunity,PTI)和病原菌效應蛋白(effector)誘導的免疫反應(effector-triggered immunity, ETI)[13]。稻瘟病菌的分生孢子附著在水稻組織表面時,真菌的細胞壁成分如幾丁質、葡聚糖等病原分子可為水稻細胞表面的模式受體(pattern recognition receptors PRRs)所識別,進而引發一系列的抗病反應,包括植保素積累、細胞壁加厚及胼胝體的產生等,PTI介導的抗性屬非小種特異性,廣泛存在于所有的水稻品種中。盡管水稻具有能夠抵御病原菌侵染的PTI防御系統,但多數情況下依然遭受稻瘟病菌的侵染并感病,這是由于稻瘟病菌能夠分泌效應蛋白,一旦稻瘟病菌通過侵染釘將附著胞內容物傳遞到水稻細胞內,這些效應蛋白即可發揮作用,抑制PAMPs誘導的PTI免疫反應,而水稻針對病原菌的效應子也進化出第二道防線,即識別病原菌效應子后啟動的ETI免疫反應。ETI主要是由一類具有核苷酸結合位點和富含亮氨酸重復結構域的受體蛋白所調控,其可誘導更強的抗病反應,包括活性氧爆發及細胞程序化死亡等[14]。截止到目前,已定位了69個位點上114個主效基因(QTL),其中已克隆的36個基因中絕大部分為介導ETI的NBS-LRR類R基因,如Pi1、Pi2、Pi5、Pi9、Pi25、Pi35、Pi36、Pi37、Pi40、Pi56、Pi64、Pita、Pib、Piz-t、Pik-m、Pit、Pid3、Pish、Pik、Pik-p、Pia、Pigm、Pb1、Pi-CO39、Pi63、Pid3-A4、Pi54rh、Pi54of和Pike等[15]。基于這些主效基因已開展大量的分子標記輔助育種工作,所育成的抗病性改良水稻品種在稻瘟病綠色防控及水稻生產中發揮了重要作用[16~17]。
4 抗稻瘟病分子育種的策略及技術路線
4.1 抗瘟基因及其供體的選擇
由于R基因識別病原菌的特異性較強,同時,稻瘟病菌復雜多變,不同地區的稻瘟病菌生理小種差異也較大,因此,在各地區對當地病原菌具主效抗病效應的基因也不同。因此,面對這種狀況,育種家常常無從選擇,難于確定該應用哪些基因能提高品種的抗病性。本文作者經過多年的育種實踐,提出幾種策略,供育種家參考。
4.1.1 基于病原菌的無毒基因型進行預測
稻瘟病菌與水稻的互作符合“基因對基因假說”[18],水稻在抵抗稻瘟病菌侵染的過程中,其抗病基因與稻瘟病菌的無毒基因互作,引發過敏性壞死反應(HR),抑制稻瘟病菌在寄主植物中的擴展,從而產生抗病的效應。通過鑒定稻瘟病菌的無毒基因型可以預測在該地區可起抗病作用的抗稻瘟病基因,進而選育并推廣攜帶這些基因的品種,從而減輕病害流行的風險及其所造成的損失。同時,鑒定稻瘟病菌的無毒基因也有助于根據不同地區流行菌株的無毒基因型選育具有相應抗病基因的水稻品種,并選擇不同水稻品種合理布局。如王世維等根據已克隆且與稻瘟病菌致病性相關的6個無毒基因序列設計引物,選取遼寧省稻瘟病重發區的26株稻瘟病菌單孢菌株鑒定,發現遼寧稻區流行稻瘟病菌中Avr-pik、AvrPiz-t和Avr-pita分布較為廣泛,表明選育及推廣攜帶相應抗病基因的水稻品種可減輕稻瘟病的危害[19]。
利用這種方法可從病原菌的角度預測下一階段在田間起作用的抗病基因,但該方法需從樣品收集開始,完成各地區病原菌的分離、擴繁及無毒基因型鑒定,工作量較大。且目前雖然已有36個抗稻瘟病基因克隆,但克隆的無毒基因只有12個[20],因此,利用該方法尚不能全面地預測抗病基因的作用。
4.1.2 基于抗稻瘟病單基因系的鑒定結果進行推斷
近年來, 國內外學者以稻瘟病普感品種麗江新團黑谷(LTH)為背景創制了攜帶不同抗稻瘟病基因的近等基因系,可將其種植于當地病害重發區(生產田,不建議種病圃)或接種當地流行的稻瘟病菌,調查葉瘟、穗頸瘟發生情況,進而全面了解不同抗病基因在某個地區的效應。如,雷財林等利用9個日本鑒別品種、7個中國鑒別品種、31個抗稻瘟病單基因系及12個黑龍江地區的主栽品種,對采自該省主要積溫區不同水稻品種的173個稻瘟病菌株進行致病性測定。結果表明Pi9在所有積溫區對稻瘟病菌株的抗譜都最廣,Piz-5(CA)、Piz-5(R)、Pita-2(R)、Pita-2(P)、Pi12(t)和Pi20(t)對供試菌株也有高于70%的抗譜, 具有較高的利用價值[21]。李進彬等將采集、分離自云南省3個稻區的282個稻瘟病菌單孢菌株,接種于以麗江新團黑谷為輪回親本培育而成的含有22個垂直抗性基因的水稻單基因系上,根據各稻區采集的菌株在水稻單基因系上的侵染率,分析各垂直抗性基因在云南省各稻區的利用價值[22]。
4.1.3 引進資源并進行鑒定
近年來隨著水稻基因組學的發展,不斷有新的基因被鑒定。育種家應時常關注國內外研究進展,如有新的基因報道,可及時將該基因的供體材料予以引進,并種植于本地區病害發生較為嚴重的地區鑒定其在當地的抗病表現,如在多年多點均表現抗病,可將其作為抗源供體。如,攜帶Pigm的谷梅4號、攜帶bsr-d1的地谷、攜帶Ptr的Katy等均是近幾年內報道的優異的抗源材料[23~25]。同時,為了縮短育種年限,在進行資源引進時,優先考慮遺傳背景與本地區水稻資源接近的材料,雜交后純合相對較快。此外,有些育種家以上述材料為親本還創制了多基因聚合的材料,這些新種質作為抗病性改良的親本更為適合[26]。
4.1.4 根據育種資源的抗稻瘟病基因型及其抗病表型選擇
在育種過程中育種家經常能發現一些在多年多點對稻瘟病表現穩定抗性的資源,但由于不了解這些材料所攜帶的抗瘟基因,在以其為親本進行雜交及回交時容易將主效抗病基因“丟失”,因此,對這些廣譜穩定抗病的材料開展抗瘟基因鑒定,并將基因型與其抗瘟表型結合進行分析,以推斷在當地可發揮主效抗性的抗瘟基因。如,汪文娟利用稻瘟病抗性基因Pi1、Pik-p、Pik-h、Pi2、Pi9、Piz-t、Pita、Pii的功能標記,對華南328個雜交稻組合進行了抗瘟基因型分子檢測。結果表明Pi2 與Pi1對華南稻區稻瘟病的抗病性貢獻最大,其他抗病基因的貢獻大小依次是Pik-h、Pik-p、Pita、Pii與Piz-t[27]。 王麗麗等選取遼寧地區水稻資源 176 份,鑒定了抗稻瘟病基因pi21、Pi36、Pi37、Pita、Pid2、Pid3、Pi5及Pib在這些材料中的分布情況,并接種鑒定了這些材料對稻瘟病的抗性。結果表明攜帶Pita+Pi5 及Pita+Pid3+Pi5的材料抗性最強[28]。可見,通過鑒定育種親本的抗稻瘟病基因型及表型對抗病分子育種過程中親本的選擇具指導性意義,但在基因型鑒定時需注意,無論采用基因的連鎖標記或基因內部標記,其鑒定結果均不能確定某品種攜帶的抗病基因是否與已克隆的基因完全一致,且是否具有該基因的功能,因此,獲取鑒定結果后仍需對資源的抗病表型進行驗證。
4.1.5 利用抗病資源定位新基因
在對育種資源的抗瘟基因進行鑒定的過程中,經常可發現一些品種對稻瘟病表現穩定的抗病性,但并不攜帶已克隆的主效抗稻瘟病基因。因此以這些資源為親本開展抗病品種選育時往往不知該跟蹤哪些基因(位點),在這種情況下,將其與感病品種雜交構建遺傳分離群體,在開展抗病基因定位的同時進行抗病分子育種,不失為一種基礎研究與育種應用相結合的選擇。多年來,眾多學者已將基因定位與抗病分子育種工作相結合,在發掘新基因的同時獲得了一系列抗病性改良的水稻材料。如,趙家銘等從北方粳稻港育129中定位到一個抗稻瘟病基因Pi65,并開發了一個與該基因緊密連鎖的分子標記InDel-1,將港育129與遼星1號雜交、回交,利用InDel-1篩選后代材料,結合花藥培養育成了一個水稻新品種遼粳168,其農藝性狀與遼星1號較為相似,但對稻瘟病的抗性顯著提升[29]。
4.2 抗病品種選育的技術路線
4.2.1 抗病新品種選育
如攜帶某抗稻瘟病基因(Pix)的供體親本遺傳背景與受體親本較為相近,同時,對所獲后代的性狀無特殊要求,則可將兩親本雜交,F1代自交,F2代用抗稻瘟病基因Pix的分子標記輔助選擇,篩選到攜帶該基因位點純合的后代,再利用系譜選擇選育攜帶Pix且農藝性狀優異的水稻品系(圖2)。
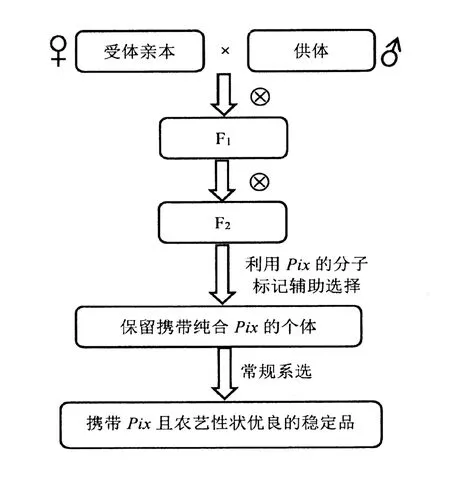
圖2 抗稻瘟病水稻新品種選育技術路線Figure 2 Breeding technology of new rice varieties resistant to rice blast
4.2.2 品種抗病性定向改良
如針對某受體親本開展抗病性定向改良,即擬獲取攜帶目的基因Pix且農藝性狀與受體親本一致的后代,可參考圖3中的技術路線。與前文的抗病新品種選育不同,開展抗病性定向改良時需以感病品種為輪回親本做多代回交,而且在做雜交時要盡可能多獲取BC1F1、BC2F1的種子,一般情況下,如需快速獲得定向改良的后代,回交子一代的個體數最好為200個以上,同時,在做每一代的回交之前,最好利用全基因組育種芯片對回交子代的遺傳背景進行分析,從中選擇既攜帶目標基因,同時遺傳背景與輪回親本最為接近的個體作為回交親本。另外,為盡快獲得抗性定向改良的純合品系,可取回交子一代的幼穗參照鄭文靜等的方法做花藥培養[30]。
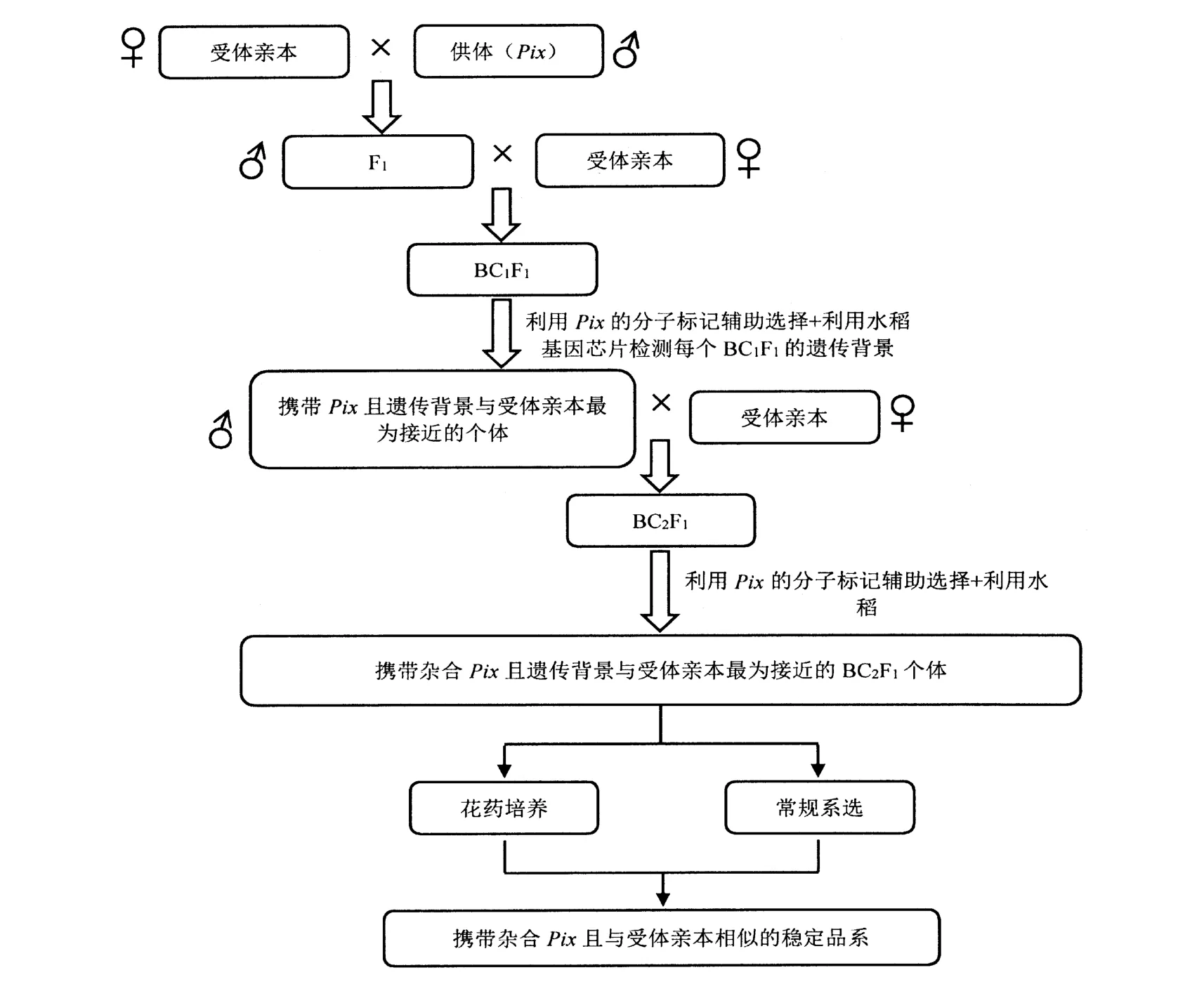
圖3 水稻抗病性定向改良技術路線Figure 3 Technical route for directional improvement of blast resistance of rice varieties
5 問題及展望
盡管多年來水稻抗稻瘟病育種已取得顯著進展,但育種家們在開展抗性育種工作時經常能遇到各種難題,如很多品種對稻瘟病(尤其是穗頸瘟)的抗性不穩定,具體表現為“今年抗、明年不抗;某一區域抗、另一區域不抗”等等。其實,如前文所述,水稻對稻瘟病的抗性受很多因素的影響,其中抽穗期對穗頸瘟發生的影響較大。如某品種不攜帶主效抗病基因,但其抽穗期明顯較當地大面積種植的品種早或晚,由于其病害易感時期與田間最宜發病的時期不一致,故表現為“避病”。此外,有些品種剛育成時抗病性較強,但在推廣2~3年后抗性即開始下降,育種家選育品種時歷程長,但品種壽命短,嚴重影響科研成果的產出及成果轉化。實際上,以上兩種情形均與品種不攜帶抗稻瘟病基因或者只攜帶單個基因有關,而通過分子標記輔助選擇引入主效抗病基因及聚合2個以上抗瘟基因可有效解決上述問題,同時,為了延長品種的壽命,推薦將主效抗病基因與部分抗性基因相聚合,使品種對稻瘟病的抗性更強、更持久[31]。在引入多基因以后,雖然抗病性提高了,但其主要農藝性狀也容易發生變化,尤其是多基因控制的復雜農藝性狀,如產量、品質、適應性等。為避免此類情況,需將分子標記輔助選擇與全基因組背景選擇相結合(參照4.2.2),基于抗病基因的分子標記選擇抗病性狀,利用全基因組育種芯片選擇其它性狀,前景選擇與背景選擇共同進行,可有效避免抗性提高但與受體親本表型相差較大的現象出現[32]。
隨著基因組學的發展,未來階段仍會有新的抗稻瘟病基因陸續被鑒定,而育種芯片的不斷升級也為攜帶不同抗病基因的品種定向改良提供了條件,因此,為有效控制稻瘟病的發生,避免單一品種大面積種植帶來的病害大發生的風險,可基于上述技術開發某一品種為背景,但包含不同抗病基因的近等基因系群體,即“多系品種”。但由于稻瘟病菌和水稻是共同進化的,水稻和病原菌之間的互作符合“軍備競賽”模式,二者之間存在“你攻我守、此消彼長”的互作[33]。病原菌不可能被消滅,水稻也不能完全抗病,可以說,抗病育種是一個“永遠在路上”的工作,因此,育種家身上將會一直肩負著抗病性改良的任務和使命,須及時跟進國內外研究進展,并不斷引進資源進行嘗試,只有這樣,才能將基礎研究與應用研究相結合,使生物技術真正“落地”,進而提高水稻抗稻瘟病分子育種的效率,不斷選育抗病品種,以實現稻瘟病的綠色防控,為保障國家糧食安全提供支撐。

