胃混合性腺神經內分泌癌的臨床特征及預后分析
范仁亮
(福建省南平市第一醫院腫瘤內科,福建 南平 353000)
2010年世界衛生組織(WHO)將神經內分泌腫瘤劃分為神經內分泌瘤、神經內分泌癌和混合性腺神經內分泌癌(mixed adenoneuroendocrine carcinomas,MANEC)[1]。MANEC是一種同時具有經典型腺癌和神經內分泌癌2種惡性成分,且每種成分至少占腫瘤細胞群的30%的惡性腫瘤[2]。由于胃混合性腺神經內分泌癌(gMANEC)具有發病率低、臨床表現不典型和病理學特征差異大等特征,嚴重影響了臨床治療及預后判斷[3]。目前,國際上尚未發布切實可行的治療指南,且缺乏對其起源、臨床表現、組織病理特征、治療方案、預后因素的系統性研究。為了加速人們對該類疾病的了解,促進相關治療方案的落實,本研究通過對相關預后危險因素的系統性分析,發現腫瘤體積、TNM分期、是否行R0切除術、術前外周血血小板與淋巴細胞比值、腺癌成分的分化程度是gMANEC患者的獨立預后危險因素。
1 資料與方法
1.1 一般資料 收集2014年6月至2020年6月就診于福建省南平市第一醫院經病理確診的gMANEC患者47例。其中男38例,女9例。年齡≥65歲22例,<65歲25例,平均年齡65歲。
1.2 方法
1.2.1 診斷方法 首先根據2010年WHO消化系統腫瘤診斷標準:MANEC是一種同時具有腺癌和神經內分泌癌2種惡性成分,且每種成分至少占30%的惡性腫瘤[2]。
1.2.2 治療方法 早期患者行根治性手術,術后行輔助治療。晚期患者因出現梗阻、穿孔、出血等并發癥而行減輕癥狀手術。如初發時已出現遠處轉移,行姑息治療。
1.2.3 隨訪 電話或門診隨訪。隨訪截止日期為2021年6月31日。
1.3 統計學方法 通過SPSS 22.0軟件進行統計學分析。計數資料采用[n(%)]表示,組間比較行χ2檢驗,采用Kaplan-Meier法繪制生存曲線,計算總體生存率;采用Log-rank檢驗、多因素Cox回歸模型實現預后影響因素分析。P<0.05表示差異有統計學意義。
2 結果
2.1 臨床表現 本研究的47例患者最常見的癥狀為上腹痛,3例患者無任何癥狀。腫瘤的體積0.5~840 cm3,平均體積45 cm3。其中≥45 cm311例,<45 cm336例。
2.2 臨床診治情況 47例患者均行術前內鏡檢查,其中僅3例經胃鏡病理活檢診斷為gMANEC,其余44例均誤診。47例患者中根治性手術+術后輔助化療29例;根治性手術+無術后輔助化療13例,包括1例ESD;姑息性切除術2例,均未行術后姑息化療;晚期未手術3例,行姑息化療。2.3 隨訪結果 47例患者均獲得隨訪。截至隨訪結束,47例患者中19例存活,中位生存時間為27個月。中位隨訪時間為21個月。1年生存率72.3%、3年生存率為47.8%、5年生存率46.1%。47例患者的總生存曲線見圖1。

圖1 47例患者的總生存曲線
2.4 預后影響因素
2.4.1 影響患者預后的單因素分析結果 gMANEC的預后與年齡、性別、T分期是否受累無關(P>0.05),而腫瘤體積、TNM分期、N分期、M分期、是否行R0切除術、術前外周血血小板與淋巴細胞比值、腺癌成分的分化程度為影響gMANEC患者預后的危險因素(P<0.05)。見表1。
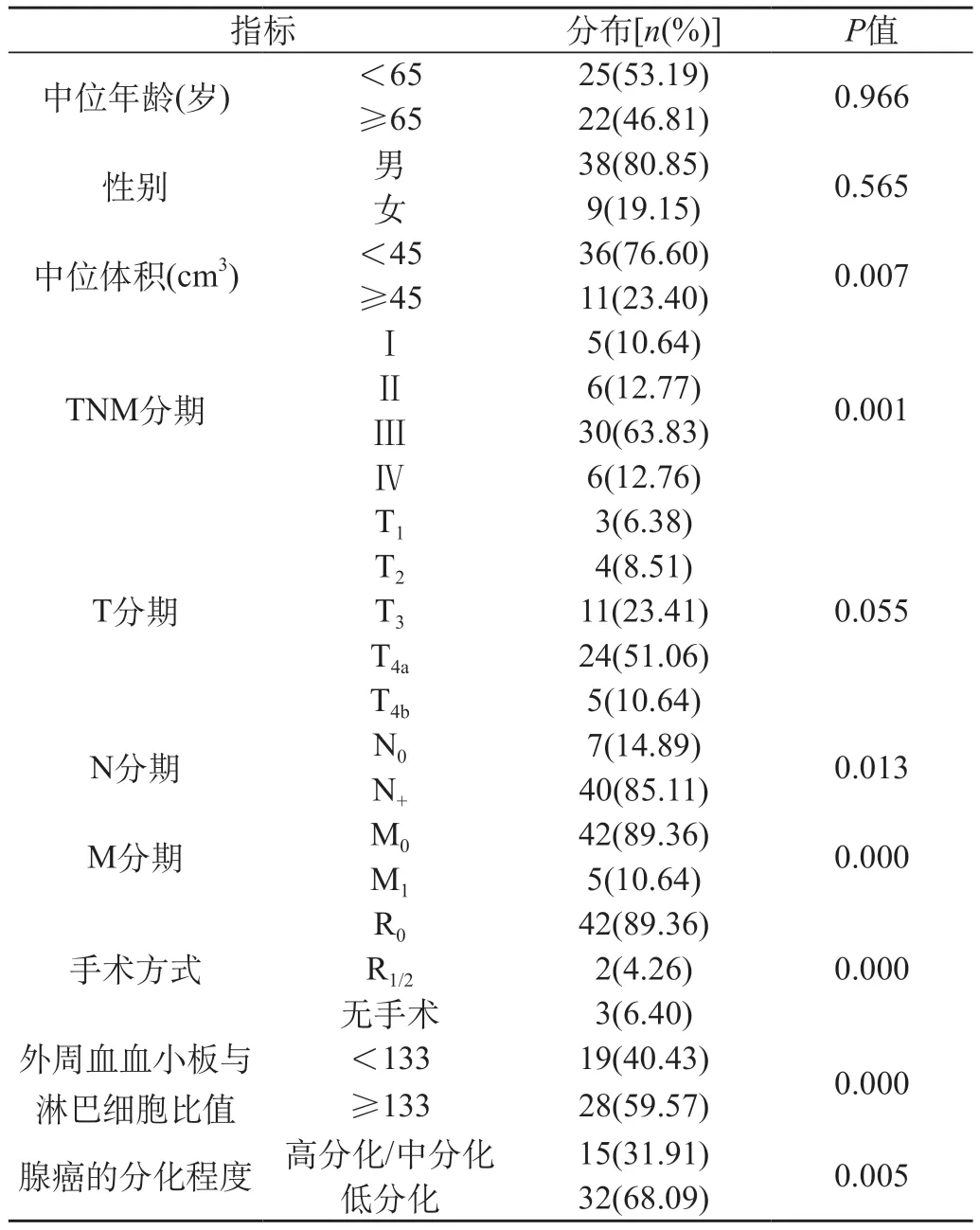
表1 47例胃混合性腺神經內分泌癌患者的臨床基本特征與預后的關系
2.4.2 影響患者預后的多因素分析結果 將單因素分析結果P<0.05的變量納入多因素Cox回歸模型分析,結果顯示腫瘤體積、M分期、術前外周血血小板與淋巴細胞比值、腺癌成分的分化程度是影響gMANEC患者預后的獨立危險因素(P<0.05)。見表2。

表2 47例胃MANEC患者預后的多因素分析
3 討論
神經內分泌腫瘤多見于消化系統和肺部。截至2016年,在英國整個國家只有35例gMANEC報道[4]。目前還沒有針對gMANEC患者的治療指南,其發病率、臨床特征、發病機制、分期、預后因素尚不明確。gMANEC易發生在賁門部[5]。有些患者無癥狀,在常規體檢時發現。gMANEC很少有類癌綜合征表現,以無功能型相對多見[6]。本研究47例患者中無1例有類癌綜合征表現,最常見為上腹痛,其次為腹脹、吞咽困難,與既往文獻報道吻合[7]。相關研究結果顯示,低外周血血小板與淋巴細胞比值患者抗PD-1治療有效率優于高外周血血小板與淋巴細胞比值患者[8]。本研究有1例患者術后復發,外周血血小板與淋巴細胞比值為98,接受Keytruda免疫治療后病情未進展,PFS時間5個月。
2017年第1版NCCN神經內分泌腫瘤指南建議對可切除的低分化神經內分泌腫瘤(包括NEC和MANEC),建議手術+化療±放療。gMANEC術后輔助化療無標準方案[9]。國外有文獻報道對于術后分期II期的gMANEC的術后輔助化療方案推薦依托泊苷+FOLFOX方案6個周期,切端陰性者不行放療。對于術后III期的患者推薦行同步放化療[10]。本研究術后輔助化療方案不統一,僅有兩例患者術后行EP方案(依托泊苷聯合順鉑)輔助化療,1例IB期,1例IIIB期,均未復發,無疾病生存期分別為38個月和45個月。NCCN指南推薦對于所有局部晚期或轉移的低分化神經內分泌腫瘤一線推薦EP方案進行化療。本研究有2例晚期患者行EP方案化療,均獲得部分緩解(PR),證實EP方案對gMANEC患者有效。
既往研究通過二代基因測序發現在gMANEC患者中,MET基因突變率高[11]。有學者對14例胃MANEC患者進行免疫組化染色,發現胃MANEC的c-MET表達陽性率達78.6%[12]。腫瘤免疫治療尤其是免疫檢查點抑制劑已經成為目前腫瘤治療的熱點[13]。在多個實體瘤中,免疫治療取得一定療效,特別是在PD-L1陽性或MSI-H/dMMR的人群中[14]。來自日本的一項研究檢測了PD-L1在胃神經內分泌腫瘤細胞膜上的表達,其中G3組PD-L1陽性率明顯高于G1、G2組[15]。本研究有1例患者術后復發,行PD-L1檢測20%+,接受PD-1抑制劑Keytruda免疫治療,PFS時間5個月。在接下來的工作中將開展gMANEC患者的PD-L1檢測及觀察免疫治療的療效。有學者對89例胃腸胰MANEC進行MSI/dMMR檢測,發現12.4%出現MSI-H[16]。本研究中,47例gMANEC患者未行MSI/dMMR檢測,在接下來的工作中,將開展gMANEC患者的MSI/dMMR檢測,發現免疫治療的優勢人群。靶向阻斷CD73可增強免疫檢查點抑制劑治療活性[17]。有學者檢測了CD73在胃神經內分泌腫瘤細胞膜上表達情況,發現27.2%的患者有CD73表達,其中MANEC組的CD73陽性率為75%[15]。CD73高表達的患者總生存期更低,腫瘤組織中CD73陽性的患者TNM分期更晚[18]。
MANEC的神經內分泌細胞是腺癌細胞分化而來,MANEC的生物學行為及預后取決于腺癌部分的分化程度[19]。本研究中所有的神經內分泌成分均為G3,預后分析中按患者腺癌部分的分化程度分為高/中分化組和低分化組,結果觀察到腺癌部分低分化組的預后明顯差于高/中分化組,為預后的獨立危險因素。相關研究指出,采用AJCC第7版胃神經內分泌腫瘤分期系統進行TNM分期,TNM分期與預后無關[12]。曹龍龍等[20]的研究中采用AJCC胃癌第8版分期,結果顯示腫瘤TNM分期為影響患者總生存的獨立預后因素。未來需要探索更優的分期方法,或者可結合其他指標,如腫瘤體積、外周血血小板與淋巴細胞比值、腫瘤分化程度等建立預后分析模型,以更好地區分出不同預后的人群,指導臨床治療。
綜上所述,胃MANEC患者應早期診斷、早期治療。治療上應以根治性手術治療為主,化療方案不統一。研究胃MANEC的蛋白質組和基因組結構,采用多學科、多模式的方法將改善這些罕見和低估的腫瘤的臨床策略。

