開心散對APP/PS1小鼠神經炎癥和Aβ沉積的作用研究
王彬斌,馮曉曉,恩特扎爾·別爾克,趙 暉,李朝霞
開心散對APP/PS1小鼠神經炎癥和Aβ沉積的作用研究
王彬斌,馮曉曉,恩特扎爾·別爾克,趙 暉,李朝霞*
首都醫科大學中醫藥學院,中醫絡病研究北京市重點實驗室,北京 100069
研究開心散對阿爾茨海默癥(Alzheimer’s disease,AD)動物模型淀粉樣前體蛋白/早老素基因1(amyloid precursor protein/presenilin 1,APP/PS1)雙轉基因小鼠的作用。將3月齡雄性APP/PS1小鼠隨機分為模型組、美金剛(3.33 mg/kg)組及開心散低、中、高劑量(0.33、1.00、3.00 g/kg)組,采用同月齡相同遺傳背景C57BL/6J小鼠作為對照組和對照給藥(開心散1.00 g/kg)組,每組8只。連續ig給藥2個月后,Morris水迷宮實驗評價小鼠學習記憶能力;蘇木素-伊紅(HE)染色法觀察小鼠海馬CA1區神經元形態;剛果紅染色法檢測小鼠腦組織淀粉樣斑塊表達;免疫組化學法檢測小鼠皮層和海馬中β淀粉樣蛋白1-40(amyloid β protein 1-40,Aβ1-40)、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)和離子鈣接頭結合調節分子-1(ionized calcium binding adaptor molecule-1,Iba-1)的表達;ELISA法檢測小鼠血清中炎癥因子腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-1β(interleukin-1β,IL-1β)和IL-6水平以及皮層和海馬中乙酰膽堿(acetylcholine,Ach)水平。與模型組相比,美金剛組和開心散組小鼠學習記憶能力明顯提高(<0.05、0.01),海馬CA1區神經元數量增加(<0.01);皮層和海馬中的淀粉樣斑塊、Aβ1-40、GFAP和Iba-1表達明顯減少(<0.05、0.01);血清中TNF-α、IL-1β和IL-6水平明顯降低(<0.05、0.01);皮層中Ach水平顯著升高(<0.01)。開心散可能通過抑制星形膠質細胞和小膠質細胞活化,降低血清中炎癥因子TNF-α、IL-6、IL-1β水平,減少Aβ和淀粉樣斑塊的生成,增加皮層中Ach含量,從而發揮保護神經元、防治AD的作用。
開心散;阿爾茨海默癥;淀粉樣前體蛋白/早老素基因1雙轉基因小鼠;β淀粉樣蛋白;膠質纖維酸性蛋白;離子鈣接頭結合調節分子-1
阿爾茨海默癥(Alzheimer’s disease,AD)是一種以獲得性記憶減退、認知功能障礙等為主要特征的中樞神經系統退行性疾病,以老年斑和神經原纖維纏結為主要病理特征[1]。隨著世界人口老齡化,AD的發病率急劇增高,嚴重影響人類健康[2]。AD的發病機制復雜,β淀粉樣蛋白(amyloid β protein,Aβ)沉積和神經炎癥在AD的病理進程中起著至關重要的作用[3-4]。AD在中醫學屬“呆病”“健忘”“虛勞”等范疇。開心散始載于唐代孫思邈的《備急千金要方》,由“遠志、人參各4分,茯苓2兩,石菖蒲1兩”組成[5],“主好忘”,是治療老年癡呆的基礎方。研究表明,開心散可改善AD動物模型的學習記憶能力,通過影響Aβ生成、保護神經元、調節神經遞質、抗氧化等途徑發揮作用[6-8],在防治AD方面具有良好的應用前景,但其基于Aβ沉積和神經炎癥的藥理作用還有待于進一步系統研究。本研究選擇淀粉樣前體蛋白/早老素基因1(amyloid precursor protein/presenilin 1,APP/PS1)雙轉基因小鼠,從行為學、Aβ沉積、神經炎癥等方面評價開心散對APP/PS1小鼠的作用,為其臨床應用提供理論依據。
1 材料
1.1 動物
SPF級雄性3月齡APP/PS1小鼠和C57BL/6J小鼠,體質量20~30 g,購自北京華阜康生物科技有限公司,動物許可證號SCXK(京)2020-0004。動物飼養于溫度(25±2)℃、濕度(50±10)%的屏障環境內,自由進食飲水,每日光照12 h。動物實驗經首都醫科大學倫理委員會批準(批準號AEEI-2018-101)。
1.2 藥材
開心散由人參、茯苓、石菖蒲和遠志組成,人參、茯苓和石菖蒲購自北京能濟中藥飲片有限公司,遠志購自北京明輝恒通藥業有限公司,經首都醫科大學中醫藥學院李佳副教授鑒定分別為五加科植物人參C. A. Mey.的干燥根和根莖、多孔菌科真菌茯苓(Schw.) Wolf的干燥菌核、天南星科植物石菖蒲Schott.的干燥根莖、遠志科植物遠志Willd.的干燥根。
1.3 藥品與試劑
鹽酸美金剛片(批號797818)購自丹麥靈北藥廠;Aβ1-40抗體(批號GB11307)、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體(批號GB11096)、離子鈣接頭結合調節分子-1(ionized calcium binding adaptor molecule-1,Iba-1)抗體(批號GB11105)、HRP標記的山羊抗兔IgG抗體(批號GB11206)均購自武漢塞維爾生物科技有限公司;小鼠腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)ELISA試劑盒、小鼠白細胞介素-6(interleukin-6,IL-6)ELISA試劑盒、小鼠IL-1β ELISA試劑盒、小鼠乙酰膽堿(acetylcholine,Ach)ELISA試劑盒均購自上海藍基生物科技有限公司;PBS溶液、蘇木素-伊紅(HE)染色試劑盒、多聚甲醛、二甲苯與中性樹膠均購自武漢賽維爾生物科技有限公司;3%雙氧水、無水乙醇、丙酮均購自北京化工廠。
1.4 儀器
63031型水迷宮實驗設備(深圳市瑞沃德生命科技有限公司);3K15型低溫高速離心機(美國Sigma公司);超低溫冰箱(美國Thermo Fisher Scientific公司);Bio-Gen PRO200勻漿儀(美國PRO Scientific公司);Pannoramic scan全自動切片掃描儀(匈牙利3DHistech公司);SpectraMax Plus 385全波長酶標儀(美國Molecular Devices公司);UC7超薄切片機(德國Leica公司);E100顯微鏡(日本Nikon公司)。
2 方法
2.1 開心散的制備
將開心散的4味藥材飲片粉碎,過24目篩得中藥粗粉。按原方比例[9-12](人參、遠志、石菖蒲、茯苓為1∶1∶25∶50),稱取藥材粉末適量,加入12倍量70%乙醇,浸泡0.5 h,加熱回流提取2 h,濾過;濾渣繼續用10倍量70%乙醇回流提取1 h,濾過,合并2次濾液,減壓回收乙醇,于真空干燥箱干燥,得到開心散醇提物,4 ℃保存。取適量開心散醇提物干粉,用0.5%羧甲基纖維素鈉(CMC-Na)溶液配制一定質量濃度的開心散藥液,經高效液相色譜法(HPLC)測定,開心散中含遠志𠮿酮III 9.3 μg/g、3,6′-二芥子酰基蔗糖102.0 μg/g、α-細辛醚97.1 μg/g、β-細辛醚1033.0 μg/g、去氫土莫酸298.0 μg/g、茯苓酸410.0 μg/g、松苓新酸11.7 μg/g。
2.2 動物分組與給藥
將雄性APP/PS1小鼠隨機分為模型組、美金剛(3.33 mg/kg)組和開心散低、中、高劑量(0.33、1.00、3.00 g/kg,以生藥量計)組,每組8只。以同月齡、相同遺傳背景的雄性C57BL/6J野生小鼠16只作為正常組,隨機分為對照組和對照給藥(開心散1.00 g/kg)組,每組8只。適應性飼養1周后,各給藥組ig相應藥物(10 mL/kg),模型組以及對照組ig等體積0.5% CMC-Na溶液,1次/d,連續2個月。給藥結束后,進行Morris水迷宮實驗[13]。
2.3 Morris水迷宮實驗
2.3.1 定位航行實驗 將平臺置于某一象限,第1~5天將小鼠分別從其他3個象限面向池壁放入水中,每日訓練3次,記錄小鼠入水后60 s內站上平臺所需時間,即逃逸潛伏期。小鼠找到平臺后使其在平臺上休息10 s,若規定時間內找不到平臺,則由操作者將其引導上平臺,使其在平臺上停留相同時間。
2.3.2 空間探索實驗 定位航行實驗結束24 h后,撤除平臺,將小鼠從同一入水點放入水中,記錄小鼠在60 s內的穿越平臺次數、平臺象限時間百分比和平臺象限路程百分比。
2.4 取材
水迷宮實驗結束后,小鼠吸入異氟烷麻醉后取血,用于血清炎癥因子的檢測。取血后每組隨機取3只小鼠心臟灌注4%多聚甲醛固定組織,制備腦組織石蠟包埋切片,分別進行HE染色、剛果紅染色和免疫組化實驗;每組剩余的5只小鼠取血后處死,斷頭取腦,冰上快速分離海馬和皮層,于液氮中快速冷凍,?80 ℃凍存,用于Ach檢測。
2.5 HE染色法觀察小鼠海馬CA1區神經元形態
取各組小鼠腦組織石蠟切片,通過常規脫蠟水化后,進行HE染色,中性樹膠封片,于光學顯微鏡下觀察海馬CA1區神經元形態并采集圖像,同時進行神經元計數。
2.6 剛果紅染色法檢測小鼠腦組織淀粉樣斑塊的表達
取各組小鼠腦組織石蠟切片,通過常規脫蠟水化后,進行剛果紅染色,中性樹膠封片,于光學顯微鏡下觀察并采集圖像。每個切片隨機選取多個不同視野,測定淀粉樣斑塊的吸光度()值。
2.7 免疫組化法檢測小鼠腦組織Aβ1-40、GFAP和Iba-1蛋白表達
取各組小鼠腦組織石蠟切片,常規脫蠟水化,抗原修復;放入3%雙氧水溶液孵育后血清封閉,滴加Aβ1-40、GFAP、Iba-1抗體,4 ℃孵育過夜;加入HRP標記的山羊抗兔IgG抗體,室溫孵育;滴加DAB顯色,中性樹膠封片,于光學顯微鏡下觀察并采集圖像。每個切片隨機選取多個不同視野,測定Aβ1-40、GFAP和Iba-1的值。
2.8 ELISA法檢測小鼠血清中炎癥因子以及皮層、海馬組織Ach水平
取各組小鼠血清,按照ELISA試劑盒說明書檢測炎癥因子TNF-α、IL-6和IL-1β水平。取各組小鼠的皮層和海馬組織,按照組織質量和體積(1∶9)加入PBS溶液,冰浴下勻漿,4 ℃、3000 r/min離心,分離上清液,按照ELISA試劑盒說明書檢測Ach水平。
2.9 數據分析
3 結果
3.1 開心散對APP/PS1小鼠學習記憶能力的影響
Morris水迷宮實驗結果見表1、2。在定位航行實驗中,各組小鼠逃逸潛伏期隨著訓練天數的增加整體呈下降趨勢。與對照組相比,對照給藥組小鼠的學習記憶能力無明顯差異;模型組小鼠在第2~5天的逃逸潛伏期明顯延長(<0.01)。與模型組相比,美金剛組小鼠在第3~5天的逃逸潛伏期明顯縮短(<0.05);開心散各劑量組小鼠的逃逸潛伏期均有所減少,其中開心散高劑量組小鼠在第3~5天的逃逸潛伏期明顯縮短(<0.05、0.01)。
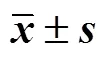
表1 各組小鼠定位航行實驗結果(, n = 8)
與對照組比較:#<0.05##<0.01;與模型組比較:*<0.05**<0.01,下表同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
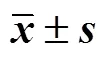
表2 各組小鼠空間探索實驗結果(, n = 8)
空間探索實驗結果表明,與對照組相比,模型組小鼠的穿越平臺次數、平臺象限時間百分比和平臺象限路程百分比均明顯減少(<0.05、0.01);與模型組相比,美金剛組小鼠的穿越平臺次數、平臺象限時間百分比和平臺象限路程百分比均明顯增加(<0.05);開心散各劑量組小鼠的穿越平臺次數、平臺象限時間百分比和平臺象限路程百分比均增加,其中開心散高劑量組具有顯著性差異(<0.05)。
3.2 開心散對APP/PS1小鼠海馬CA1區神經元損傷的影響
如圖1和表3所示,對照組和對照給藥組小鼠海馬CA1區神經元染色清楚且均勻,細胞排列整齊,細胞核呈圓形,核仁清晰。與對照組相比,模型組小鼠的海馬CA1區神經元數量明顯減少(<0.01),細胞排列較為分散,核固縮現象明顯,核仁不清晰;與模型組相比,美金剛組小鼠的海馬CA1神經元數量明顯增多(<0.01),神經元排列較為整齊,核固縮現象明顯改善;開心散各劑量組小鼠的海馬CA1區神經元數量均明顯增多(<0.01),神經元排列較為規則整齊,核固縮現象明顯得到改善。
3.3 開心散對APP/PS1小鼠腦組織淀粉樣斑塊表達的影響
如圖2所示,對照組和對照給藥組小鼠的皮層和海馬中均未檢測到陽性表達,在其他組小鼠的皮層和海馬則檢測到了呈彌散性分布的粉紅色陽性表達,即淀粉樣斑塊。分別對海馬和皮層中淀粉樣斑塊陽性表達的值進行半定量分析,結果見表4,與模型組相比,美金剛組和開心散中、高劑量組小鼠皮層中的淀粉樣斑塊均明顯減少(<0.01),但對海馬中淀粉樣斑塊的表達無明顯改善作用。

圖1 開心散對APP/PS1小鼠海馬CA1區神經元形態的影響 (HE, ×400)
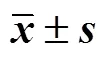
表3 開心散對APP/PS1小鼠海馬CA1區神經元數量的影響(, n = 3)

A-對照組 B-對照給藥組 C-模型組 D-美金剛組 E-開心散低劑量組 F-開心散中劑量組 G-開心散高劑量組 圖片從左至右依次為全腦 (×20)、皮層 (×630)、海馬(×100)、海馬局部放大圖(×630),黑色框標注局部放大區域,圖3~5同
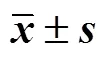
表4 開心散對APP/PS1小鼠腦組織淀粉樣斑塊表達的影響(, n = 3)
ND表示未檢測到
ND means not detected
3.4 開心散對APP/PS1小鼠腦組織Aβ1-40表達的影響
Aβ1-40陽性表達為棕褐色。如圖3和表5所示,與對照組相比,模型組小鼠的皮層和海馬中Aβ1-40陽性表達顯著增加(<0.01);與模型組相比,美金剛組小鼠的皮層和海馬中Aβ1-40陽性表達明顯減少(<0.05),開心散各劑量組小鼠皮層和海馬中Aβ1-40陽性表達均有所減少,其中開心散低、中劑量組皮層Aβ1-40陽性表達具有顯著性差異(<0.05),開心散中、劑量組海馬中Aβ1-40陽性表達具有顯著性差異(<0.05)。

圖3 開心散對APP/PS1小鼠腦組織Aβ1-40表達的影響
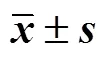
表5 開心散對APP/PS1小鼠腦組織Aβ1-40表達的影響(, n = 3)
3.5 開心散對APP/PS1小鼠腦組織GFAP表達的影響
各組小鼠皮層和海馬星形膠質細胞活化標志物GFAP的免疫組化實驗結果見圖4和表6,陽性表達為棕褐色。與對照組相比,模型組小鼠皮層和海馬中GFAP表達明顯增加(<0.01);與模型組相比,美金剛組小鼠皮層中GFAP表達明顯減少(<0.01),開心散中劑量組海馬和皮層中的GFAP表達均明顯降低(<0.01)。

圖4 開心散對APP/PS1小鼠腦組織GFAP表達的影響
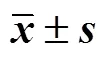
表6 開心散對APP/PS1小鼠腦組織GFAP表達的影響(, n = 3)
3.6 開心散對APP/PS1小鼠腦組織Iba-1表達的影響
各組小鼠皮層和海馬小膠質細胞活化標志物Iba-1的免疫組化實驗結果見圖5和表7,陽性表達為棕褐色。與對照組相比,模型組小鼠皮層和海馬中Iba-1的表達明顯增加(<0.05、0.01);與模型組相比,美金剛組小鼠海馬中Iba-1的表達明顯減少(<0.05),開心散中劑量組海馬和皮層中Iba-1表達顯著降低(<0.05、0.01)。
3.7 開心散對APP/PS1小鼠血清炎癥因子水平的影響
如表8所示,與對照組相比,模型組小鼠血清中TNF-α、IL-1β和IL-6水平均明顯升高(<0.05、0.01);與模型組相比,美金剛組和開心散高劑量組小鼠血清中TNF-α、IL-1β和IL-6水平均明顯降低(<0.05、0.01),開心散中劑量組小鼠血清中TNF-α水平明顯降低(<0.05)。

圖5 開心散對APP/PS1小鼠腦組織中Iba-1表達的影響
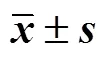
表7 開心散對APP/PS1小鼠腦組織Iba-1表達的影響(, n = 3)
3.8 開心散對APP/PS1小鼠皮層和海馬中Ach水平的影響
如表9所示,與對照組相比,模型組小鼠皮層和海馬中Ach水平均明顯下降(<0.01);與模型組相比,美金剛組和開心散中劑量組小鼠皮層中Ach水平明顯升高(<0.01)。
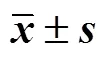
表8 開心散對APP/PS1小鼠血清中炎癥因子水平的影響(, n = 8)
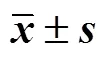
表9 開心散對APP/PS1小鼠皮層和海馬中Ach水平的影響(, n = 5)
4 討論
AD在中醫學屬“呆病”“健忘”“虛勞”等范疇。歷代中醫醫家對老年癡呆疾病的癥狀、病因和病機等都有著全面而深刻的認識,在疾病的治療上多從補氣、益智、安神等方面用藥[14-15]。開心散始載于唐代孫思邈《備急千金要方·卷十四》,為益智方劑,“主好忘”,由“遠志、人參各4分,茯苓2兩,石菖蒲1兩”組成。方中人參具有補氣固脫、寧心益智之功效;遠志具有安神益智、祛痰、消腫之功效;茯苓具有寧心安神、利水滲濕之功效;石菖蒲具有醒神益智、開竅豁痰之功效[16]。從數據挖掘角度分析中醫藥治療健忘和癡呆的用藥規律,人參、遠志、茯苓和石菖蒲均為高頻使用中藥,故可認為開心散治療老年性癡呆具有歷史淵源且是治療老年癡呆的基礎方[17-18],其治療老年癡呆的作用機制值得進一步的研究與探索。
AD的發病機制復雜,涉及多個病理環節。Aβ在腦內沉積是AD主要的發病機制之一[19-20]。Aβ在腦內生成過剩,不能及時得到清除,繼而在神經細胞外大量聚集形成淀粉樣斑塊,引發神經炎癥、神經元變性等一系列病理變化,最終導致患者的認知和記憶能力下降[21]。本研究結果顯示,5月齡APP/PS1小鼠皮層和海馬中均出現彌散分布的淀粉樣斑塊,Aβ1-40表達與對照組相比明顯增多。給藥2個月后,中、高劑量開心散可使APP/PS1小鼠皮層中淀粉樣斑塊表達明顯降低,低、中劑量開心散可使APP/PS1小鼠皮層中Aβ1-40表達明顯降低,中、高劑量開心散可使APP/PS1小鼠海馬中Aβ1-40表達明顯降低。結果表明,開心散對APP/PS1皮層和海馬中的Aβ沉積具有一定的改善作用,可能通過降低Aβ1-40表達發揮作用。
神經炎癥也是AD的發病機制之一[22-23]。神經炎癥反應主要由腦組織中的免疫細胞異常激活介導,星形膠質細胞和小膠質細胞是腦中主要負責免疫調節的細胞,GFAP和Iba-1分別是星形膠質細胞和小膠質細胞活化的標志物[24-25]。研究表明,開心散具有降低AD小鼠腦組織和血清中炎癥因子水平[26-27]以及通過調控中樞神經炎癥系統、抗抑郁的作用[28-29],但未見開心散在APP/PS1小鼠的抗炎作用報道。本研究結果顯示,5月齡APP/PS1小鼠皮層和海馬中GFAP和Iba-1表達異常增加,出現星形膠質細胞和小膠質細胞異常活化,血清中炎癥因子TNF-α、IL-1β和IL-6水平增加。中劑量開心散可明顯降低APP/PS1小鼠皮層和海馬中GFAP和Iba-1表達,并降低血清中IL-1β水平;高劑量開心散可明顯降低血清中TNF-α、IL-1β和IL-6水平,表明開心散可緩解星形膠質細胞和小膠質細胞的異常活化,抑制炎癥因子TNF-α、IL-1β和IL-6的大量釋放。
在AD的病理過程中,炎癥反應與Aβ沉積密切相關。Aβ沉積可誘導膠質細胞過度激活[30-31]。小膠質細胞過度激活導致促炎因子大量釋放,對Aβ的清除減少[32];星形膠質細胞被激活后表現出神經毒性作用,促使炎性介質釋放增加,導致神經變性和突觸丟失,加劇認知障礙[33],從而形成惡性循環。開心散具體通過哪些作用靶點和通路抑制膠質細胞活化、炎癥反應和Aβ沉積,有待進一步深入研究。
此外,有研究表明膽堿能異常與Aβ異常沉積之間存在緊密聯系,膽堿能缺失可能促進Aβ和tau的病理改變,從而導致認知功能障礙[34]。腦內的Ach主要來源于皮層和基底前腦的膽堿能神經元,在學習記憶與認知功能中起重要作用。FDA批準上市的AD治療藥物主要是膽堿酯酶抑制劑,它們通過抑制Ach水解從而增加腦內Ach水平。本研究結果顯示,5月齡APP/PS1小鼠腦組織的皮層和海馬腦區均出現Ach水平下降,開心散給藥2個月后,中劑量開心散可明顯提高大腦皮層中的Ach水平,提示開心散可能通過增加Ach的含量發揮改善學習記憶的功能。
綜上所述,本研究發現開心散給藥2個月可改善APP/PS1小鼠的學習記憶能力,其作用機制為通過抑制星形膠質細胞和小膠質細胞活化,降低血清中炎癥因子TNF-α、IL-6、IL-1β水平,改善神經炎癥,降低Aβ的含量,提高神經遞質Ach水平,從而發揮對神經元的保護作用。
利益沖突 所有作者均聲明不存在利益沖突
[1] Knopman D S, Amieva H, Petersen R C,. Alzheimer disease [J]., 2021, 7(1): 1-21.
[2] Scheltens P, De Strooper B, Kivipelto M,. Alzheimer’s disease [J]., 2021, 397(10284): 1577-1590.
[3] Graff-Radford J, Yong K X X, Apostolova L G,. New insights into atypical Alzheimer’s disease in the era of biomarkers [J]., 2021, 20(3): 222-234.
[4] Leng F D, Edison P. Neuroinflammation and microglial activation in Alzheimer disease: Where do we go from here? [J]., 2021, 17(3): 157-172.
[5] 唐·孫思邈撰, 魯兆麟主校. 備急千金要方 [M]. 沈陽: 遼寧科學技術出版社, 1997: 222.
[6] Yi P J, Zhang Z Y, Huang S Q,. Integrated meta-analysis, network pharmacology, and molecular docking to investigate the efficacy and potential pharmacological mechanism of Kai-Xin-San on Alzheimer’s disease [J]., 2020, 58(1): 932-943.
[7] Wang N, Jia Y M, Zhang B,. Neuroprotective mechanism of Kai Xin San: Upregulation of hippocampal insulin-degrading enzyme protein expression and acceleration of amyloid-beta degradation [J]., 2017, 12(4): 654-659.
[8] 李牧函, 張靜, 趙潤清, 等. 6首開心散類方對阿爾茲海默病模型小鼠的藥理作用及機制研究 [J]. 中國中藥雜志, 2016, 41(7): 1269-1274.
[9] Cao C, Xiao J Y, Liu M Q,. Active components, derived from Kai-Xin-San, a herbal formula, increase the expressions of neurotrophic factor NGF and BDNF on mouse astrocyte primary cultures via cAMP-dependent signaling pathway [J]., 2018, 224: 554-562.
[10] Zhu Y, Chao C, Duan X Z,. Kai-Xin-San series formulae alleviate depressive-like behaviors on chronic mild stressed mice via regulating neurotrophic factor system on hippocampus [J]., 2017, 7(1): 1467.
[11] Zhu Y, Duan X Z, Cheng X X,. Kai-Xin-San, a standardized traditional Chinese medicine formula, up-regulates the expressions of synaptic proteins on hippocampus of chronic mild stress induced depressive rats and primary cultured rat hippocampal neuron [J]., 2016, 193: 423-432.
[12] Smriga M, Saito H, Nishiyama N. Hoelen (Wolf) and ginseng (C. A. Meyer), the ingredients of a Chinese prescription DX-9386, individually promote hippocampal long-term potentiation[J]., 1995, 18(4): 518-522.
[13] Vorhees C V, Williams M T. Morris water maze: Procedures for assessing spatial and related forms of learning and memory [J]., 2006, 1(2): 848-858.
[14] 易婭靜, 于穎, 劉旭, 等. 中醫藥治療阿爾茲海默病研究進展 [J]. 中醫藥學報, 2021, 49(4): 99-105.
[15] 宋克立, 劉源香. 中醫治療阿爾茨海默病研究進展 [J]. 西部中醫藥, 2019, 32(4): 148-151.
[16] 王海霞, 姜寧, 呂靜薇, 等. 開心散抗抑郁、改善學習記憶作用及機制研究進展 [J]. 中草藥, 2020, 51(14): 3802-3813.
[17] 紀榮芳, 牛建昭, 許樹強, 等. 從數據挖掘角度看中醫藥治療健忘與癡呆 [J]. 中日友好醫院學報, 2006, 20(6): 337-340.
[18] 蘆錳, 周雨慧, 李曉寧, 等. 基于數據挖掘中醫藥治療阿爾茨海默病用藥規律研究 [J]. 中國中藥雜志, 2021, 46(6): 1558-1563.
[19] Busche M A, Hyman B T. Synergy between amyloid-β and tau in Alzheimer’s disease [J]., 2020, 23(10): 1183-1193.
[20] Greenberg S M, Bacskai B J, Hernandez-Guillamon M,. Cerebral amyloid angiopathy and Alzheimer disease- one peptide, two pathways [J]., 2020, 16(1): 30-42.
[21] Panza F, Lozupone M, Logroscino G,. A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease [J]., 2019, 15(2): 73-88.
[22] Kwon H S, Koh S H. Neuroinflammation in neurodegenerative disorders: The roles of microglia and astrocytes [J]., 2020, 9(1): 42.
[23] Ransohoff R M. How neuroinflammation contributes to neurodegeneration [J]., 2016, 353(6301): 777-783.
[24] Taipa R, Ferreira V, Brochado P,. Inflammatory pathology markers (activated microglia and reactive astrocytes) in early and late onset Alzheimer disease: A post mortem study [J]., 2018, 44(3): 298-313.
[25] Price B R, Johnson L A, Norris C M. Reactive astrocytes: The nexus of pathological and clinical hallmarks of Alzheimer’s disease [J]., 2021, 68: 101335.
[26] 師冉, 季旭明, 董麗雪, 等. 開心散對快速老化癡呆小鼠SAMP8炎癥因子及β-APP影響隨機平行對照研究 [J]. 實用中醫內科雜志, 2013, 27(13): 101-104.
[27] Guo S, Wang J, Wang Y,. Study on the multitarget synergistic effects of Kai-Xin-San against Alzheimer’s disease based on systems biology [J]., 2019, 2019: 1707218.
[28] Qu S, Liu M, Cao C,. Chinese medicine formula Kai-Xin-San ameliorates neuronal inflammation of CUMS-induced depression-like mice and reduces the expressions of inflammatory factors via inhibiting TLR4/IKK/NF-κB pathways on BV2 cells [J]., 2021, 12: 626949.
[29] Cao C, Liu M, Qu S,. Chinese medicine formula Kai-Xin-San ameliorates depression-like behaviours in chronic unpredictable mild stressed mice by regulating gut microbiota-inflammation-stress system [J]., 2020, 261: 113055.
[30] Kaur D, Sharma V, Deshmukh R. Activation of microglia and astrocytes: A roadway to neuroinflammation and Alzheimer’s disease [J]., 2019, 27(4): 663-677.
[31] Milà-Alomà M, Salvadó G, Gispert J D,. Amyloid beta, tau, synaptic, neurodegeneration, and glial biomarkers in the preclinical stage of the Alzheimer’s continuum [J]., 2020, 16(10): 1358-1371.
[32] Krasemann S, Madore C, Cialic R,. The TREM2-APOE pathway drives the transcriptional phenotype of dysfunctional microglia in neurodegenerative diseases [J]., 2017, 47(3): 566-581.
[33] Arranz A M, De Strooper B. The role of astroglia in Alzheimer’s disease: Pathophysiology and clinical implications [J]., 2019, 18(4): 406-414.
[34] Ramos-Rodriguez J J, Pacheco-Herrero M, Thyssen D,. Rapid β-amyloid deposition and cognitive impairment after cholinergic denervation in APP/PS1 mice [J]., 2013, 72(4): 272-285.
Pharmacological effects of Kaixin San on neuroinflammation and Aβ deposition in APP/PS1 mice
WANG Bin-bin, FENG Xiao-xiao, Entzal Berk, ZHAO Hui, LI Zhao-xia
Beijing Key Laboratory of TCM Collateral Disease Theory Research, School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China
To study the pharmacological effects of Kaixin San (開心散) on Alzheimer’s disease (AD) aninal model, amyloid precursor protein/presenilin 1 (APP/PS1) double transgenic mice.Three-month-old male APP/PS1 mice were randomly divided into model group, memantine group (3.33 mg/kg), low-, medium- and high-dose Kaixin San (0.33, 1.00, 3.00 g/kg) groups. C57BL/6J mice with the same genetic background of same month age were used as control group and control administration (Kaixin San 1.00 g/kg) group, with eight mice in each group. After continuous ig administration for two months, the learning and memory ability of mice was evaluated by Morris water maze test; Hematoxylin-eosin (HE) staining method was used to observe the neuron morphology in hippocampus CA1 area; Congo red staining was used to detect amyloid plaques expression in cortex and hippocampus; Immunohistochemical staining was used to detect amyloid β protein 1-40 (Aβ1-40), glial fibrillary acidic protein (GFAP) and ionized calcium binding adaptor molecule-1 (Iba-1) expressions in cortex and hippocampus; ELISA was used to detect the levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-6 in serum and acetylcholine (Ach) level in cortex and hippocampus.Compared with model group, learning and memory ability of mice in memantine group and Kaixin San group was significantly improved (< 0.05, 0.01), number of neurons in hippocampal CA1 area was increased (< 0.01); Expressions of amyloid plaques, Aβ1-40, GFAP and Iba-1 in cortex and hippocampus were significantly reduced (< 0.05, 0.01); Levels of TNF-α, IL-1β and IL-6 in serum were significantly reduced (< 0.05, 0.01); Ach level in cortex was increased (< 0.01).Kaixin San may prevent and treat AD by inhibiting the activation of astrocytes and microglia, decreasing the levels of inflammatory factors TNF-α, IL-6 and IL-1β in serum, reducing the production of Aβ and amyloid plaques, and increasing the content of Ach.
Kaixin San; Alzheimer’s disease; APP/PS1 double transgenic mice; amyloid β protein; glial fibrillary acidic protein; ionized calcium binding adaptor molecule-1
R285.5
A
0253 - 2670(2021)24 - 7511 - 09
10.7501/j.issn.0253-2670.2021.24.013
2021-09-03
北京市自然科學基金面上項目(7182019)
王彬斌,碩士研究生,研究方向為中藥體內過程和作用機制研究。E-mail: missbin1996@163.com
李朝霞,副教授,研究方向為中藥體內過程和作用機制研究。E-mail: gmacli@ccmu.edu.cn
[責任編輯 李亞楠]

