具有線粒體靶向性的雷公藤甲素TPP-PEG-PCL脂質體的制備及其促肝腫瘤細胞凋亡研究
王 鋒,張 超,鄭 栓
具有線粒體靶向性的雷公藤甲素TPP-PEG-PCL脂質體的制備及其促肝腫瘤細胞凋亡研究
王 鋒1,張 超2*,鄭 栓1
1. 駐馬店中心醫院,河南 駐馬店 463000 2. 河南中醫藥大學研究生學院,河南 鄭州 450046
成功制備雷公藤甲素(3-丙羧基)三苯基溴化膦(TPP)-聚乙二醇-b-聚己內脂(PEG-PCL)脂質體(Tr@TPP/Lip),評價其靶向性及促肝腫瘤細胞凋亡效果。采用正交試驗優選Tr@TPP/Lip的制備工藝,再研究該載藥系統的粒徑、Zeta電位、載藥量、包封率和多分散系數及透射電鏡微觀形態,評價Tr@TPP/Lip的穩定性、溶血性、釋放情況;采用熒光試驗,研究脂質體與肝腫瘤細胞的融合情況、線粒體靶向性和肝臟靶向性;在等劑量給藥條件下,評價Tr@TPP/Lip促肝癌細胞凋亡效果。正交試驗優選的Tr@TPP/Lip粒徑為(113.5±17.6)nm,Zeta電位(12.6±0.7)mV,包封率為(71.3±3.2)%,載藥量為(3.9±1.1)%,多分散系數為0.12±0.04;透射電子顯微鏡圖片顯示Tr@TPP/Lip呈規則圓球形,該脂質體穩定性良好,具有較小的溶血率和良好的緩釋藥物性能;熒光試驗結果顯示,TPP陽離子能促進脂質體與腫瘤細胞的融合,并靶向線粒體,還能提高藥物在肝腫瘤部位的靶向和滯留效果;細胞藥效結果顯示,Tr@TPP/Lip具有良好的促肝腫瘤細胞凋亡效果,能明顯降低線粒體膜Zeta電位、增加細胞內活性氧水平和Caspase-3的釋放,顯著增加促凋亡蛋白Bcl-2、減少抗凋亡Bax蛋白的表達,這些細胞凋亡試驗結果均明顯優于雷公藤甲素普通脂質體和雷公藤甲素。Tr@TPP/Lip具有較好的線粒體靶向功能,能增強藥物促肝腫瘤細胞凋亡效果。
雷公藤甲素;正交試驗;細胞凋亡;TPP-PEG-PCL;線粒體靶向;脂質體;肝腫瘤;溶血性;緩釋;活性氧;Caspase-3;Bcl-2;Bax
肝癌是臨床上常見的惡性腫瘤之一,死亡率在惡性腫瘤中位居第3位,目前開展的治療策略有手術切除、肝動脈栓塞、肝移植、化療及中藥聯合治療等[1-2]。傳統的化療容易帶來高復發、多藥耐藥和嚴重的不良反應等,故很多晚期肝癌患者治療效果并不滿意[3]。
中藥具有多成分、多靶點聯合治療的優勢,目前正逐漸成為治療肝癌新的研究方向[4-5]。雷公藤甲素(triptolide,Tr)是從衛矛科雷公藤屬植物雷公藤Hook. f.中分離得到的二萜三環氧化物,目前,發現它對肝癌、胰腺癌、子宮癌和膽管癌等多種惡性腫瘤均具有很好的療效[6-7]。大量研究證實,Tr可以通過調控細胞線粒體相關因子,引起線粒體生物功能改變,升高細胞內活性氧(reactive oxygen species,ROS)水平[8-9],誘導腫瘤細胞凋亡[10-11]。但該藥物分子存在水溶性差和毒性大等問題[12],嚴重限制了該藥物在臨床上的應用。因此,有必要構建一種新型藥物載體,增強Tr的水溶性,降低該藥物的毒副作用,同時精準將藥物遞送到腫瘤部位的線粒體,充分發揮制劑減毒增效的優勢,將來更好的用于肝癌的治療。
脂質體可將藥物包載于磷脂雙分子層內而形成微型泡囊體,不僅能明顯增強藥物的水溶性,改善藥物的生物相容性,還能通過高分子材料的進一步修飾,增強脂質體的靶向性,目前已廣泛應用于腫瘤藥物的靶向遞送[13]。(3-丙羧基)三苯基溴化膦[(3-carboxypropyl) triphenylphosphonium bromide,TPP]屬于陽離子,容易被帶負電荷線粒體膜所吸引,常用來介導腫瘤藥物載體靶向遞送至線粒體,提高藥物的選擇性,發揮細胞器靶向給藥的優勢,增強藥物的抗腫瘤效果[14-15]。因此,本研究在文獻報道[16]的基礎上,擬采用TPP陽離子修飾脂質體,預設計將Tr遞送到肝癌細胞線粒體的雷公藤甲素TPP-PEG-PCL脂質體(Tr@TPP/Lip),精確調節線粒體功能,增強藥物促腫瘤細胞凋亡效果。
1 材料與儀器
1.1 試藥
Tr原料藥,質量分數≥98%,批號20201107,成都德思特生物科技有限公司;大豆磷脂,批號20200711,德國Lipoid公司;膽固醇,質量分數≥95%,批號20201108,北京百靈威科技有限公司;氨基聚乙二醇聚己內酯高分子聚合物(PCL-PEG- NH2),PEG相對分子質量2000,質量分數≥90%,批號20191205,西安瑞禧生物科技有限公司;香豆素6熒光染料(coumarin 6,C6),質量分數≥90%,批號20200917,西格瑪奧德里奇(上海)貿易有限公司;DIR熒光染料,批號20201022,蘇州宇恒生物科技有限公司;線粒體熒光染料(MitoTracker? Red),批號20201009,上海聯邁生物工程有限公司;細胞核Hoechst 33258染料,批號20201117,上海碧云天生物技術有限公司;TPP(批號20201022)、1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC?HCl,批號20200917),上海麥克林生化科技有限公司;-羥基丁二酰亞胺(NHS),批號20201106,上海共價化學科技有限公司;甲醇、乙腈,色譜級,美國Fisher化學試劑公司。
1.2 細胞株、培養基及動物
人肝癌細胞株SMMC-7721,中科院上海細胞生物學研究所;美國Gibco 16000-044胎牛血清,特級FBS,上海聯碩生物科技有限公司;BALB/c nude(裸鼠),河南中醫藥大學動物實驗中心。所有動物實驗遵循河南中醫藥大學有關實驗動物管理和使用的規定,均符合3R原則。
1.3 儀器
Zetasizer Nano ZSP納米粒度Zeta電位儀,英國馬爾文公司;OLS5000型激光共聚焦顯微鏡,奧林巴斯北京銷售有限公司;JEM-2100型透射電子顯微鏡(TEM),日本電子株式會社;TG19型臺式高速離心機,上海盧湘儀離心機儀器有限公司;ESJ60-5A型電子分析天平,上海精密儀器有限公司;Aglient 1200高效液相色譜儀,安捷倫科技(中國)有限公司;Multiskan SkyHigh型全波長酶標儀,賽默飛世爾科技公司。
2 方法與結果
2.1 TPP-PEG-PCL的合成
精密稱取80 mg TPP、75 mg EDC、70 mg NHS置于10 mL二孔圓底燒瓶中,加入3 mL二氯甲烷促使三者溶解,添加30 μL三乙胺,向其中一孔通入氬氣,然后再用塞子堵住另一孔,室溫下攪拌5 h,然后加入120 mg PCL-PEG-NH2,再添加2 mL二氯甲烷,室溫繼續攪拌過夜,然后將其轉移到透析袋(截留相對分子質量3000)中透析12 h,純化樣品,最后將透析袋中內容物轉移至燒杯中,進行冷凍干燥,即可獲得TPP-PEG-PCL。經1H-NMR(圖1)驗證,化學位移7~8的為TPP陽離子的3個聯苯峰,化學位移3.5為PEG的單甲醚特征峰,化學位移1.2為PCL烷基氫特征峰,由此表明,TPP-PEG-PCL已經成功合成。

圖1 1H-NMR驗證TPP-PEG-PCL的合成
2.2 Tr@TPP/Lip的制備
精密稱取Tr 30 mg、大豆磷脂和膽固醇適量,TPP-PEG-PCL 20 mg,置于茄型瓶中,加入20 mL色譜甲醇促進溶解,使用旋轉蒸發儀設置適量轉速減壓濃縮成膜除去有機溶劑,然后再冷凍干燥過夜,盡量除去殘留有機溶劑,加入適量的蒸餾水或磷酸鹽緩沖液(phosphate buffer saline,PBS),于適量溫度水浴輕微振搖30 min進行水化,再超聲處理5 min,促進脂質體分散,然后過0.22 μm微孔濾膜,再轉移到Avanti脂質體擠壓器中,以100 nm的膜來回擠壓20次左右,即可獲得粒徑均勻分布的Tr@TPP/Lip溶液。
2.3 粒徑分布、Zeta電位測定和TEM分析
吸取Tr@TPP/Lip,采用蒸餾水稀釋10倍左右,以Zetasizer Nano ZS納米粒度Zeta電位儀測定粒徑、Zeta電位分布;采用移液槍吸取大約100 μL Tr@TPP/Lip,滴加在200目銅網上,采用洗耳球吹干,再滴加微量0.5%磷鎢酸進行復染,低溫吹干溶液,在TEM下觀察脂質體的微觀形態。
2.4 包封率及載藥量測定
2.4.1 色譜條件[17]Phenomenex Hyper Clore BDS C18分析柱(250 mm×4.6 mm,5 μm);柱溫為30 ℃;流動相為乙腈-水(33∶67);體積流量為1 mL/min,檢測波長為218 nm;進樣體積為10 μL。
2.4.2 包封率和載藥量測定 吸取Tr@TPP/Lip溶液500 μL,置于超濾離心管(截留相對分子質量3000)中,以15 000 r/min高速離心10 min,將離心管外游離的藥物定容到5 mL,即為外,將最初吸取的500 μL Tr@TPP/Lip溶液也定容到5 mL,即為總,采用HPLC測定以上樣品中Tr的含量,按照公式計算包封率。
將離心管內的藥物進行冷凍干燥成粉末,精密稱定質量,再采用HPLC測定凍干后脂質體中Tr含量,計算載藥量。
包封率=(總-外)/總
載藥量=內/
外為離心后游離Tr質量,總為脂質體中Tr質量,內為離心后脂質體中Tr質量,為Tr@TPP/Lip質量
2.5 正交試驗優選Tr@TPP/Lip的制備工藝
按表1設定的因素、水平設計正交試驗,考察脂質體制備工藝研究中大豆卵磷脂和膽固醇投料比(A)、旋轉轉速(B)、水化溫度(C)這3個因素,以脂質體粒徑、包封率和載藥量為指標,參照文獻方法進行綜合評分[11],滿分為100分,粒徑占50%,以最小粒徑者為滿分50分,包封率和載藥量各占25%,以最高包封率和載藥量為滿分25分,優選Tr@TPP/Lip制備過程中的上述考察因素,結果如表1顯示,方差分析結果見表2,極差結果提示,3個因素對結果影響的大小順序為A>C>B,最終優選的條件為A2B3C2,即大豆卵磷脂和膽固醇投料比例為80∶35,轉速為110 r/min,水化溫度為40 ℃。
綜合評分=粒徑最小值/粒徑×50+載藥量/載藥量最大值×25+包封率/包封率最大值×25
2.6 Tr@TPP/Lip的形態表征
采用上述優選的工藝條件,制備3批Tr@TPP/ Lip,按照“2.3”項方法進行測定,結果見圖2。Tr@ TPP/Lip的平均粒徑為(113.5±17.6)nm,Zeta電位為(12.6±0.7)mV;TEM圖顯示,Tr@TPP/Lip呈規則圓球形,分散性良好。Tr@TPP/Lip包封率為(71.3±3.2)%,載藥量為(3.9±1.1)%,多分散系數(PDI)為0.12±0.04。采用同樣質量的Tr、大豆磷脂和膽固醇,以薄膜水化法制備Tr普通脂質體(Tr@Lip)[18],經測定Tr@Lip的平均粒徑為(108.4±15.6)nm,Zeta電位為(?10.8±0.6)mV,包封率為(79.6±4.5)%,載藥量為(4.1±1.2)%,PDI為0.11±0.05。

表1 正交試驗設計及結果

表2 方差分析結果
0.01(2, 2)=99.00

圖2 Tr@TPP/Lip的粒徑分布(a)、Zeta電位(b) 和TEM圖(c)
2.7 穩定性考察
2.7.1 存儲穩定性試驗 將Tr@TPP/Lip于4 ℃冰箱中保存60 d,然后每隔10 d檢測該脂質體的粒徑、Zeta電位、載藥量和包封率。由表3可知,Tr@TPP/ Lip在放置60 d的粒徑、Zeta電位載藥量和包封率波動不大,基本與最初保持一致,由此表明,Tr@ TPP/Lip在4 ℃冰箱中穩定性良好。

表3 Tr@TPP/Lip的存儲穩定性
2.7.2 血清穩定性 將Tr@TPP/Lip與10%胎牛血清于37 ℃條件下進行孵育24 h,然后每隔4 h將其取出,采用15 000 r/min離心5 min,除去胎牛血清的干擾,吸取上清液檢測脂質體的粒徑、Zeta電位、載藥量和包封率。由表4可知,Tr@TPP/Lip在與血清孵育24 h期間,粒徑和Zeta電位變化也不明顯,粒徑比未孵育前的脂質體稍微增大,可能在檢測過程中有少量血清蛋白吸附所致,載藥量和包封率也未見明顯變化,由此提示,Tr@TPP/Lip在與血清孵育過程中能基本上保持固有的脂質體結果,穩定性良好。

表4 Tr@TPP/Lip血清穩定性
2.8 溶血試驗考察
吸取Tr@TPP/Lip適量體積,依次用PBS稀釋成質量濃度為800、400、200、100、50、25 ng/mL的系列溶液,將其等體積的10%紅細胞懸液混合,以生理鹽水為陰性對照,蒸餾水為陽性對照,放置于37 ℃生化培養箱中孵育2 h,然后將其取出,以2500 r/min離心5 min,下層為血細胞,采用移液槍吸取上層,轉移到96孔酶標板,于540 nm采用酶標儀測定吸光度(),計算溶血率,平行3份。結果見圖3,Tr@TPP/Lip和Tr@Lip溶血率都保持在5%以下。由此表明,Tr@TPP/Lip具有很好的血液相容性,溶血率相對較小。
溶血率=(樣品管值-陰性對照管值)/(陽性對照管值-陰性對照管值)
2.9 Tr@TPP/Lip的體外釋放
取Tr、Tr@Lip、Tr@TPP/Lip(三者均含200 μg Tr)分別置于Spectrum Labs透析袋(截留相對分子質量為3000)中,兩端以塑料夾封閉,將透析袋置于50 mL pH 7.4 PBS和pH 5 PBS緩沖液中,添加0.1%聚山梨酯80作為表面活性劑促進釋放出Tr的溶解,攪拌快速分散。設置水溫為37 ℃,采用磁力攪拌器,設置轉速為150 r/min,于預定時間點(2、4、8、10、12、24、36、48 h),采用移液槍吸取200 μL至進樣瓶中內襯管中,同時補充相應體積的PBS,檢測釋放的Tr含量,計算累積釋放率。實驗結果如圖4所示,pH 7.4 PBS條件下,游離Tr表現為快速釋放狀態,12 h釋放量達86%以上,Tr@TPP/ Lip和Tr@Lip最初釋放較快,后面釋放緩慢,由此表明,Tr@TPP/Lip具有較好的緩釋性能;pH 5.0 PBS條件下,Tr@TPP/Lip和Tr@Lip也表現為緩釋趨勢,但釋放速率明顯快于pH 7.4條件,鑒于腫瘤部位的酸性環境,有助于藥物在腫瘤部位的快速釋放,發揮藥物達到抗腫瘤效果。

圖3 Tr@TPP/Lip和Tr@Lip的溶血率
r=(eC+0C)/
r為藥物累積釋放率,e為PBS的置換體積,0為釋放介質總體積,C為第次置換取樣時釋放液的濃度,為納米粒子所載藥物總質量,為置換PBS的次數
2.10 細胞融合
考慮到Tr無熒光,本研究采用帶綠色熒光的C6作為表征藥物,按照上述方法載入脂質體中,獲得C6@Lip和C6@TPP/Lip。人肝癌細胞SMMC- 7721接種于12孔培養板中,將細胞在胎牛血清中進行培養24 h,然后與C6@Lip和C6@TPP/Lip共同孵育,其中C6在細胞培養液中的質量濃度為100 ng/mL,孵育時間為1、2 h,收集細胞,采用PBS多次洗滌除去吸附在細胞外的C6,然后吸取少量轉移至載玻片上,采用5%多聚甲醇進行固定,以1 mg/mL Hoechst 33342染細胞核(藍色)5 min,再置激光共聚焦顯微鏡下,觀察帶綠色的脂質體與細胞核的重合情況,以Image J數據軟件計算各組的泊桑分布值,由此判斷脂質體是否被細胞攝取。結果見圖5和表5。熒光結果(圖5)顯示,C6@TPP/Lip進入細胞后,能快速聚集在細胞核周圍,細胞核周圍呈明亮的綠色,明顯強于C6@Lip;表5泊桑分布數值結果也表明,C6@TPP/Lip顯著高于C6@ Lip,兩者存在顯著性差異。由此推斷,TPP陽離子能促進脂質體的細胞攝取,促進藥物載體與腫瘤細胞的融合,該實驗結果一方面取決于脂質體的磷脂雙分子層能與細胞膜很好的融合,另一方面借助于TPP陽離子的跨膜轉運[15],有助于增強藥物載體的細胞攝取。

圖4 Tr@TPP/Lip、Tr@Lip和Tr的體外釋放對比研究(,n = 3)
2.11 線粒體靶向
按照以上處理程序將人肝癌SMMC-7721細胞進行培養,采用C6@Lip和C6@TPP/Lip共同孵育2 h,然后將細胞取出,以5%多聚甲醇進行固定細胞,添加50 nmol/L MitoTracker?RED染線粒體(紅色)5 min,1 mg/mL Hoechst 33342染細胞核(藍色)5 min,然后置激光共聚焦顯微鏡下,觀察脂質體在細胞內的定位及分布情況,結果見圖6。帶綠色熒光的脂質體進入細胞后,與紅色線粒體重合后,變為黃色,C6@TPP/Lip的黃色面積明顯高于C6@Lip。采用Image J數據軟件計算2組的泊桑分布值,C6@ TPP/Lip(0.727±0.028)顯著高于C6@Lip(0.412±0.032),2組比較具有顯著性差異(<0.01)。據此推斷,TPP陽離子可以促進脂質體靶向線粒體。

圖5 不同時間點人肝癌細胞SMMC-7721與脂質體的融合情況

表5 C6@Lip和C6@TPP/Lip的泊桑分布值(,n = 3)
與C6@Lip組比較:**<0.01
**< 0.01C6@Lip group
2.12 肝腫瘤靶向
采用熒光染料DIR包載于脂質體中,制成DIR@TPP/Lip和DIR@Lip 2種脂質體,將人肝癌細胞SMMC-7721接種在裸鼠肝臟部位制成肝腫瘤模型,然后將DIR@TPP/Lip和DIR@Lip以尾靜脈的形式注射肝腫瘤模型裸鼠,采用小動物活體成像儀觀察給藥后8、24 h時肝臟部位的熒光強度,結果見圖7,DIR@TPP/Lip肝臟部位平均熒光強度明顯高于DIR@TPP/Lip,兩者存在顯著性差異,DIR@ TPP/Lip在24 h時,肝臟部位還有較強的熒光強度,具有一定的滯留效應。由此表明,TPP陽離子可以促進脂質體靶向聚集在肝臟部位,并且消除也相對較慢。

圖6 C6@TPP/Lip與C6@Lip的線粒體靶向性和泊桑分布系數

圖7 DIR@TPP/Lip與DIR@Lip在腫瘤模型體內的肝靶向性
2.13 腫瘤細胞凋亡
2.13.1 細胞培養 人肝癌細胞SMMC-7721接種于24孔培養皿中,(密度約為1×106個/mL),在37 ℃、5% CO2培養箱中進行培養。

表6 DIR@TPP/Lip與DIR@Lip肝臟平均熒光強度(,n = 3)
與DIR@Lip組比較:##<0.01
##< 0.01DIR@Lip group
2.13.2 細胞存活率測定 將藥物組Tr、Tr@Lip、Tr@TPP/Lip與人肝癌細胞SMMC-772共同孵育,并設定系列藥物濃度分別為10、30、50、70、90、130、170、210 nmol/L,平行3份樣品。孵育24 h,加入5 mg/mL MTT 100 μL,繼續避光孵育4 h,隨后加入150 μL二甲基亞砜,輕微振蕩10 min,采用酶標儀于570 nm波長下檢測各組的值,以PBS作為空白對照,按公式計算各組的細胞存活率,根據存活率擬合公式計算各組的計算半數抑制濃度(half maximal inhibitory concentration,IC50)。
細胞存活率=加藥組值/空白對照組值
試驗結果如表7所示,Tr@TPP/Lip對于腫瘤細胞的抑制效果最顯著,明顯優于Tr、Tr@Lip,尤其在高濃度下表現最為突出,經計算給藥組中Tr@ TPP/Lip的IC50最小,與其他2組比較存在顯著性差異,該實驗結果表明,TPP-PEG-PCL脂質體能明顯增強藥物的抗腫瘤細胞生長作用。
2.13.3 細胞凋亡率 將Tr、Tr@Lip、Tr@TPP/Lip與人肝癌細胞SMMC-772共同孵育,設定給藥劑量為80 nmol/L,孵育24 h后,采用流式細胞儀以Annexin V-FITC/PI雙染色法檢測腫瘤細胞凋亡率。以添加PBS(不含藥物)作為對照,其余同以上處理,通過統計軟件處理,計算各組的腫瘤細胞凋亡率(早期凋亡率和晚期凋亡率之和),結果見表8,Tr@TPP/Lip的腫瘤細胞凋亡率最高,與其余2組比較,均存在顯著性差異,由此表明,Tr@TPP/Lip具有很好的促腫瘤細胞凋亡效果。

表7 Tr@TPP/Lip、Tr@Lip與Tr的細胞存活率和IC50(,n = 3)
與Tr@Lip組比較:**<0.01;與Tr組比較:##<0.01
**< 0.01Tr@Lip group;##< 0.01Tr group
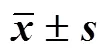
表8 Tr@TPP/Lip、Tr@Lip與Tr的腫瘤細胞凋亡率(,n = 3)
與Tr@Lip組比較:*<0.05;與Tr組比較:#<0.05
*< 0.05Tr@Lip group;#< 0.05Tr group
2.13.4 線粒體膜電位 將Tr、Tr@Lip、Tr@TPP/Lip與人肝癌細胞SMMC-772共同孵育,設定給藥劑量為80 nmol/L,孵育24 h后,加入2 μL JC-1(5 μg/mL)染色液,與細胞懸液均勻懸浮,繼續在37 ℃培養箱中孵育20 min,再以1500 r/min轉速離心5 min,收集細胞,用PBS洗滌2次,采用移液槍吸取200 μL細胞懸液,JC-1檢測試劑在正常細胞中發紅色熒光,在凋亡細胞中發綠色熒光,采用流式細胞儀檢測紅/綠熒光強度的比值可以定量檢測病變線粒體的比例。以添加PBS(不含藥物)作為對照,其余同以上處理。結果見表9,以對照組紅/綠熒光強度比值為基準,給藥組的該比值與對照組進行比較,Tr@TPP/Lip組的熒光比值最小,促進腫瘤細胞凋亡效果最顯著。
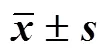
表9 Tr@TPP/Lip、Tr@Lip與Tr促肝腫瘤細胞凋亡的線粒體膜電位比值(,n = 3)
與Tr@Lip組比較:*<0.05;與Tr組比較:#<0.05,表10同
*< 0.05Tr@Lip group;#< 0.05Tr group, same as table 10
2.13.5 DCFH-DA染色檢測胞內ROS水平 將Tr、Tr@Lip、Tr@TPP/Lip與人肝癌細胞SMMC-772共同孵育,設定給藥劑量為80 nmol/L,孵育24 h后,加入濃度為10 μmol/L的2′,7′-二氯熒光黃雙乙酸鹽(DCFH-DA)孵育30 min,然后以PBS洗滌3次,除去細胞表面殘留的DCFH-DA,以流式細胞技術檢測各組DCF熒光的強度值,體現細胞內ROS水平。以添加PBS(不含藥物)作為對照,其余同以上處理。結果見表10,雷公藤甲素TPP-PEG-PCL預處理后,可以明顯提高細胞內ROS水平,激活線粒體信號通路,促進腫瘤細胞的大量凋亡。
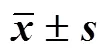
表10 Tr@TPP/Lip、Tr@Lip與Tr促肝腫瘤細胞凋亡的DCF熒光強度和Caspase-3活性(,n = 3)
2.13.6 Caspase-3活性 將Tr、Tr@Lip、Tr@TPP/ Lip與人肝癌細胞SMMC-772共同孵育,設定每孔中藥物濃度為80 nmol/L,孵育24 h后,棄去培養液。采用0.25%胰蛋白酶消化后并收集于離心管中,以5000 r/min離心5 min,除去上清液,然后加入60 μL裂解液混勻,冰浴30 min,再以12 000 r/min離心15 min,采用移液槍將上清液轉移至離心管中,加入50 μL檢測緩沖液,10 μL Ac-DEVD-pNA孵育12 h,以酶標儀于405 nm處測定值,體現Caspase-3活性。以添加PBS(不含藥物)作為對照,其余同以上處理。結果見表10,Tr@TPP/Lip干預腫瘤細胞后的Caspase活性最高,可推測TPP-PEG-PCL脂質體將較多的Tr遞送到線粒體,從而激活Caspase家族依賴細胞凋亡通路。
2.13.7 Western blotting分析 將人肝癌細胞SMMC-772接種于6孔板中(密度約為1×106個/mL)置于細胞培養箱中孵育24 h,待細胞生長到對數期,采用Tr、Tr@Lip、Tr@TPP/Lip與人肝癌SMMC-772細胞共同孵育,每孔中藥物濃度為80 nmol/L,對照組為含10%胎牛血清培養基取代藥物。
收集細胞,提取蛋白,以12% SDS-PAGE分離膠溶液進行電泳,100 V濕轉50 min,以5%牛血清白蛋白(bovine serum albumin,BSA)/三(羥甲基)氨基甲烷緩沖鹽溶液+聚山梨酯(Triethanolamine buffer saline + Tween,TBST)封閉液室溫下封閉1 h,TBST洗10 min,重復3次,加入一抗,采用TBST按照稀釋至適當濃度[B淋巴細胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相關X蛋白(Bcl-2 associated X,Bax)稀釋比例均為1∶1000)]孵育一抗,以β-actin(稀釋比例為1∶1000)作為內參,于4 ℃振蕩過夜,添加辣根過氧化物酶標記的二抗(稀釋比例為 1∶2000),再采用TBST每隔5 min清洗,重復3次,采用Image J圖像分析軟件進行各組的光密度。以添加PBS(不含藥物)作為對照,其余同以上處理。結果如圖8所示,Tr@TPP/Lip可以顯著提高促凋亡蛋白Bax表達,降低抗凋亡蛋白BCl-2表達,與其他2組比較,存在顯著性差異。根據該結果推測,Tr@TPP/Lip有助于將大量藥物遞送到腫瘤線粒體,激活細胞凋亡通路,從而引起凋亡蛋白Bax和BCl-2表達的改變。

與Tr@Lip組比較:**P<0.01;與Tr組比較:##P<0.01
3 討論
肝癌是我國發病率和致死率較高的惡性腫瘤之一,目前臨床上主要以手術切除、介入、射頻消融等,這些治療手段最終嚴重損傷患者的生理機能,5年生存率仍低于20%[19]。中醫藥基于“扶正驅邪”理念,不僅關注腫瘤生長抑制,還提高機體的免疫力,目前已成為腫瘤治療的新方向,目前已成為腫瘤治療的新方向[20]。雷公藤在中醫藥領域用藥歷史悠久,如常用的雷公藤片、雷公藤多苷片等。Tr是該藥用植物中提取的活性成分,在抗腫瘤方面相關分子機制較為成熟,以線粒體為中心,提高線粒體膜通透性,引起線粒體生物功能紊亂,從而促進腫瘤細胞凋亡。故構建一種線粒體靶向給藥系統,對于提高該藥抗腫瘤效果具有重大研究價值。
本研究采用生物相容性好的脂質體包載Tr,并以具有線粒體靶向功能的TPP陽離子進行修飾,成功制備了Tr@TPP/Lip,粒徑約為(113.5±17.6)nm,Zeta電位為(12.6±0.7)mV,透射電鏡圖片清晰直觀的發現Tr@TPP/Lip呈現規則圓球形,粒子大小與馬爾文粒徑檢測結果基本保持一致。穩定性試驗結果顯示,Tr@TPP/Lip在4 ℃放置60 d和37 ℃胎牛血清孵育過程中,納米粒子均能保持較好的粒子形態,載藥量和包封率也基本與最初差不多,由此表明Tr@TPP/Lip具有較好的穩定性。從Tr@TPP/ Lip制備的材料分析,大豆磷脂屬于天然磷脂,可自發形成良好的磷脂雙分子層,膽固醇還可以加強脂質體的流動性,TPP-PEG-PCL屬于雙親性高分子材料,恰好嵌合在磷脂雙分子層的親水和親脂層中,借助于高分子鏈狀結構加強脂質體的穩定性;磷脂雙分子層具有較強的電負性,能中和正電荷TPP陽離子,很大程度上減少TPP陽離子吸附電負性物質,加強脂質體的穩定性。另外,TPP陽離子具有較強的正電性,采用TPP-PEG-PCL修飾脂質體后,TPP陽離子鏈接的PEG鑲嵌在磷脂雙分子層親水層,PCL屬于親脂性材料則與脂質體的疏水層能較好的融合,而TPP陽離子類似靶標穿插于脂質體親水層表面,故Tr@TPP/Lip仍可保持正電勢,與文獻報道的一樣具有較強的靶向性[17]。紅細胞溶血結果顯示,Tr@TPP/Lip的溶血率基本5%以下,具有很好的血液相容性,可能是脂質體具有較好的生物相容性,包載藥物后能掩蓋藥物的免疫原性,減少藥物與紅細胞的直接接觸;體外釋放結果表明,Tr@TPP/Lip釋藥緩慢,有助于延長藥物的體內循環時間,將更多的藥物輸送到效應部位;細胞熒光試驗結果表明,TPP陽離子可促進TPP-PEG-PCL脂質體與腫瘤細胞的融合,還能有助于脂質體的跨膜轉運,突破線粒體膜的阻礙,靶向聚集在線粒體周圍,從而實現了藥物的線粒體靶向傳輸。目前大量文獻表明,鑒于細胞膜和線粒體膜均帶負電荷,故可吸引到正電荷的TPP陽離子,提高納米粒子靶向線粒體的能力達100~150倍,很大程度上克服高黏度細胞液的阻礙,促進藥物進入線粒體的效率,從而增強藥物的抗腫瘤效果[21-22]。小動物活體成像結果顯示,TPP陽離子能明顯提高脂質體的肝靶性效果,有助于將大部分藥物聚集在肝細胞部位,且具有良好的滯留效應,可能的原因是帶正電荷的Tr@TPP/Lip被帶負電荷的肝細胞膜所吸引,增強了藥物載體在肝臟部位的滯留。細胞藥效結果表明,Tr@TPP/Lip促肝腫瘤細胞凋亡的IC50濃度最小,等濃度下腫瘤細胞凋亡率最高,明顯優于Tr普通脂質體和Tr,存在顯著性差異;另外,Tr@TPP/Lip還可以顯著升高細胞內ROS水平和Caspase-3活性,降低線粒體膜Zeta電位,提高促凋亡蛋白Bax表達,明顯降低抗凋亡蛋白BCl-2表達,據此推測,TPP-PEG-PCL脂質體能促進藥物的跨膜轉運,并靶向腫瘤線粒體部位,故能很大程度上提高藥物促肝腫瘤細胞凋亡效果。盡管如此,文獻報告TPP陽離子修飾的靶向給藥系統在體內代謝過程中,容易被帶負電荷的血漿蛋白吸附的問題,從而影響藥物的靶向行為[23]。
本實驗成功制備了Tr@TPP/Lip,穩定性較好,具有良好的肝癌細胞線粒體靶向性,能明顯增強藥物促肝癌細胞凋亡效果。
利益沖突 所有作者均聲明不存在利益沖突
[1] 陳建國. 中國肝癌發病趨勢和一級預防 [J]. 臨床肝膽病雜志, 2012, 28(4): 256-260.
[2] 張楊, 游阿彬, 齊寒, 等. 負載化療藥物的外泌體對肝癌的靶向治療研究 [J]. 天津醫科大學學報, 2021, 27(3): 229-233.
[3] 于杉. 原發性肝癌化療栓塞風險的多因素分析 [J]. 中國醫藥指南, 2020, 18(12): 167-168.
[4] 曹建, 朱曉燃, 楊振寰, 等. 基于網絡藥理學探討清肝化瘀顆粒治療肝癌的作用機制 [J]. 中草藥, 2021, 52(7): 2039-2052.
[5] 宋娜, 吳施國, 謝星星, 等. 中藥干預肝癌及其疼痛的分子機制研究進展 [J]. 現代中醫藥, 2021, 41(4): 1-6.
[6] 宋基正, 劉宇靈, 林龍飛, 等. 雷公藤甲素抗腫瘤新型給藥系統研究進展 [J]. 中草藥, 2019, 50(5): 1269-1275.
[7] 黃宇, 馬全鑫, 凌云. 雷公藤甲素抗腫瘤藥理作用的研究進展 [J]. 藥物評價研究, 2018, 41(2): 328-333.
[8] You L, Dong X, Ni B,. Triptolide induces apoptosis through fas death and mitochondrial pathways in HepaRG cell line [J]., 2018, 9: 813.
[9] Liu X, Zhao P, Wang X,. Triptolide induces glioma cell autophagy and apoptosis via upregulating the ROS/JNK and downregulating the Akt/mTOR signaling pathways [J]., 2019, 9: 387.
[10] 宋慧娜. 線粒體靶向的雷公藤甲素衍生物的合成及其抗腫瘤活性研究 [D]. 濟南: 山東大學, 2020.
[11] 王曉菲. 雷公藤甲素通過線粒體途徑促進子宮內膜癌細胞凋亡的實驗研究 [D]. 南京: 南京醫科大學, 2013.
[12] 劉斌, 樊丹平, 舒海洋, 等. 雷公藤甲素毒性作用及減毒研究的整合探析 [J]. 中國實驗方劑學雜志, 2019, 25(20): 181-190.
[13] 馮宇飛, 常書源, 秦國昭, 等. 星點設計-效應面法優化pH值響應及線粒體靶向雙功能金絲桃苷脂質體的處方及其體外評價 [J]. 中草藥, 2020, 51(23): 5934-5942.
[14] Shao J, Li M, Guo Z,. TPP-related mitochondrial targeting copper (II) complex induces p53-dependent apoptosis in hepatoma cells through ROS-mediated activation of Drp1 [J]., 2019, 17(1): 149.
[15] Biswas S, Dodwadkar N S, Deshpande P P,. Liposomes loaded with paclitaxel and modified with novel triphenylphosphonium-PEG-PE conjugate possess low toxicity, target mitochondria and demonstrate enhanced antitumor effectsand[J]., 2012, 159(3): 393-402.
[16] 韓黎麗, 呂慧芳, 王丹, 等. 具有線粒體靶向功能的載去甲斑蝥素TPP-PEG-PCL納米膠束促肝腫瘤細胞凋亡研究[J]. 中草藥, 2020, 51(19): 4943-4953.
[17] 錢勇, 費文靜, 諸晨, 等. 高效液相色譜法測定雷公藤滴丸中雷公藤甲素的含量 [J]. 中華中醫藥雜志, 2015, 30(11): 4115-4116.
[18] Al-Amin M D, Mastrotto F, Garofalo M,. Dexamethasone loaded liposomes by thin-film hydration and microfluidic procedures: Formulation challenges [J]., 2020, 21(5): 1611.
[19] 于泳. Regulome-SNP與原發性肝癌生存率的相關研究 [D]. 延吉: 延邊大學, 2020.
[20] 王蜀梅. 扶正祛邪方在晚期胃癌治療中的應用 [J]. 中國民間療法, 2016, 24(9): 42-43.
[21] Murphy M P. Targeting lipophilic cations to mitochondria [J]., 2008, 1777(7/8): 1028-1031.
[22] Biswas S, Dodwadkar N S, Piroyan A,. Surface conjugation of triphenylphosphonium to target poly(amidoamine) dendrimers to mitochondria [J]., 2012, 33(18): 4773-4782.
[23] Zhou W, Yu H, Zhang L J,. Redox-triggered activation of nanocarriers for mitochondria-targeting cancer chemotherapy [J]., 2017, 9(43): 17044-17053.
Preparation of triptolide TPP-PEG-PCL liposomes with mitochondrial targeting and its promotion apoptosis of hepatic tumor cells
WANG Feng1, ZHANG Chao2, ZHENG Shuan1
1. Zhumadian Central Hospital, Zhumadian 463000, China 2. Graduate School of Henan University of Chinese Medicine, Zhengzhou 450046, China
To prepare triptolide TPP-PEG-PCL liposomes and evaluate its mitochondrial targeting and hepatic tumor cell apoptosis promoting effect.Orthogonal test was used to optimize the preparation process of triptolide TPP-PEG-PCL liposomes, and the particle size, Zeta potential, drug loading capacity, encapsulation rate, polydispersion coefficient and transmission electron microscope morphology of the drug delivery system were studied. The stability, hemolysis and release of triptolide TPP-PEG-PCL liposomes were evaluated. Fluorescence test was used to study the fusion of liver tumor cells and liposomes, mitochondrial targeting andliver targeting. Under the conditions of equal dose administration, the effect of triptolide TPP-PEG-PCL liposomes on promoting apoptosis of liver cancer cells was evaluated.The particle size of triptolide TPP-PEG-PCL liposomes was (113.5 ± 17.6) nm, Zeta potential was (12.6 ± 0.7) mV, encapsulation rate was (71.3 ± 3.2)%, drug loading was (3.9 ± 1.1)% and polydispersity index was 0.12 ± 0.04. Transmission electron microscopy pictures showed that triptolide TPP-PEG-PCL liposomes were in regular round spheres. The liposomes had good stability, low hemolysis rate and good sustained-release drug properties; Fluorescence test results showed that TPP cations could promote the fusion of liposomes and tumor cells, and target mitochondria, and could also improve the targeting and retention of drugs in liver tumors. The cell efficacy results showed that triptolide TPP-PEG-PCL liposomes had a good effect on promoting liver tumor cell apoptosis, and significantly reduced the mitochondrial membrane potential, increased the level of intracellular ROS and the release of Caspase-3 significantly, increased the expression of pro-apoptotic protein Bcl-2 and decreased the expression of anti-apoptotic Bax protein. The results of these apoptosis tests were significantly better than that of triptolide liposomes and triptolide.Triptolide TPP-PEG-PCL liposomes had a good mitochondrial targeting function and can enhance the effect of drugs on promoting liver tumor cell apoptosis.
triptolide; orthogonal experiment; cell apoptosis; TPP-PEG-PCL; mitochondrial targeting; liposomes; hepatic tumor; hemolysis; sustained release; active oxygen; Caspase-3; Bcl-2; Bax
R283.6
A
0253 - 2670(2021)24 - 7473 - 11
10.7501/j.issn.0253-2670.2021.24.009
2021-06-01
河南中醫藥大學博士科研基金資助項目(2017023);2017年全國名老中醫藥專家傳承工作室建設項目(豫中醫科教[2018]19)
王 鋒,主治中醫師,研究方向中藥分子的靶向構建與評價。E-mail: 15978863102@163.com
張 超,副教授,博士。E-mail: 378745364@qq.com
[責任編輯 鄭禮勝]

