支原體營養代謝特征的研究進展
張曉亮,郝華芳,陳勝利,顏新敏,儲岳峰
支原體(Mycoplasma)是一類缺乏細胞壁、呈高度多形性、能通過濾菌器、可在無生命培養基中生長繁殖的最小原核細胞型微生物。目前,已經從人類和動植物體中分離出了多種致病性支原體,例如感染人類的人肺炎支原體(M.pneumonia, Mp),在新生兒以及青少年中有極高的發病率;感染動物的如能引起山羊傳染性胸膜肺炎(contagious caprine pleuropneumonia, CCPP)的山羊支原體山羊肺炎亞種[1](M.capricolumsubsp.capripneumoniae, Mccp)和感染植物的如能引起棗瘋病(Jujube witches’-broom disease)的棗瘋病植原體(Jujubewitches’-broomphytoplasma, JWBP)等[2],各種動植物支原體對世界畜牧業以及糧食產業造成了嚴重的經濟損失,也威脅人類生命健康。
支原體基因組是環狀雙股DNA,大小480~2 200 kbp,G+C含量低,在23%~40%之間,支原體基因組中編碼氨基酸和其他各種如嘌呤,嘧啶,生物素等生長因子生物合成的基因數量很少[3],缺乏能量代謝途徑中許多重要基因,脂肪酸和磷脂代謝基因及相關調控基因也很少[4]。因此,支原體是氨基酸、脂類和某些生長因子的營養缺陷型生命體,難以應對環境的變化,僅在特定環境中生存[5],這就造成了支原體培養困難。但體外培養是開展支原體生物學、病原學及防控技術研究的基礎前提,尤其由于抗藥性越來越普遍[6],疫苗成為防治支原體病的重要方向。盡管用支原體培養物制造疫苗在人類和動植物支原體病防控方面取得了一些成果[7-8],但支原體對營養要求高、生長緩慢和菌體密度低的特點極大阻礙了現有疫苗生產效率和推廣應用。所以,探究支原體的代謝特點,開發新培養基和培養技術,是解決支原體培養難題的有效途徑,也是支原體研究領域的基礎性問題。
本綜述總結了支原體這一具有“營養缺陷”特點的微生物在轉運系統、營養需求以及代謝網絡方面的研究進展,對研發支原體高效培養技術和培養基提供參考,同時希望從代謝角度對探索支原體的致病機制、毒力因子等有所啟發。
1 支原體的轉運系統
運輸系統被認為在支原體的生存中起著重要作用。由于支原體的生物合成能力有限,許多營養物質需要依靠外源性供給,因此支原體需要較多的運輸系統來運輸營養物質[9],在Mp中有17%的基因是編碼運輸過程所需的轉運蛋白或脂蛋白[10]。但與大腸桿菌和枯草桿菌相比,支原體轉運蛋白的數量并不多,可能是由于支原體只有一個通透屏障,其運輸系統的底物特異性較低,且生物合成過程中耗能少等所致[11]。在支原體中已發現3種類型的轉運系統,即ATP結合型轉運系統(ATP-binding cassette transporter,ABC)、依賴磷酸烯醇丙酮酸的磷酸轉移酶系統(Phosphotransferase system,PTS)和易化擴散。
1.1 ABC轉運系統 ABC轉運系統由胞質中的兩個ATP結合區、兩個跨膜區和一個胞外底物結合區組成,主要參與胞內和胞外的物質轉運,包括糖類、肽類、蛋白質和毒素等。該系統的某些蛋白可以自由改變構象,從而能相應地改變底物的特異性和轉運功能。首先在豬鼻支原體(M.hyorhinis)和豬Mp(M.hyopneumoniae)中發現了ABC轉運系統存在,后來在Mp(M.pneumoniae)、生殖支原體(M.genitalium)和發酵支原體(M.fermentans)中也都發現了ABC轉運系統的存在。可以說,ABC轉運系統是支原體與外界進行物質交換的“高速公路”。近些年,對ABC轉運蛋白的研究是微生物代謝和合成生物學領域研究的熱點之一。通過對其轉運蛋白的結構與基因組分析,解析其具體的作用機制,探究其是否可以由一種轉運蛋白轉運多種底物,提高微生物的代謝性能,設計出科研工作者想要的具有特定代謝性能的菌株,使其更適用于疫苗生產和科學研究[12-15]。2019年,Masukagami比較了野生型牛支原體和假定ABC轉運蛋白基因轉座子突變株的代謝產物譜,并用13C-同位素標記甘油轉運蛋白的突變株。發現突變體的兩個基因組編碼轉運蛋白的功能與基因組注釋結果不同,假定的氨基酸轉運蛋白(mbovppg450533)似乎更有可能與運輸核苷酸有關,而假定的二羧酸/氨基酸:陽離子轉運體(mbovppg450568)更有可能起生物蝶呤/葉酸轉運體的作用。說明基因注釋的某些轉運蛋白功能與實際情況存在一定差異。進一步推測支原體的轉運系統似乎有高度可變性,對其適應環境和營養供給的變化有重要意義[16]。
1.2 PTS轉運系統 PTS是大多數細菌的糖轉移系統,包含對糖專一的酶II和不專一的酶I及HPr(Heat-stable histidine-phosphoryl protein,HPr)蛋白,目前已經發現山羊支原體(M.capricolum)的PTS與大腸桿菌相似,但兩者的酶II和HPr的分子結構有差異,不存在交叉免疫反應[17]。
對PTS轉運系統的酶和調節成分的活性研究是支原體代謝研究方面的主要方面,尤其對HPr和HPr激酶/磷酸化酶(HPrK/P)的生理活性研究極大地促進了各國學者對支原體PTS系統功能活性的了解。2004年,Halbed等人研究了Mp利用不同碳水化合物的能力及其對不同PTS組分活性的影響,結果發現在添加果糖或甘油時Mp的培養時間比添加葡萄糖時大約延長了1倍,產量也較低,因此葡萄糖是Mp最好的碳源。另一方面,雖然Mp基因組編碼甘露醇分解代謝所需的所有基因,但其在體外培養時并不能利用甘露醇。在研究中所有測試的生長條件下,PTS的酶I、HPr和HPrK/P均存在。然而,如果培養基中添加了甘油,HPrK/P活性會顯著增加[18]。隨后,Merzbacher等發現HPrK/P是Mp為數不多的調控蛋白之一,其調節方式與其他細菌有明顯不同:MpHPrK/P在低ATP濃度下就具有激酶活性,而其他細菌的HPrK/P蛋白需要高ATP濃度才能發揮出激酶活性;Mp的HPrK/P蛋白對ATP具有非常高的親和力,而果糖-1,6-二磷酸只有微弱的調節作用。進一步研究發現,HPrK/P活性部位——核苷酸結合的P環的突變導致了MpHPrK/P獨特的調節方式,P環區域突變顯著影響ATP結合,從而影響酶的功能發揮[19]。HPrK/P缺陷的Mp突變株不再表現出HPr激酶活性,但仍具有針對絲氨酸磷酸化HPr的磷酸酶活性。編碼蛋白磷酸酶2C(Protein Phosphatase 2C,PP2C)家族的假定蛋白絲氨酸/蘇氨酸磷酸酶的基因(PrpC)可能在調節細胞HPr磷酸化狀態中起重要作用[20]。總之,HPr和HPrK/P作為PTS發揮功能的重要組成部分,對支原體的能量攝取具有重要作用,通過調節HPr和HPrK/P的功能發揮來改造PTS系統對今后支原體的代謝乃至毒力因子[21]的研究有重要意義。
2 支原體的一般性營養需求
支原體的一般性營養需求包括碳源、氨基酸、無機鹽和水。碳源在細胞內經過一系列復雜的代謝后,成為支原體自身的細胞物質(如碳水化合物、蛋白質和脂類等)和代謝產物。碳元素占細胞干重的50%左右,因此碳源是最基本的營養要素,需要量大,一般的糖類、甘油等可作為支原體的碳來源。尤其是甘油代謝過程中,支原體中的3-磷酸甘油氧化過程涉及一個產生過氧化氫的甘油-3-磷酸氧化酶。而過氧化氫是大部分支原體的主要毒力因子之一,所以甘油代謝過程和甘油-3-磷酸氧化酶在支原體的毒力中起著關鍵作用,目前在雞毒支原體和豬Mp相關毒力研究中均有報道[22-23]。氨基酸也是支原體不可或缺的營養需求,不同的支原體對氨基酸的需要量也不同,但大部分支原體均需全譜氨基酸。另外,研究發現無機鹽也是支原體穩定生長所需的必需物質,Beier等發現為使豬Mp穩定生長,在全組分確定的培養基CMRL+中添加了多種無機鹽,各種無機鹽的添加濃度和作用見表1[24]。總之,一般性營養需求是支原體培養的物質基礎。
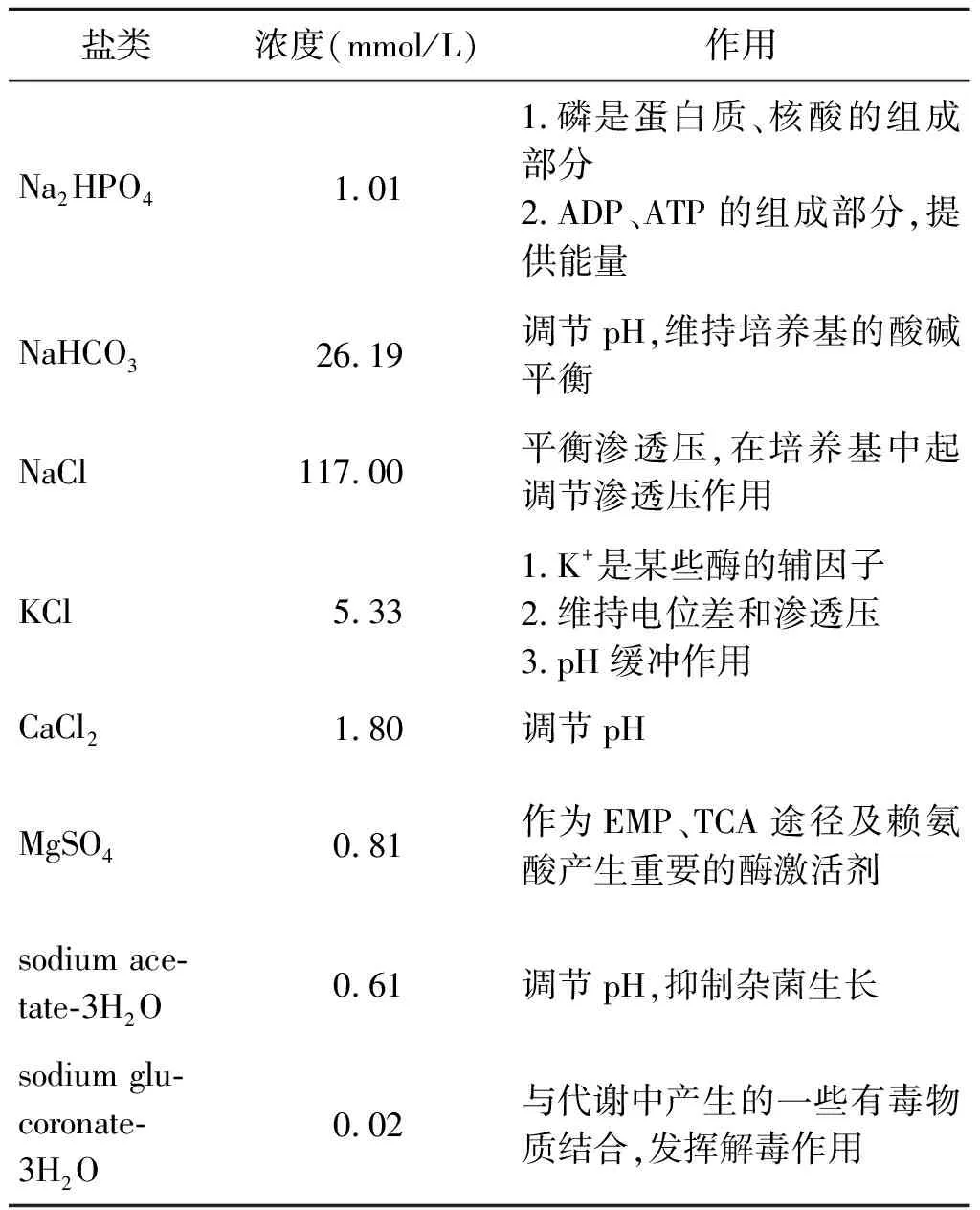
表1 CMRL+培養基中添加的幾種鹽類物質Tab.1 Several salts added in CMRL+ medium
3 支原體的特殊營養需求
支原體基因組很小,生物合成和代謝能力有限,因此支原體生存需要的營養成分主要靠從外界攝取。支原體對營養物質要求苛刻,一般來講,其特殊營養成分主要包括:膽固醇和脂肪酸、核酸前體和能量來源。
3.1 膽固醇和脂肪酸 大多數支原體的生長需要膽固醇,因此通常在培養基中添加血清,目的是提供支原體生長過程中必需的膽固醇和飽和及不飽和脂肪酸[25]。牛、馬血清中所含膽固醇的主要成分是高密度脂蛋白(HDL),并且血清中的蛋白是支原體生長所需脂肪酸的載體。由于不同動物甚至同種動物不同批號的血清所含HDL、低密度脂蛋白(LDL)和極低密度脂蛋白(VLDL)的量有差異,故其培養支原體的效果也有所不同[26]。到目前為止,還沒有關于支原體脂肪酶的實驗信息。然而,目前認為脂肪酶對支原體和其他柔膜體綱物種非常重要,因為這些微生物不能合成脂肪酸,因此依賴于從環境中獲取脂肪酸。事實上,3個脂肪酶編碼基因已經在絲狀支原體山羊亞種(M.mycoidessubsp.capri, Mmc)中被確定[27],并且在Mp和生殖支原體的基因組中也預測了3個脂肪酶編碼基因。并且假定的脂肪酶編碼基因在Mp都是必不可少的,這表明他們是專門的底物特異性酶[28]。此外,在豬Mp中發現了一種偏愛較短脂肪酸的脂解酶[29],在Mp中也存在相應的蛋白質(MPN407)。
由于大多數支原體都存在隱性感染的問題,難以及時診斷發現,目前也有諸多學者提出利用感染早期血清代謝標志物檢測的方法來解決支原體隱性感染的問題。而血清代謝標志物也在一定程度上反映了支原體的代謝特點,在2019年,Meera等人利用非靶向代謝組學技術,檢測到在豬Mp早期感染的豬的血清中,發現肉豆蔻酸,棕櫚油酸,油酸和亞油酸等幾種脂肪酸的含量較未感染豬的血清中顯著上升,提示了豬Mp在機體中生長繁殖對脂肪酸具有強烈需求[30]。
3.2 核酸前體 支原體缺乏合成嘧啶所需的乳清酸代謝途徑和合成嘌呤所需的酶促代謝途徑,因此,培養基內需要提供一定量的嘌呤堿和嘧啶堿。實驗證明,許多支原體的酶系統可以將培養液中的核苷酸分解為自由堿基[31],因此可以通過核苷酸補救合成途徑合成支原體生長過程中所需要的核苷酸。
最早在1977年,Mitchell等通過試驗確定了絲狀支原體(M.mycoides)中核苷酸合成的主要途徑,發現其不具有從頭合成核苷酸的途徑,但能夠進行核苷酸的相互轉化,因此,尿嘧啶提供了對兩種嘧啶的需求。此外還需要胸腺嘧啶,說明其無法進行尿嘧啶的甲基化[32]。目前,在支原體核苷酸代謝研究中,公認的是大多數支原體都缺乏核苷酸從頭合成途徑,核苷和脫氧核苷被核苷激酶和脫氧腺苷激酶有效地吸收和磷酸化為它們各自的核苷酸。核酸酶是通過次黃嘌呤磷酸核糖基轉移酶(HPRT)、腺嘌呤磷酸核糖基轉移酶(APRT)和尿嘧啶磷酸核糖基轉移酶(UPRT)系統補救[33]。2013年,Sun和Wang在Mp基因組核苷酸生物合成中共鑒定到17種酶,其中15種是必不可少的,對30種核苷或核苷堿基類似物的藥物評價發現7種藥物能夠有效抑制Mp的生長,其機制是抑制了核苷酸生物合成途徑和核苷轉運蛋白中的酶[34]。支原體對外源核酸及核酸前體的需求,是支原體區別于其他微生物的重要營養代謝特征,而支原體對核酸的攝取造成宿主機體的損害,也是某些支原體的重要毒力因素。圖1展示了Mp中核苷酸的生物合成途徑。

Hx:次黃嘌呤,Gua:鳥嘌呤,Ura:尿嘧啶,Thy:胸腺嘧啶,dT:胸苷,dA:脫氧腺苷,dC:脫氧胞苷,dG:脫氧鳥苷,PRPP:焦磷酸核糖基,NMP:核苷一磷酸,NDP:二磷酸核苷,NTP:三磷酸核苷, dNDP:脫氧核苷二磷酸,dNTP:脫氧核苷三磷酸,TFT:三氟胸苷,TFT-MP:三氟胸苷一磷酸, TFT-TP:三氟胸苷三磷酸, 5FdU-MP:5-氟脫氧尿苷一磷酸,5FdU-TP:5-氟脫氧尿苷三磷酸, dFdC-DP:吉西他濱二磷酸, dFdC-TP:吉西他濱三磷酸, 6-TG:6-硫鳥嘌呤,6-TG-TP:6-硫鳥嘌呤三磷酸。酶:hpt:次黃嘌呤鳥嘌呤磷酸核糖基轉移酶(MPN672),apt:腺嘌呤磷酸核糖基轉移酶(MPN395),upp:尿嘧啶磷酸核糖基轉移酶(MPN033),deoA:胸苷磷酸化酶(MPN064),tdk:胸苷激酶(MPN044),thyA:胸苷酸合酶(MPN320),tmk:胸苷酸激酶(MPN006),adk:腺苷酸激酶(MPN185),gmk:鳥苷酸激酶(MPN246),cmk:胞苷酸激酶(MPN476),nrdE/nrdF:核糖核苷酸還原酶(MPN322和MPN324),pyrH:尿酸激酶(MPN632),脫氧腺苷激酶(MPN386),I:抑制。圖1 Mp核苷酸生物合成示意圖[34]Fig.1 Schematic overview of M. pneumoniae nucleotide biosynthesis[34]
3.3 能量來源 由于缺少編碼中間代謝產物的基因,支原體的能量代謝系統比較簡單,缺乏細胞色素和三羧酸循環所需的酶類等,呼吸鏈進行不完整,因此支原體是主要依靠底物的磷酸化產生ATP,而不是氧化磷酸化過程。大部分支原體以葡萄糖、精氨酸以及有機酸如丙酮酸等作為能量來源。值得注意的是,雖然支原體對培養條件要求較高,但并非培養基的營養成分越豐富,培養效果越好。有些較難培養支原體并非是缺乏相應的營養成分,而是某種營養成分對支原體的毒性作用。如蛋白胨、酵母提取液中的某些生長因子對某些支原體而言是一種生長抑制因子。1977年,Washburn在研究中發現,精氨酸量的增多抑制發酵支原體和Mp的生長,因為過多的精氨酸代謝產生的游離堿干擾了這兩種支原體發酵葡萄糖[35]。
根據對糖類分解能力的不同,可將支原體分為發酵型和非發酵型兩種。發酵支原體主要依靠糖酵解途徑分解葡萄糖合成ATP作為能源。發酵型支原體中,以對Mp的研究居多。Mp可以利用葡萄糖、果糖和甘油作為碳源[36]。這些碳水化合物通過糖酵解分解,作為 ATP 生成的主要途徑。鑒于糖酵解對Mp的重要性,糖酵解途徑的效率對其生長至關重要。事實上,大多數Mp的糖酵解相關酶可以形成復合物,這可能對確保糖酵解途徑高通量進行起到了關鍵作用[37-38],由于磷酸戊糖途徑和三羧酸循環缺乏氧化部分,所以糖酵解對于柔膜體綱的重要性不言而喻[39]。而在非發酵型支原體主要通過精氨酸脫氫酶、鳥氨酸甲酰轉移酶及氨基甲酸鹽激酶三個酶系統,將精氨酸通過底物水平磷酸化而分解成瓜氨酸、鳥氨酸、CO2、NH3及產生ATP而獲得能量。但是,精氨酸脫氫酶途徑在少數發酵型支原體中也存在,因此,當培養這一類支原體時,如果培養基中同時含有葡萄糖和精氨酸,分解葡萄糖產生的酸可能被分解精氨酸產生的堿中和,使其pH不發生明顯改變,從而影響精氨酸利用試驗的結果判斷。Fenske等發現雞毒支原體、人型支原體和發酵支原體在含高濃度精氨酸(34 mmol/L)和低濃度精氨酸(4 mmol/L)的培養基中培養時,人型支原體菌體蛋白的含量和精氨酸脫亞胺酶的比活性在前者中都顯著增加,而雞毒支原體和發酵支原體雖然在前者中培養時也表現出蛋白含量的增加,但酶的比活性沒有增加,這說明精氨酸在某些支原體中可能作為一種替代能源使用[40]。2009年,Pereyre等發現人型支原體的糖酵解通路是不完整的,而精氨酸二水解酶途徑對促進其生長不可或缺,同時預測了二甲基精氨酸和二甲氨基水解酶的存在,提示精氨酸分解代謝是極其復雜的[41]。
4 支原體代謝與組學研究
隨著基因組學、蛋白質組學和代謝組學等各種組學技術的發展,通過高通量的基因組測序,蛋白質篩選和代謝物分析,解析支原體基因組與蛋白功能,為研究支原體這類最小微生物代謝提供了更多的數據與實驗基礎。
2017年,Kamminga等在豬Mp基因組測序基礎上構建了基于284種化學反應和298種代謝物的基因組代謝模型,該模型預測豬Mp標準株中84%的能量用于非生長相關的生命維持,僅有16%的細胞能量用于生長和生長相關活動。發酵實驗發現通過添加丙酮酸可增加用于生長的細胞能量的質量分數,從而使生長速率增加[42]。目前,在支原體培養基中添加適量丙酮酸鹽用來提高支原體的產量已成為各國學者的共識。同年王曉暉等[43]比較了絲狀支原體山羊亞種(Mmc)PG3菌株生長周期4個不同階段的動態基因表達,發現45個差異表達基因(P<0.01)與PG3代謝相關。這些基因編碼的酶主要參與ATP合酶、嘧啶代謝、煙酸和煙酰胺代謝、精氨酸和脯氨酸代謝,其中,胞苷激酶、果糖1,6-二磷酸醛縮酶II類、煙酸-核苷酸腺苷酰轉移酶和二氫硫辛酰胺脫氫酶在Mmc代謝中起關鍵作用,該研究為了解Mmc代謝機制奠定了基礎。之后,作者又對綿羊MpNM151菌株和絲狀支原體亞種PG3菌株的不同生長階段進行了“點對點”的比較。結果表明,核苷酸代謝的最大差異出現在生長曲線的穩定期。轉錄組試驗比較發現,PG3的核苷酸合成主要是從頭合成,而NM151核苷酸合成途徑主要是利用核苷酸的補救途徑。與 PG3相比,NM151缺乏脫氧胸腺嘧啶單磷酸酯合成的相關反應,并通過體外添加絲氨酸來彌補這一反應途徑的空白,延長了NM151的生長穩定期,解決了Mo死亡較快的問題[44]。
2017年,Masukagami等使用代謝組學技術發現牛支原體和雞毒支原體在代謝產物穩態水平和碳源利用方面表現出明顯的差異。雞毒支原體積極吸收外源性葡萄糖并積累大量的磷酸己糖,隨后在糖酵解和磷酸戊糖途徑中異化,產生ATP,這表明其PTS系統和碳水化合物轉運體系統具有高效作用。然而有趣的是,即使是在外源葡萄糖水平很高的情況下,牛支原體似乎也是主要通過糖異生途徑產生磷酸化糖。兩種支原體均可以吸收其他中性糖,可能是通過非特異性的碳水化合物ABC轉運蛋白CUT-2轉運蛋白來實現的,進一步通過細胞穩態分析發現盡管雞毒支原體培養基中的糖消耗更快,但牛支原體細胞中葡萄糖和果糖的水平高于雞毒支原體細胞,推測可能是由于缺乏葡萄糖激酶同源物,牛支原體培養過程中外源葡萄糖轉化為葡萄糖-6-磷酸(G-6-P)和其他糖磷酸鹽的轉化率低造成的。同時發現,牛支原體中乳酸含量較高,并且從培養基中快速吸收乳酸,這表明牛支原體可能利用乳酸作為首選的碳源,而在雞毒支原體中丙酮酸發酵產生乳酸可能是導致培養過程中pH下降的原因。牛支原體攝取乳酸不僅是為了獲取能量,也能夠氧化乳酸產生過氧化氫,這也是支原體的毒力因子之一,在許多支原體代謝中都存在。結果表明牛支原體優先使用非糖類碳源,這可能反映了以反芻動物為宿主的支原體所處的生化環境,其中揮發性脂肪酸和乳酸鹽(而不是葡萄糖)是腸粘膜吸收能量的主要來源[45-49]。這是為數不多的關于動物支原體病病原的代謝組學研究,對指導我們了解支原體代謝提供了新的試驗參考和理論支持。
Mp是目前支原體組學方面研究最多的病原。2013年,Wodke等對Mp代謝網絡進行了詳細的分析和描述,并將一系列條件下不同組學分析的數據整合到一個模型中。通過模型預測、邏輯假設、實驗測試和模型細化,精確地繪制了Mp的代謝網絡,并對能量代謝進行了定量研究,發現Mp的大部分能量用于維持生命,而不是生長[50]。Maier等則進行了Mp大規模代謝組學分析以及與基因組學和蛋白質組學數據的定量整合研究,檢測到超過50%的代謝中間物,得到了在實驗室生長條件下Mp代謝途徑的定性圖像,測定了體內糖酵解酶的催化參數。同時將細胞質內代謝物的量的大小與來自生長培養基的營養物質及其相應的形式結合起來,解釋了Mp細胞內代謝穩態維持的生化機制。揭示了Mp將代謝途徑作為功能單元進行調節,表明Mp的代謝網絡具有更模塊化的調節方式,極大地簡化了代謝流程中各種復雜的調節過程,盡量省去不必要的能量消耗,用于維持Mp的生命和生長[51]。
5 支原體的合成生物學
支原體作為自然界目前已知的能在無生命培基中生長繁殖的最小的微生物[52],一直是合成生物學領域的重點研究對象。2010年,美國J. Craig Venter團隊合成絲狀支原體(M.mycoides)基因組,然后將其移植入另一種關系密切的山羊支原體(M.capricolum)中,制造出他們稱為JCVI-syn1.0的合成細胞。2016年,研究人員在syn1.0細胞的基礎上,不斷嘗試刪除其基因組中不必要的基因,最終把syn1.0中901個基因刪除約一半,只剩下473個基因,合成了一個目前已知的具有最小基因組的可自主營生的最小細菌細胞,取名為JCVI-syn3.0合成細胞[53]。2019年, 美國伊利諾伊大學的Zaida Luthey-Schulten團隊又以syn3.0為基礎,進一步研究了這一具有最小基因組的人工生命體的必需代謝網絡,為進一步研究這一最小生命體奠定了基礎[54]。2020年,以JCVI-syn3.0為基礎構建的計算機基因敲除模型以及生化反應網絡模型被設計出來[55-57],為利用計算機技術體外重構生命體代謝網絡和指導合成生物學發展奠定了基礎。
6 結 論
支原體作為一種體外較難培養的微生物,從上世紀70年代各國學者都在致力于優化其體外培養條件,降低體外培養難度和培養成本,尤其是致力于彌補其某些代謝通路的缺失,并期望尋找培養基中血清替代物從而降低其培養成本。同時,支原體作為一類具有最小基因組的可自主營生的微生物,可將其作為一種模式生物體外重構基因-蛋白-代謝物網絡,探尋三者之間的聯系,從高通量、大數據、全局性角度為支原體的致病性研究提供數據支撐。
利益沖突:無
引用本文格式:張曉亮,郝華芳,陳勝利,等.支原體營養代謝特征的研究進展[J].中國人獸共患病學報,2021,37(11):1029-1036. DOI:10.3969/j.issn.1002-2694.2021.00.146

