山桐子冬芽休眠過程及其生理生化特征
王艷梅 郭云天 陳珺肄 沈 紅 楊 懷 劉 震
(1. 河南農業大學林學院,河南 鄭州 450002;2. 中原地區森林資源培育國家林業局重點實驗室,河南 鄭州 450002;3. 浙江韻澤盈農業科技發展有限公司,浙江 衢州 324000;4. 洛陽市森林病蟲害防治檢疫站,河南 洛陽 471000;5. 河南省雞公山國家級自然保護區管理局,河南 信陽 464000)
為了適應冬季的寒冷和干燥,大多溫帶樹木在秋季就停止高生長,形成冬芽,進入休眠,為北方系冬休眠類型[1]。山桐子(Idesia polycarpa)為大風子科(Flacourtiaceae)山桐子屬落葉闊葉喬木,其不僅分布于暖溫帶的冬芽有休眠特性,分布于亞熱帶的冬芽同樣具有適應冬季寒冷干燥的特性;劉震等研究發現,山桐子冬芽休眠的具有主要以溫度為導入誘因,具有較低的休眠深度以及5~15 ℃的低溫范圍可以解除休眠的休眠特性,這與溫帶樹種的冬休眠特性有顯著差異,被稱為南方系冬休眠類型[1];同樣橫跨亞熱帶與暖溫帶的紅潤楠(Machilus Thunbergii),僅分布于暖溫帶的具有淺休眠特性[2],這類常綠闊葉樹種的休眠被歸為紅潤楠型冬休眠[1]。
永田洋等[3]根據芽萌發率結合芽的狀態和環境溫度將芽休眠的變化過程分為:休眠導入期、深休眠期、休眠解除期和內生長期4個階段。樹木在越冬休眠的各個時期的內源激素含量變化各不相同,影響著休眠的進程[4-8]。有關樹木冬芽內源激素的變化與休眠解除的研究也較多,如楊樹(Populus tremula×Populus alba)[9]、茶 樹(Camellia sinensis)[10]、泡桐(Paulowniasp.)[11]和懸鈴木(Platanussp.)[12]等,通過這些研究可知,ABA的積累可以促進冬芽的休眠,赤霉素能夠促進休眠的解除。伴隨著內源激素含量的變化,冬芽休眠過程中其他內含物也在發生著變化。抗氧化酶參與果樹芽休除進程的調控[13],是低溫響應和影響休眠誘導與解除的信號[14-17]。可溶性糖、蛋白質等生化物質與冬芽的休眠過程和抗寒性密切相關[18-19]。劉震等[20]發現分布于暖溫帶三重縣的山桐子冬芽休眠比分布于亞熱帶沖繩縣的深,并且這2種種源的山桐子只有經歷足夠的低溫冬芽才能夠萌發生長,其生長量與所經歷的低溫量有關。王艷梅等[21]通過探究分布與大陸性氣候的不同種源山桐子冬芽休眠解除的有效低溫發現其有效低溫各不相同,15 ℃也具有解除休眠使冬芽萌芽的效果。目前山桐子冬芽休眠過程中冬芽內生理生化物質的變化還不明了。為此,本研究通過采集鄭州氣候條件下山桐子枝條進行水培來判斷其冬休眠過程的同時,測定不同時期冬芽內生理生化物質的變化,以揭示南方系冬休眠類型樹種冬芽休眠過程的生理生化機制。
1 材料與方法
1.1 試驗材料與設計
材料采集于種植于河南農業大學林業試驗站(113°42′ E,34°43′ N)4年生東京種源山桐子。該地屬于暖溫帶大陸性氣候,四季分明,年平均氣溫14.2 ℃,年日照時數約2 400 h,無霜期220 d,年平均降水量650.1 mm,土壤為潮土(沙壤土),微堿性。
分別在2017年9月10日、9月20日、10月10日、10月20日、10月30日、11月15日、12月1日、12月15日,2018年1月1日、1月15日、2月5日、3月1日、3月10日和3月17日從樣地4年生東京種源山桐子樹上采集長10 cm、基徑范圍在0.4~0.8 cm、帶頂芽的枝條10枝,采集樹體上部2~3年生枝條上的成型的芽體30個。枝條放置于光照強度為2 000 lx、光照時長24 h、溫度25 ℃恒溫箱內100 mL的三角錐形瓶中進行水培試驗,試驗用的培養液由50 mL蒸餾水和5 mL濃度為22.15 mg/L MS鹽溶液組成,每3 d換1次培養液;采集的芽體用錫箔紙包裹置于液氮中帶回實驗室,存放于?80 ℃冰箱里,15個芽體用于生理指標的測定,主要包括:超氧化物歧化酶(SOD)活性、過氧化物酶(POD)活性、過氧化氫酶(CAT)活性、可溶性蛋白含量、可溶性糖含量,15個芽體用于內源激素含量的測定,主要包括:生長素(IAA)、脫落酸(ABA)、反式玉米素(tZR)、赤霉素(GA3)。
1.2 試驗方法
不同時間采集的山桐子枝條在恒溫箱內水培,主要觀測不同時期枝條上頂芽萌發的時間、展葉數、萌發率、萌發高生長率和平均高生長量(對于出現高生長現象的枝條持續觀察,沒有出現的則不進行觀察),萌發高生長率為既萌發又出現高生長的枝條占處理總枝條數的百分率,萌發率為芽萌發的枝條占處理總枝數的百分率,并將萌發率作為芽體休眠深度的判斷標準[2]。
可溶性糖含量采用苯酚法測定[22];可溶性蛋白含量測定選用考馬斯亮藍G?250染色法,超氧物歧化酶(SOD)測定采用氮藍四唑(NBT)比色法,過氧化物酶(POD)測定采用愈創木酚法,過氧化氫酶(CAT)采用高錳酸鉀滴定法[23];采集測定內源激素的樣品使用Agilent 1 260 InfinityⅡ液相色譜儀,采用高效液相色譜法[24]測定生長素(IAA)、脫落酸(ABA)、反式玉米素(tZR)和赤霉素(GA3)。
2 結果與分析
2.1 不同時期山桐子冬芽在25 ℃條件下萌發生長的變化
由圖1可知,9月10日采集的冬芽在水培10 d后開始萌芽,11月之前的萌發率集中在46.67%~66.67%,進入11月冬芽萌發率突然降低,萌發時間也在增加,11月15日冬芽萌發率只有30%,但12月1日冬芽萌發率快速上升至90%,但冬芽萌發所需時間長達20 d,之后冬芽萌發所需時間逐漸減短,萌發率均為100%,3月17日冬芽第4天就出現萌發現象。
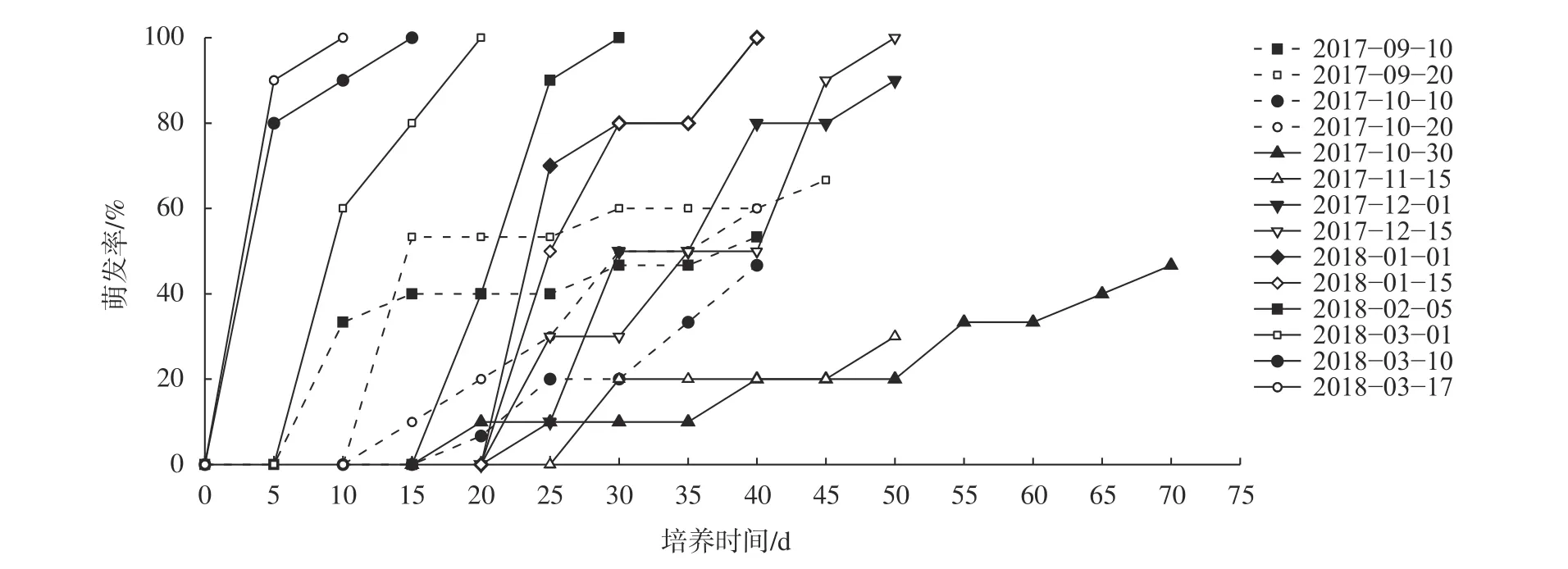
圖1 不同時期山桐子冬芽在25 ℃條件下的萌發率Fig. 1 Germination rate of I. polycarpa winter buds in different periods at 25 ℃
由圖2可知,各個時期采集水培的枝條在9月10日至1月15日的冬芽萌發后均不能進行正常生長,只有2月5日之后才開始出現生長現象,出現高生長的天數逐漸減短,萌發高生長率3月1日最高,2月5日最低,只有1株出現高生長現象,最大生長量為2.2 cm;3月1日的萌發高生長率達到60%,最大平均高生長量1.38 cm,之后3月10日和3月17日采集枝條的萌發高生長率分別為20%和30%,平均高生長量分別為1.15 cm和1 cm。
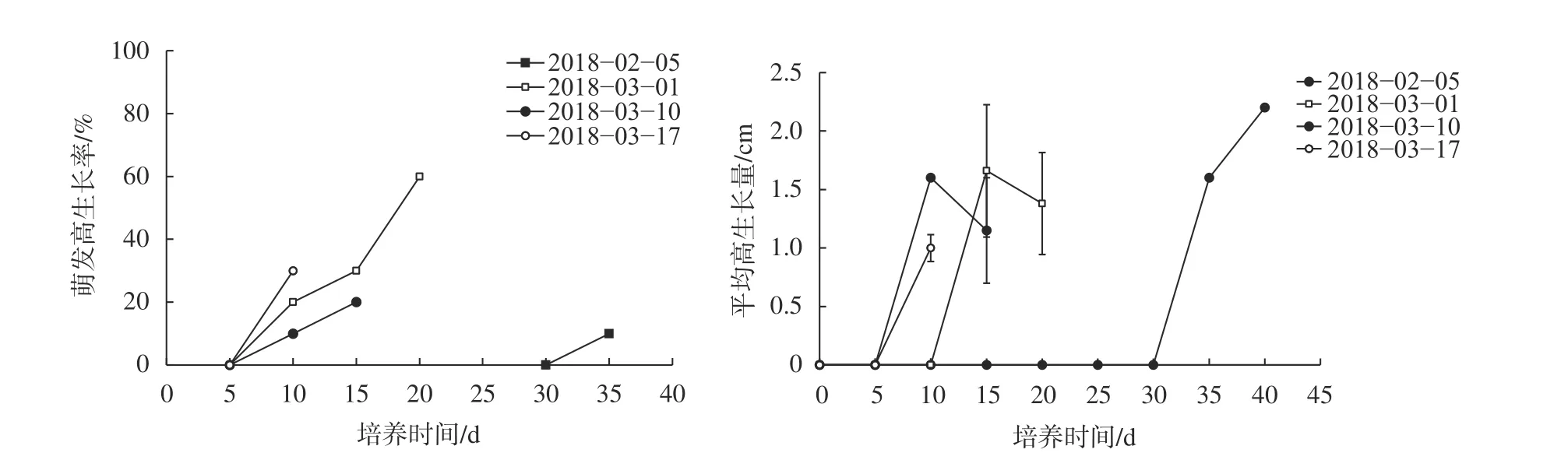
圖2 不同時期山桐子冬芽在25 ℃條件下萌芽后高生長狀況Fig. 2 The high growth of I. polycarpa buds in different periods after germination at 25 ℃
2.2 不同休眠期山桐子冬芽內生理生化物質的變化
2.2.1 滲透調節物質含量的變化
由圖3可知,可溶性糖含量呈現W型動態變化。冬芽可溶性糖含量在9月10日至9月20日顯著下降(P<0.05),在10月保持在較低水平;進入11月,10月30日至12月1日可溶性糖含量呈顯著增加趨勢(P<0.05),在12月1日達到最大值2.221 μg/g;12—2月可溶性糖含量開始波動下降,但仍維持在較高水平;進入3月,可溶性糖含量在3月10日達到最低值0.634 μg/g后到3月17日顯著上升(P<0.05)。可溶性蛋白含量的變化與可溶性糖含量變化不同,9月20日至10月20日可溶性蛋白含量顯著上升(P<0.05),在10月20日達到峰值140.64 μg/g,10月20日至10月30日顯著下降(P<0.05),但仍維持在較高水平;進入11月,10月30日至11月15日可溶性蛋白含量顯著下降(P<0.05),在11月15日降到最低值59.48 μg/g,之后略有上升,可溶性蛋白的含量處在較低水平;12月之后含量呈上升趨勢,1月1日在達到峰值126.15 μg/g后至2月5日呈顯著下降趨勢(P<0.05);進入3月后,3月1日至3月17日可溶性蛋白含量顯著上升(P<0.05),在3月17日達到最大值156.21 μg/g。
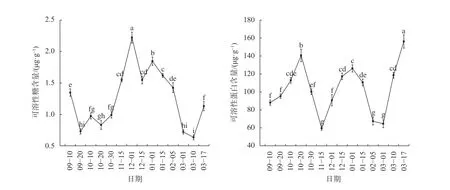
圖3 不同休眠期山桐子冬芽滲透調節物質含量的變化Fig. 3 The dynamic changes of osmoregulation substancecontent in winter buds of I. polycarpa during different periods
2.2.2 抗氧化酶活性的變化
由圖4可知,SOD活性呈現小幅波動的趨勢,整體上變化不大。相比于SOD,POD和CAT的活性變化更為明顯,9—10月冬芽內POD活性逐漸降低,10月20日至10月30日POD活性顯著下降(P<0.05),在10月30日POD活性下降至最低9.48 U/(g·min);進入11月,10月30日至11月15日POD活性顯著上升(P<0.05);POD的活性在12月之后繼續上升,一直到2月,POD活性整體維持在較高水平;進入3月,POD活性維持在高水平,3月1日POD活性達到20.86 U/(g·min),之后3月10日至3月17日POD活性顯著下降(P<0.05)。CAT的活性變化與POD活性變化在前期較為一致,10月10日至10月30日CAT活性呈顯著下降趨勢(P<0.05),在10月30日CAT活性下降至最低值2.5 U/(g·min);10月30日至12月1日冬芽內CAT活性顯著上升(P<0.05),在12月1日活性達到13.67 U/(g·min);12月之后,芽內CAT活性再次降低,在2月5日再次達低峰值4 U/(g·min),這段時期冬芽內的CAT活性都保持在低水平;進入3月后,3月1日至3月17日冬芽內CAT活性呈顯著上升趨勢(P<0.05),在3月17日達到最大值31U/(g·min),恢復到9月初的高水平狀態。
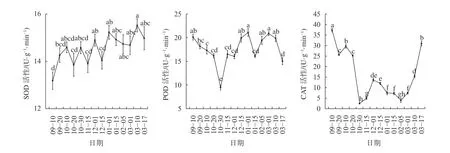
圖4 不同時期山桐子冬芽抗氧化酶活性的動態變化Fig. 4 The dynamic changes of antioxidant enzyme activity in winter buds of I. polycarpa during different periods
2.2.3 內源激素含量的變化
由圖5可知,山桐子冬芽在休眠過程中,IAA和ABA含量都呈現“上升—下降”的變化趨勢,tZR的含量變化隨越冬溫度呈現季節性的變化,而在冬芽休眠過程中不同時期的赤霉素GA3含量的動態變化比較大。9月至10月中上旬ABA含量較低,在0.045 ~0.056 μg/g,10月20日至10月30日含量顯著增加(P<0.05),在10月30日達到最高值;進入11月,10月30日至11月15日冬芽內的ABA含量顯著下降(P<0.05),但仍維持在較高水平;12月1日至1月15日,ABA含量呈顯著下降趨勢(P<0.05),2月ABA含量逐漸降低至較低水平;3月之后,ABA含量維持在較低水平,在3月17日達到最低值0.011 μg/g。IAA含量的變化趨勢與ABA相似,9月至10月中上旬冬芽內IAA含量穩定在較低水平,10月20日至10月30日IAA含量顯著上升(P<0.05),在10月30日升至最高1.142 μg/g;11月之后,10月30日至11月15日生長素含量顯著下降(P<0.05),11月15日至12月1日顯著上升(P<0.05),后在12月15日顯著下降降至最低值0.011 μg/g(P<0.05),之后IAA含量略有小幅波動,但始終保持在較低水平;3月之后IAA含量穩定在較低水平。
從圖5中可以看出,9—10月冬芽內的tZR含量較低,基本穩定在0.022~0.061 μg/g;進入11月,10月30日至11月15日tZR含量顯著上升(P<0.05),在11月15日升高到0.339 μg/g;12月1日至12月15日冬芽內tZR含量呈顯著下降趨勢(P<0.05),在12月15日達到最低值0.002 μg/g,之后12月15日至2月5日隨著休眠的進程tZR含量呈顯著上升趨勢(P<0.05),在2月維持在較高水平;3月10日至3月17日冬芽內tZR含量顯著增加(P<0.05),在3月17日達到最大含量為0.490 μg/g。山桐子冬芽內GA3含量的動態變化比較大,9月到10月初的冬芽GA3含量較低,10月10日至10月30日GA3的含量呈顯著上升趨勢(P<0.05),在10月30日達到峰值156.290 μg/g;進入11月,10月30日至11月15日GA3含量顯著下降(P<0.05),11月15日至12月1日又顯著上升(P<0.05),11月GA3維持在較高水平;在12月,12月1日至12月15日GA3的含量顯著下降(P<0.05),在12月15日降至最低值0.123 μg/g,之后12月15日至1月15日冬芽內GA3含量呈顯著上升趨勢(P<0.05),2月GA3含量略有下降,但維持在較高水平;3月10日至3月17日GA3含量顯著上升(P<0.05),在3月17日達最大值162.703 μg/g。
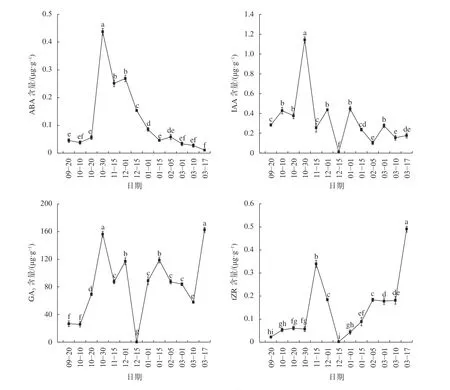
圖5 不同時期山桐子冬芽內源激素含量的動態變化Fig. 5 The dynamic changes of endogenous hormone in winter buds of I. polycarpa during different periods
圖6可知,將內源激素IAA、tZR、GA3、IAA+GA3+tZR分別與ABA進行比值,可以發現在整個山桐子冬芽休眠過程中,生長素IAA與脫落酸ABA之間的比值變化波動較多,10月10日至10月30日比值顯著下降(P<0.05),11月比值保持在較低水平,12月之后比值波動上升,進入3月,3月10日至3月17日比值顯著增大(P<0.05),在3月17日比值達到最大;而激素tZR、GA3和IAA+GA3+tZR與ABA之間的比值變化較大,相對一致,在9—11月比值變化較小,12月之后開始上升,進入3月,3月10日至3月17日比值顯著增大(P<0.05),在3月17日達到最高的比值。
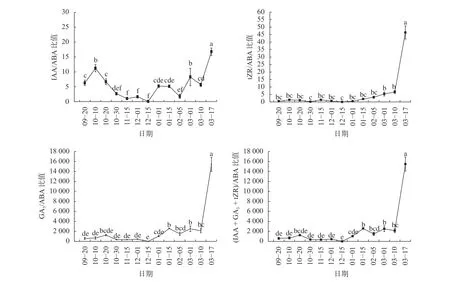
圖6 不同時期山桐子冬芽內源激素比值的變化Fig. 6 Changes of endogenous hormone ratio of I. polycarpa winter buds during different periods
3 結論與討論
3.1 山桐子冬芽休眠過程特征
根據不同山桐子冬芽萌發率的變化,可以判定東京種源山桐子休眠過程為:9—10月為芽休眠導入期,11月為深休眠期,12—2月為休眠解除期,3月進入內生長期,這與前期研究結果基本一致,只是休眠深度比三重縣種源淺,比沖繩縣種源深[1,20],可能是東京氣候較三重溫暖的原因。該休眠過程與同為南方系冬休眠類型的懸鈴木和泡桐側芽相似[25-26],區別是山桐子休眠導入期、深休眠期以及未充分解除休眠時期冬芽即使萌發,也難于抽枝,節間伸長。百合在冷藏解除休眠時,冷藏時間不足會影響頂芽萌發后的伸長[25],對于山桐子來說,分析其原因可能相比于冬芽的展葉萌發,冬芽萌發后的正常生長需要積累更多的低溫量,這種休眠解除時只能萌發展葉不進行正常生長的特殊現象,將其暫稱為冬芽內的“葉原基休眠”,而冬芽需要經歷更長時間的低溫,萌發后才能進行正常生長,這種冬芽休眠暫稱為“分生區休眠”,其休眠解除期更長,只有2種休眠均解除才能保證山桐子冬芽在春季重新萌發生長。
北方系冬休眠類型的楊樹(Populus×euramericanacv.‘I?214’)冬芽9月30日在日本津市(34°42' N,136°30' E)就達到了深休眠期[26],而南方系山桐子深休眠期延遲到11月,說明南方系冬休眠類型休眠導入期滯后以適應南方冬季來臨較晚且較暖的氣候;同時,與北方系冬休眠類型冬芽在深休眠期即使25 ℃高溫條件下也不萌發相比,南方系冬休眠類型山桐子冬芽在深休眠期有一定比率的冬芽萌發,休眠深度較淺;南方系山桐子冬芽休眠解除期與北方系楊樹冬芽休眠解除期相似,均在春季2—3月萌發開始重新生長。
3.2 山桐子冬芽休眠過程的生理生化特征
可溶性糖和可溶性蛋白是植物的重要的滲透調節物質,可溶性糖使細胞冰點下降,保護原生質體[18,27]。從山桐子冬芽休眠過程中可溶性糖和可溶性蛋白含量的變化趨勢來看,與葡萄(Vitis vinifera)[27]和杏樹(Armeniaca vulgaris)[28]的變化基本一致,不同在于可溶性蛋白含量在深休眠期降低,可能由于此時內源激素GA3、tZR和ABA含量增加,導致可溶性蛋白含量下降。可溶性糖和可溶性蛋白含量均在冬季最寒冷季節最大,以提高其抗寒性,其變化與休眠過程密切相關。
植物遇到低溫會積累大量有害的活性氧(AOS),使植物體內抗氧化酶系統加強,提高植物對活性氧的耐受力[29],低溫促進保護酶活性的提高[30],SOD、POD和CAT活性與梨樹(Pyrus bretschneideri)花芽的休眠有很大關系[31]。本研究發現隨著溫度的降低,休眠深度的加深,山桐子冬芽內SOD作為清除活性氧的主要酶類,其活性一直保持在較高水平,這與油桃[32](Prunus persicavar.nectarina)[32]的芽體在休眠期SOD活性基本保持在較高水平的研究結果一致,但SOD活性在不同休眠階段變化無顯著差異;而CAT和POD作為清除H2O2的主要酶類,其活性隨著溫度的降低而下降,在深休眠期顯著低于其他時期的活性,而后POD活性隨著休眠的解除開始上升,CAT活性一直到休眠完全解除才有明顯升高,這與研究北方系冬休眠類型的許多樹種如杏樹[33]、油桃[32]和葡萄[32]的休眠過程中,發現隨著低溫的累積,CAT活性在休眠初期下降,深休眠期保持較低水平,休眠后期又升高,而POD活性的變化趨勢與CAT相反的結果不一致,其原因可能是相比于溫帶樹種,山桐子在低溫下的抗逆性較弱,這些結果表明低溫環境對山桐子冬芽抗氧化酶活性的影響CAT最明顯,POD次之,SOD影響最小,可以看出CAT和POD指標對于山桐子冬芽的休眠過程有較為明顯的指示作用。。
植物激素是調控芽休眠過程的重要內部因素,內源激素之間的相互作用和動態平衡影響著休眠的進程。ABA含量在牡丹(Paeonia suffruticosa)的芽休眠期間增加,在休眠解除階段下降[34],這與山桐子冬芽的ABA含量變化一致,ABA含量的增加誘導了芽的休眠;而在山桐子冬芽休眠導入期,IAA含量增加,高濃度的IAA不利于芽的萌發[35],之后IAA含量降至較低水平,對休眠調控作用不顯著;作為促進休眠解除的赤霉素和細胞分裂素,在牡丹[34],杏[36],歐洲樺(Betula pubescens)[37]冬芽休眠導入期含量減少,隨著經歷低溫休眠的解除,赤霉素和細胞分裂素含量增加的變化規律,與山桐子冬芽GA3和tZR在休眠期的變化有明顯不同,山桐子在深休眠期GA3和tZR不僅沒有降低,還有所增大,這與懸鈴木冬芽休眠過程中的激素含量變化相似[12],對于未經低溫解除休眠的懸鈴木冬芽來說,外施赤霉素可以加深其休眠,隨著休眠的解除,赤霉素的促進休眠作用才解除[38],分析其原因可能是山桐子或懸鈴木冬休眠芽休眠導入與內源激素GA3含量急劇增加有關。說明南方系冬休眠類型冬芽生理活性比北方系冬休眠類型高,反映了其休眠深度較淺。內源激素之間的協調作用也影響這休眠的進程,分析發現,從休眠導入期到深休眠期,IAA、tZR、GA3、IAA+GA3+tZR與ABA的比值都在下降,說明這兩個時期ABA相對含量較高,對休眠的誘導起到主要作用,而隨著經歷足夠的低溫,休眠解除促進物質量分數增加,抑制物質量分數下降,這可能是GA3和tZR含量的增加抑制了ABA含量的增加。
3.3 結論
山桐子冬芽休眠具有淺冬休眠特性,其中休眠導入期、深休眠期、休眠解除期及內生長期分別為9—10月,11月,12—2月與3月上旬。山桐子冬芽內的可溶性糖和可溶性蛋白的含量具有與休眠變化季節適應規律;POD和CAT作為山桐子冬芽內的抗氧化酶,其活性不止與抗寒性密切相關,也與休眠的促進和解除有關;ABA能夠促進山桐子冬芽的休眠,在休眠解除期,tZR和GA3含量的增多可以促進休眠的解除,對ABA有抑制作用。

