含碳球團氣固協同還原特點及動力學研究
柴志鵬,丁學勇,居天華,劉金生,劉程宏
(東北大學 冶金學院,沈陽 110819)
近年來,含碳球團由于其自身反應性好、原料適用范圍廣等優點,在煉鐵工藝中得到了廣泛應用.含碳球團的還原機理對煉鐵工藝的優化有著重要的作用[1-2],眾多專家學者圍繞其還原特性以及還原機理開展了大量的研究.方展等[3]在600~1 000℃下,通過熱重實驗分析了H2還原鐵礦石球團的還原動力學,結果表明,還原過程由擴散和化學反應混合控制,活化能為39.49 kJ/mol.劉松利及陳雯等[4-6]研究了含碳球團還原過程中的限制性環節,認為還原過程中界面反應和擴散共同控制還原速率.趙文廣等[7]在800~1 000℃條件下,探討了白云鄂博鐵精礦含碳球團還原的動力學機理,結果表明,還原反應速度是由氣體內擴散控制,活化能為93.18 kJ/mol.滿毅等[8]在950~1 100℃的N2條件下研究了含碳球團還原反應的控速模型,發現還原過程由氣相擴散控制.而陳思明等[9]在對天青石含碳球團還原過程進行動力學分析后,認為還原速率由界面反應控制.寧國山等[10]在900~1 200℃條件下,研究了赤泥含碳球團還原過程,發現反應的限制性環節為碳氣化和界面反應,升高溫度有利于還原的進行.
目前多數關于球團的研究都是圍繞單一還原劑即煤基或氣基而展開的,其還原過程緩慢,還原效果受限.為了改善這一現狀,本文將煤基和氣基結合起來,以含碳球團的還原過程為研究對象,探索在氣基-固基協同條件下含碳球團的還原機理,對含碳球團在800~1 100℃下的還原熱力學及動力學進行分析,將各階段還原過程用動力學方程進行擬合,根據擬合結果,推斷出含碳球團在不同溫度下的限制性環節以及控速方程,從而為還原工藝的研究進一步奠定理論基礎.
1 實 驗
1.1 實驗原料
實驗中所用到的煤粉由某廠提供,用化學分析的方法測定了煤粉及其灰分的化學組成,檢測結果如表1和表2所列.

表1 煤粉樣品成分表(質量分數)Table 1 The chemical compositions of coal(mass fraction) %
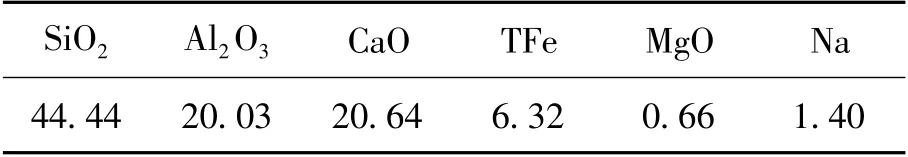
表2 煤粉灰分成分表(質量分數)Table 2 The chemical compositions of ash(mass fraction) %
由表1及表2可知,實驗所用煤粉中的固定碳質量分數為58.85%,揮發分質量分數為31.03%,灰分的質量分數為4.46%.灰分主要成分是SiO2,Al2O3和CaO.
煤粉的粒度分布如表3所列.從表中可以看出,本實驗所用煤粉樣品粒度較細,其中粒徑在75μm以下的煤粉所占的體積分數大約為85%,38μm以下的超過了50%,符合造球過程對于粒度的要求.
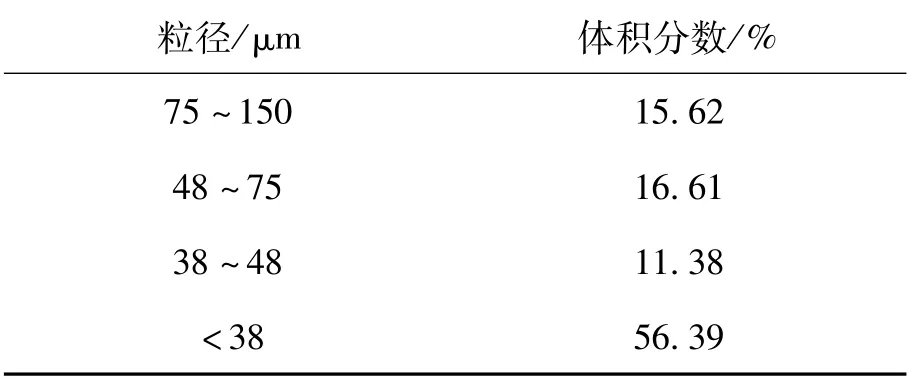
表3 煤粉粒度分布表Table 3 The particle distribution of coal
實驗中所用到的鐵礦粉由某廠提供,用化學分析的方法測定了其化學組成,檢測結果如表4所示.該鐵礦粉中TFe質量分數為62.45%,FeO質量分數為26.41%,其余成分以CaO和Al2O3為主,P和S質量分數較低,屬于鐵品位較高的鐵礦粉.

表4 鐵精礦樣品成分表(質量分數)Table 4 The chemical compositions of iron ore(mass fraction) %
1.2 含碳球團熱重還原實驗
本實驗過程在自制的熱重分析系統中進行,該系統由反應爐和天平測定及計算機記錄裝置3部分組成.為了更直接準確地表述還原過程中的反應分數,需要先去除揮發分的影響,即先將煤粉在700℃高溫下N2氣氛中保溫焙燒3 h,去掉其中的揮發分,隨后將處理過的煤粉置于900℃高溫下N2氣氛中保溫焙燒3 h,發現其重量幾乎沒有變化,表明揮發分已經基本去除.
實驗所用含碳球團全部由圓盤造球機制取,添加劑為質量分數1% 的膨潤土,球團直徑為10~15 mm,每次實驗用量1個球團.經過對不同碳氧比(0.8,1.0,1.2,1.4)的含碳球團反應后進行分析,發現當碳氧比為1.2時,還原效果更好,因此本文中含碳球團所選碳氧比為1.2.在實驗過程中,將干燥后的含碳球團放入坩堝中,并將坩堝放置于加熱管上端,啟動程序,開始加熱并通入N2作為保護氣氛,升溫速率為10℃/min.待溫度升到設定溫度時,通過調節升降按鈕下降加熱爐,待坩堝處于加熱爐中央時,切換為還原氣體(CO,H2,以及CO和H2的混合氣體),并開始記錄失重數據,還原氣的流量為1 L/min,由桌面控制系統調節.為了使反應充分進行,還原時間設置為60 min,還原過程中,計算機每隔15 s記錄一次失重數據,實驗結束后繪制相應的失重曲線.
1.3 反應分數的計算
在含碳球團還原反應中,由于含碳球團的還原過程不僅包括氧的損耗,還包括碳的損耗,因此表征含碳球團反應進行的程度常用反應分數來表示,含碳球團還原的反應分數表示為[11]:

式中,ΔM為含碳球團還原過程中某時刻失去的質量,g;Mmax為含碳球團還原過程中理論上可以失掉的最大質量,包括鐵氧化物的最大失氧量以及煤粉的最大失碳量,g.
1.4 熱力學理論分析
在含碳球團還原反應過程中,當采用CO或者H2作為還原劑參與還原反應時,鐵氧化物會與還原氣體發生一系列還原反應,且根據還原溫度的不同,鐵氧化物依次發生逐級還原反應.因為鐵有三種價態,即存在三種不同價態的鐵氧化物,分別為Fe2O3,Fe3O4,FeO.對于FeO而言,實際上Fe與O原子比可能與1∶1存在一定偏差,所以分子式可以寫成FexOy或者Fe0.95O,其還原歷程如下所示[12]:
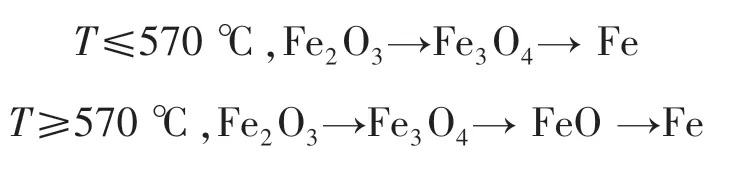
表5為還原過程中鐵氧化物氣體還原反應與溫度的關系,描述了不同溫度段發生的還原反應.

表5 鐵氧化物氣體還原反應與溫度的關系Table 5 Relationship between the iron oxide gas reduction and temperature
如圖1所示,反應(e)在接近底端處,說明該反應比較容易發生,即在還原過程中少量的CO就可以將Fe2O3還原成Fe3O4.對于CO而言,當溫度為570℃時,反應(f)~(h)相交于相同的一點,說明當溫度低于570℃時發生反應(g),CO將Fe3O4還原為Fe,沒有FeO生成;當溫度大于570℃時,反應(f)(h)同時進行,生成了FeO,并且FeO進一步參與反應.而對于H2來說,當溫度低于570℃時,發生反應(3),H2將Fe3O4還原為Fe;當溫度高于570℃時,反應(b)(d)同時進行,并生成FeO和Fe.
同時,由圖1也可以看出,在整個還原反應過程中,CO和H2在還原鐵氧化物的過程中存在一定的區別,即當溫度不斷升高的時候,所需CO的濃度是逐漸增加的,而H2的濃度逐漸降低.對于FeO來說,當溫度低于810℃時,CO的還原能力要強于H2;而當溫度高于810℃時,H2的還原能力逐漸增強.
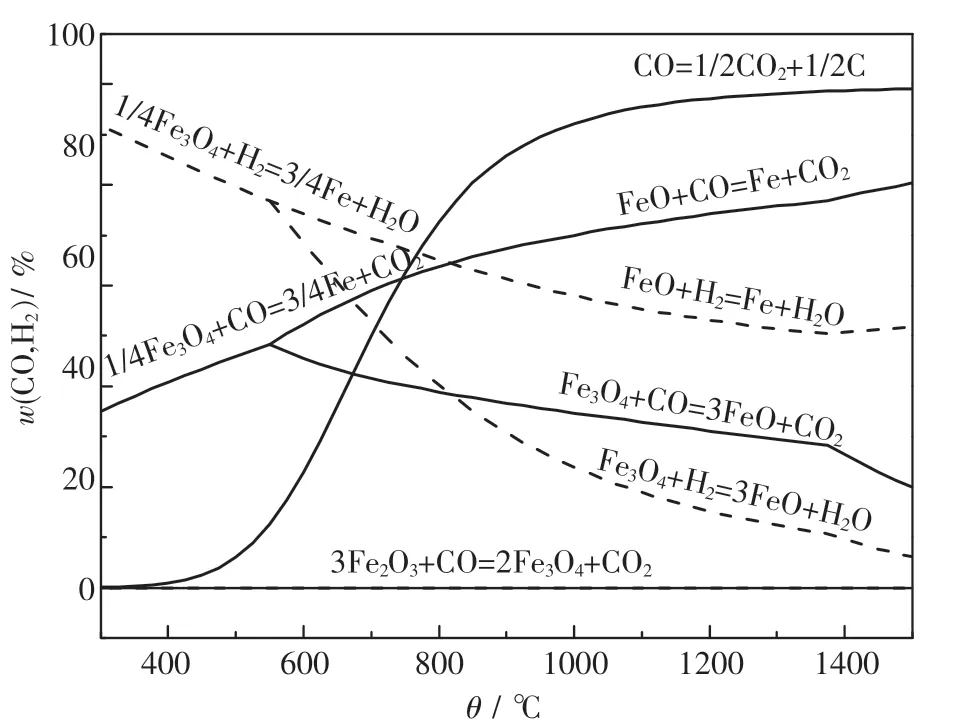
圖1 CO和H 2還原鐵氧化物的平衡圖Fig.1 CO and H 2 reduction of the iron oxide equilibrium
2 結果與討論
2.1 球團質量及反應分數隨時間的變化
如圖2所示,在含碳球團還原過程中,同一氣氛同一時間條件下,溫度越高,球團失重越大,說明球團參與反應的程度隨著溫度的升高也在逐步提高,升高溫度對球團的還原起到了一定的促進作用.而在同一氣氛同一溫度下,隨著還原時間的增加,球團的質量先是快速下降隨后再緩慢降低,即在反應過程中,球團的失重速率先增大后減小.而當含碳球團在同一溫度同一時間不同氣氛條件時,球團的質量變化也有一定的差異.由圖2(d)可知,當氣氛為單一H2時,球團失重最多,表明在單一H2氣氛中鐵氧化物的還原反應進行得更充分,還原速率更快,還原反應進行得更徹底.
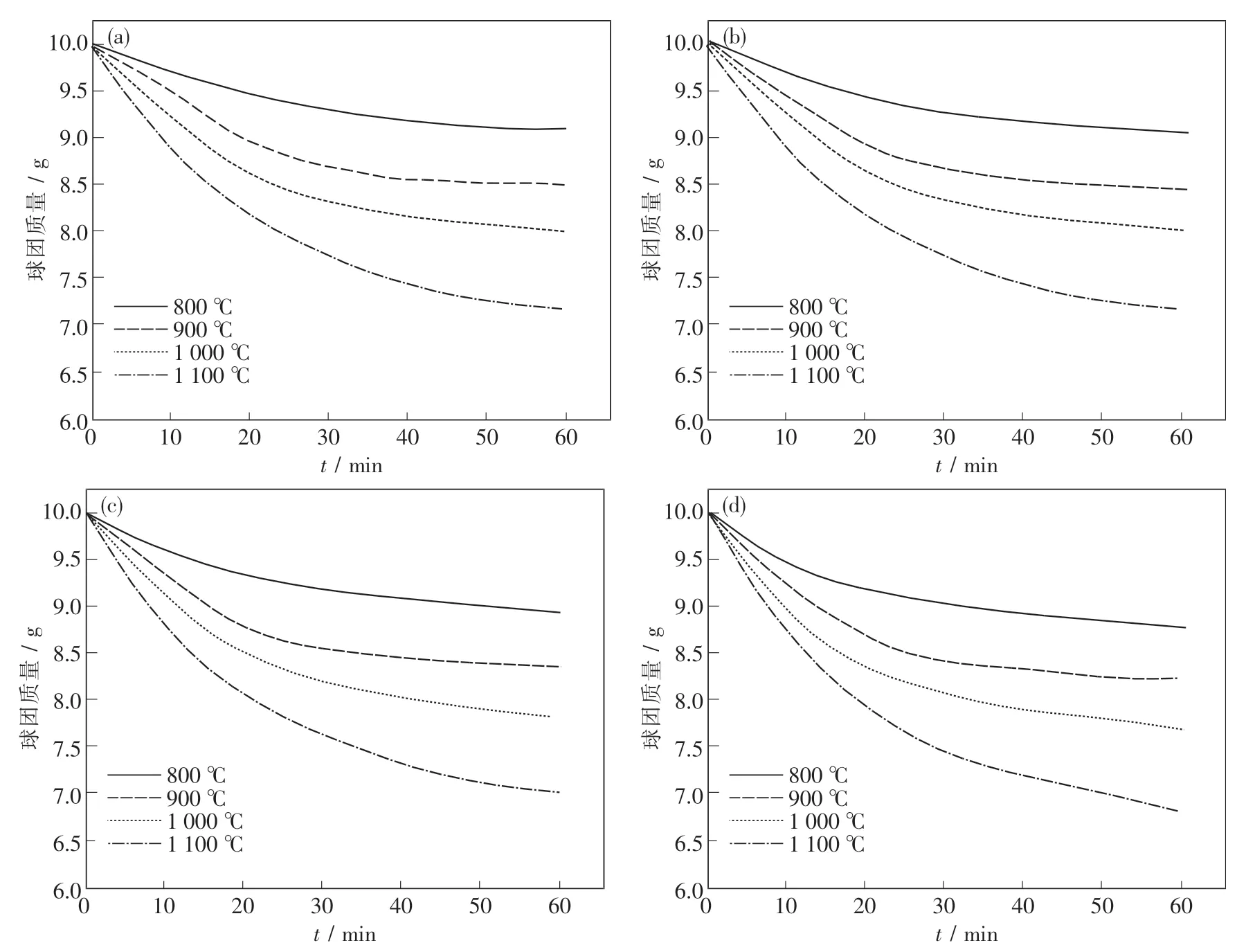
圖2 不同氣氛不同溫度下含碳球團質量隨還原時間的變化Fig.2 Change in mass over time at different temperatures in different atmosphere
圖3為單一H2氣氛中不同溫度下含碳球團的反應分數隨時間變化的曲線.從圖中可以看出,隨著還原時間的增加,反應分數逐漸變大,在前30 min內反應分數增幅明顯.在還原60 min、還原溫度為1 100℃的情況下,反應分數達到最大值0.81.這表明在單一H2氣氛中,升高溫度有利于還原反應的進行.

圖3 不同溫度下含碳球團的反應分數隨還原時間的變化Fig.3 Change of reaction fraction of carbon-containing pellets with time at different temperatures
反應過程中,隨著時間的增加,反應分數逐漸增大,表明球團表面以及內部發生著一系列劇烈的物理化學反應,包括鐵氧化物與還原氣體以及碳之間的還原反應.反應分數不斷增大的原因可能是隨著還原反應的進行,鐵氧化物和碳顆粒之間產生了一定的空隙,球團孔隙度增大,更多的還原氣體通過擴散進入球團內部,進一步參與反應.在還原了一定的時間后,反應分數增幅放緩,表明還原反應已逐步變弱.
2.2 還原產物化學分析
實驗(單一H2氣氛中)后的含碳球團中全鐵的質量分數較原料中全鐵的質量分數有一定提高,且隨著溫度的升高而增加,如圖4所示.當溫度為1 100℃時,含碳球團中全鐵的質量分數達到了79.66%,這是由于煤粉中的碳與鐵氧化物發生反應,碳和氧都發生了一定的損耗,導致球團質量變小,從而使得全鐵質量分數增加.從圖中也可看出,當溫度高于800℃時,FeO的質量分數隨著溫度的升高迅速減小,而金屬鐵的質量分數明顯上升,在1 100℃時達到了73.96%.此時,還原產物主要由金屬鐵組成,同時含有少量的FeO.
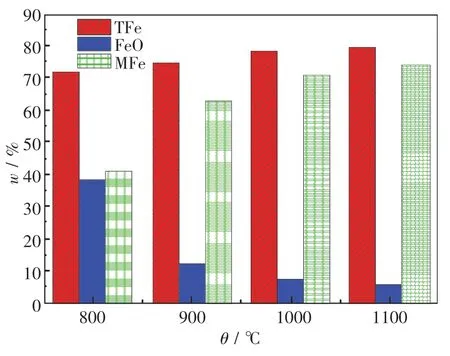
圖4 含碳球團還原產物的化學分析結果Fig.4 Chemical analysis results of reduction products of carbon-containing pellets
2.3 反應動力學分析
根據前人的研究工作[13-14]可知,含碳球團還原過程主要包括碳的氣化反應、鐵氧化物的界面還原反應以及擴散等.
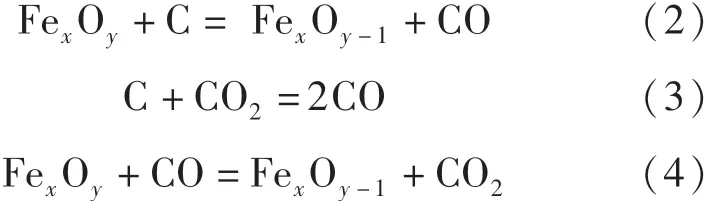
式(2)~(4)為含碳球團還原過程中主要的反應.在還原過程中,含碳球團中的固體碳顆粒與氣相中的CO2發生的式(3)稱為碳氣化反應.孟繁明等[15]對含碳球團碳氣化的研究表明,碳氣化反應對還原過程中鐵氧化物的還原、物料混合的狀態以及反應后球團內部結構的變化有著一定的影響,是含碳球團反應過程中不可忽視的環節.此外,鐵氧化物的界面還原反應與擴散也同樣影響著球團的還原過程.
為探究本實驗過程中含碳球團還原過程的限制性環節,對含碳球團還原過程做出以下假設:①含碳球團還原中的碳氣化以及鐵氧化物的還原反應為一級反應;②含碳球團內部各向同性,內部碳顆粒和鐵氧化物顆粒分布均勻.根據上述機理分析和假設條件,結合前人研究含碳球團還原機理時所用動力學模型[16-17]得出有關限制性環節的結論,本文認為含碳球團還原過程的限制性環節可能有碳氣化、界面反應和擴散等.
若認為碳氣化反應為還原過程的限制性環節,則反應的控速方程為
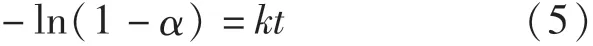
若認為擴散反應為還原過程的限制性環節,則反應的控速方程為
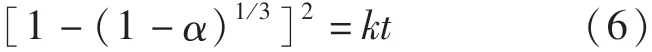
若認為界面反應為還原過程的限制性環節,則反應的控速方程為
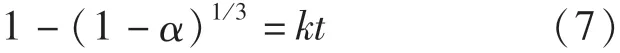
式中:α為反應分數;k為反應速率常數,s-1;t為時間,min.
以碳氣化、擴散及界面反應模型處理實驗數據,建立模型與還原時間的關系圖,如圖5~7所示.通過線性擬合,根據不同的擬合效果,結合各限制性環節所對應的活化能,找出最優的限制性環節.當某一模型的擬合度最高時,假設該模型所對應的動力學方程即為還原過程中的限制性環節,結合表觀活化能大小以及表觀活化能范圍與限制性環節之間的關系進一步確定具體的限制性環節.
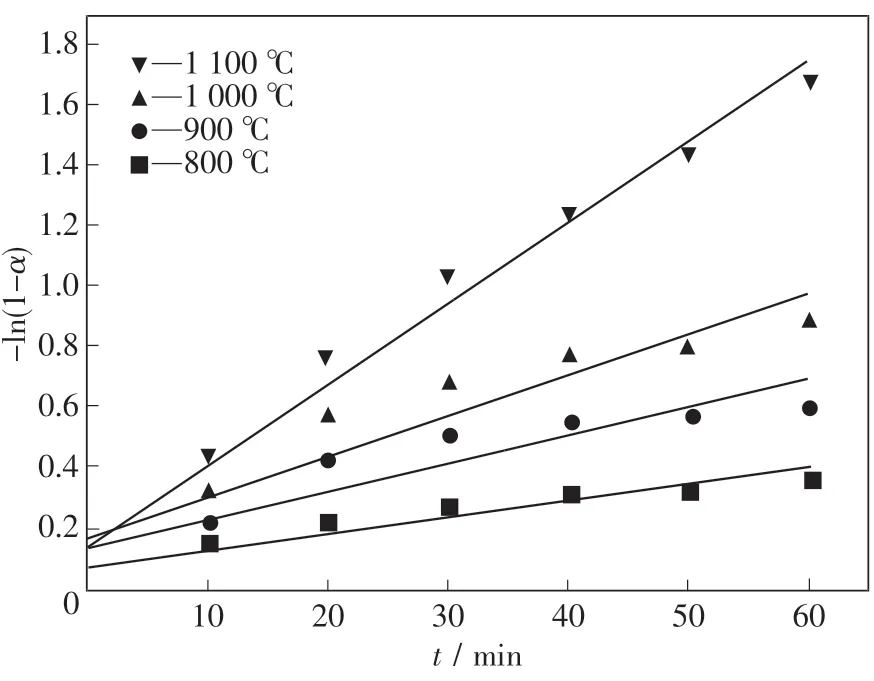
圖5 碳氣化為限制性環節的擬合結果Fig.5 The fitting results of carbon gasificationas a restrictive link
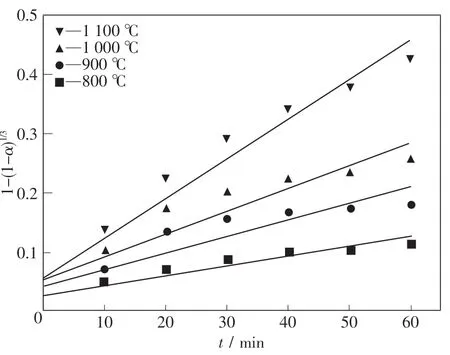
圖6 界面反應為限制性環節的擬合結果Fig.6 The fitting results of the interface reaction as a restrictive link
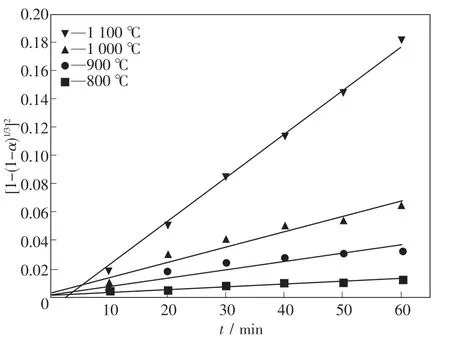
圖7 擴散為限制性環節的擬合結果Fig.7 Fitting results of gas diffusion as a restrictive link
表6為3種模型經過線性擬合的方法得到的結果.由此可知,在整個還原過程中,以擴散為限制性環節對還原過程進行擬合得到的擬合度最高,表明當擴散為限制性環節時擬合效果最好,擴散環節最有可能是本實驗條件下還原過程的限制性環節.
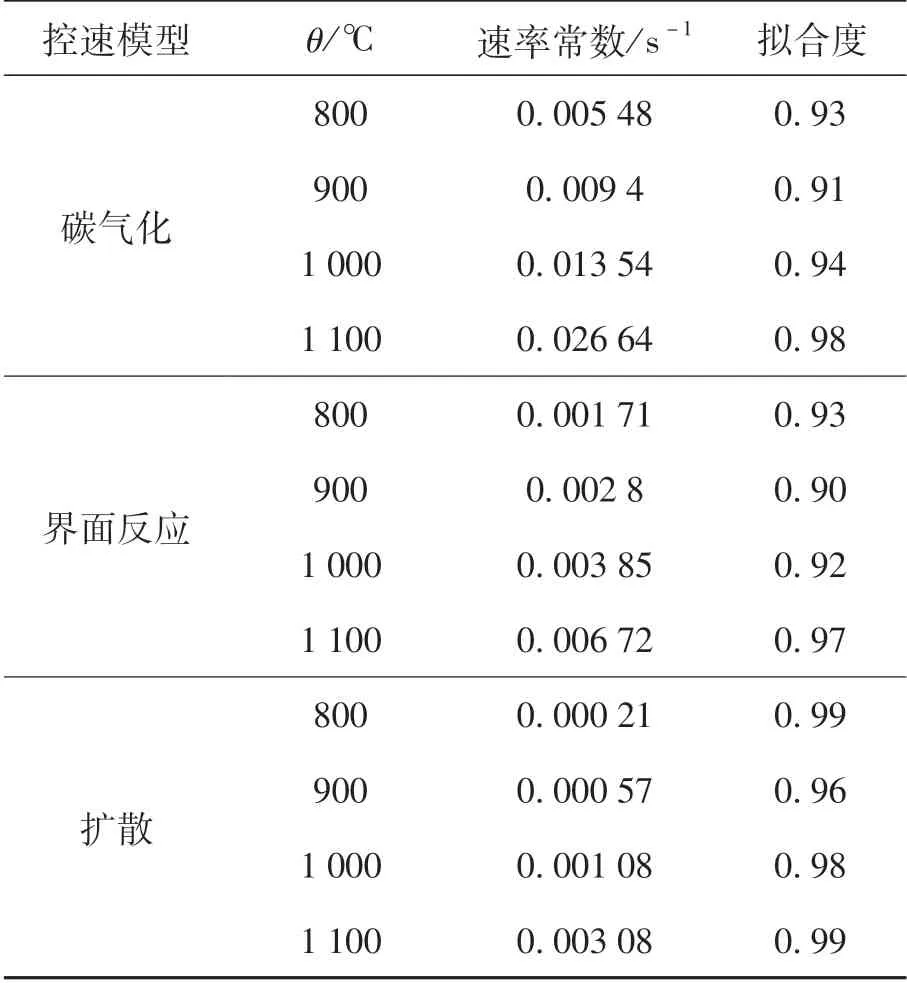
表6 含碳球團還原過程動力學各模型擬合結果Table 6 Reduction process dynamics model fitting results in pellets
2.4 活化能的計算
由上述計算得到各個溫度下含碳球團的還原速率常數,根據式(8)~(9)Arrheniu方程求解反應活化能,并得到lnk與1/T的曲線圖,如圖8所示.
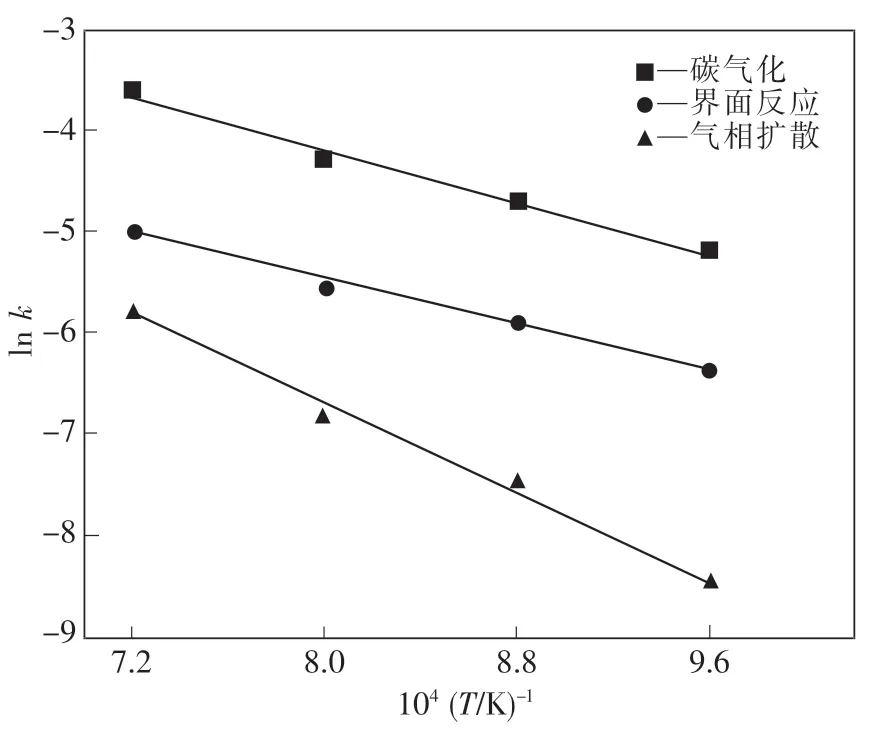
圖8 lnk與1/T的線性回歸曲線Fig.8 lnk and 1/T linear regression curve
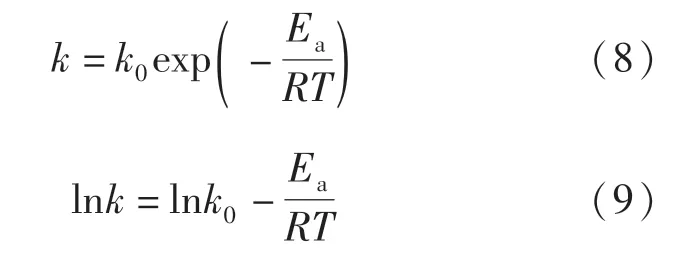
式中,Ea為活化能,kJ/mol;k0為指前因子,s-1;R為摩爾氣體常數,為8.314 J/(mol·K);T為溫度,K.
若碳氣化為還原過程的限制性環節,相對應的含碳球團的活化能為54.73 kJ/mol;若界面反應為還原過程的限制性環節,反應活化能為47.45 kJ/mol;若擴散為還原過程的限制性環節,反應活化能為93.18 kJ/mol.
2.5 限制性環節的確定
由上述計算可知,當以擴散為還原過程的限制性環節時,其表觀活化能要大于以碳氣化和界面反應為限制性環節時的表觀活化能,表明在還原過程中擴散環節所需要的能壘較高,擴散對還原的影響要大于碳氣化和界面反應.結合前人對還原過程中各限制性環節下活化能的研究工作[18],當界面反應為還原過程的限制性環節時,其活化能大于400 kJ/mol;當碳氣化為還原過程的限制性環節時,其活化能為230~355 kJ/mol;當擴散為還原過程的限制性環節時,其活化能小于150 kJ/mol.在本文中,碳氣化與界面反應為限制性環節時的活化能都不在這一范圍內,而擴散為限制性環節時的活化能符合這一范圍.綜合還原過程的擬合結果,當擴散為限制性環節時的擬合度要高于界面反應和碳氣化的擬合度,因此在本文中擴散被認為是還原過程的限制性環節.
3 結 論
(1)在含碳球團氣固協同還原過程中,溫度越高,反應分數越大,還原反應進行得越徹底.當溫度為1 100℃、還原時間為60 min時,反應分數達到最大值0.81.
(2)在含碳球團氣固協同還原過程中,不同還原氣氛對含碳球團的還原有一定的影響.當溫度為1 100℃、還原時間為60 min、還原氣氛為單一H2時,含碳球團失重最大,還原效果最好.在反應前期,還原速率快速增加,隨著反應的進行,還原速率逐漸放緩.
(3)對含碳球團還原過程進行動力學分析可知,當擴散模型為氣固還原過程的限制性環節時,擬合效果最好,表觀活化能為93.18 kJ/mol.

