棗癭蚊圖爾病毒(DjTV-2a)PCR檢測方法的建立
賀鵬鵬 馬光皇 劉語涵 張來斌 肖海兵 楊明祿


摘 ? ?要:為了建立棗癭蚊圖爾病毒(DjTV-2a)的 PCR 檢測方法,通過提取棗癭蚊總基因組 DNA 和設計 DiTV-2a 特異性引物,以DNA模板(80,100,120 ng),引物濃度(0.7,0.8,0.9 μmol·L-1),dNTP(0.2,0.3,0.4 mmol·L-1),Taq酶(1.25,1.35,1.45 U)為變量,采用正交設計篩選最佳 PCR 反應體系,建立與優化 DjTV-2a 的 PCR 檢測方法。結果表明:正交設計的9組 PCR 反應體系均能夠擴增和檢測該病毒,且DNA模板100 ng,引物0.7 μmol·L-1,dNTPs 0.4 mmol·L-1和Taq酶 1.35U反應體系擴增效果最佳;對最佳 PCR 反應體系進行退火溫度(46,48,50,52,54,56 ℃)優化,發現52 ℃為引物最佳退火溫度。綜上分析,在 50 μL 反應體系下,引物退火溫度為52 ℃,模板 DNA 量100 ng,引物0.7 μmol·L-1,dNTPs 0.4 mmol·L-1,Taq酶 1.35 U是 DiTV-2a 的最佳PCR擴增體系,可用于該病毒的檢測。
關鍵詞:棗癭蚊;棗癭蚊圖爾病毒;PCR
中圖分類號:S476 ? ? ? ? ? ? 文獻標識碼:A ? ? ? ? ? ? DOI 編碼:10.3969/j.issn.1006-6500.2021.11.018
Establishment of PCR Method for Detection of Dasineura jujubifolia Toursvirus 2 (DjTV-2a)
HE Pengpeng1,2, MA Guanghuang1,2, LIU Yuhan1,2, ZHANG Laibing1,2, XIAO Haibing1,2,3, YANG Minglu1,2,3
(1.College of Plant Science, Tarim University, Alar, Xijiang 843300, China; 2.Southern Xinjiang Key Laboratory of IPM of Tarim University, Alar, Xijiang 843300, China; 3.Scientific Observing and Experimental Station of Crop Pests in Alar.Ministry of Agriculture, Alar, Xinjiang 843300, China)
Abstract:To establish a PCR detection method for Dasineura jujubifolia toursvirus 2 (DjTV-2a), the experiment extracted the total genomic DNA of Dasineura jujubifolia, designed DiTV-2a specific primers, the DNA template (80, 100, 120 ng) and the primer concentration (0.7, 0.8, 0.9 μmol·L-1), dNTP (0.2, 0.3, 0.4 mmol·L-1) and Taq enzyme (1.25, 1.35, 1.45 U) were as variables, screening the optimum PCR reaction system to establish and optimize the PCR detection method of DjTV-2a by the orthogonal design. The results showed that all the nine group of PCR reaction systems from the orthogonal design could amplify and detect the virus, but the reaction system of 100 ng DNA template, 0.7 μmol·L-1 primers, 0.4 mmol·L-1 dNTPs and 1.35U Taq enzyme had the best amplification effect. For the best PCR reaction system, the optimum annealing temperature of the primers were 52 ℃ in the six treatment including 46, 48, 50, 52, 54, 56 ℃. In summary, in a 50 μL reaction system, 52 ℃ primer annealing temperature, 100 ng DNA template, 0.7 μmol·L-1 primer, 0.4 mmol·L-1 dNTPs and 1.35 U Taq enzyme is the optimum PCR amplification system for DiTV-2a which can be used for the detection of the virus.
Key words: Dasineura jujubifolia; Dasineura jujubifolia toursvirus 2(DjTV-2a) ; PCR
棗癭蚊(Dasineura jujubifolia)又名棗葉癭蚊[1],廣泛分布于我國棗產區。該蟲1966年首次于山東地區發現并報道,鑒定為 Contarinia Sp.[2];也有 Contarinia datifolia Jiang和Dasineura datifolia 等名稱被使用[3-6]。隨著新疆紅棗產業的發展,棗癭蚊在新疆紅棗產區為害猖獗[7-8],連年造成紅棗座果率下降、產果品質下跌的嚴重影響,導致果農損失嚴重[9]。課題組在研究棗癭蚊線粒體基因組時,發現了一種雙鏈環狀昆蟲病毒基因組,經進一步鑒定為棗癭蚊圖爾病毒2(Dasineura jujubifolia toursvirus 2,DjTV-2a)[10],這種病毒是是囊泡病毒科圖爾病毒屬的第二位成員和該科唯一寄生雙翅目昆蟲的種類,可能是棗癭蚊的重要天敵之一,對棗癭蚊為害擴散起到抑制作用。一般認為它們在田間常由寄生蜂傳播[11],因此研究其分布范圍及寄主媒介有重要意義,但棗癭蚊幼蟲感染后癥狀不明顯,從表觀上很難進行區分,所以建立分子檢測方法十分必要。
本研究擬通過設計特異性引物和優化反應體系以建立 DjTV-2a 的 PCR 檢測方法,為進一步開展 DjTV-2a 相關研究提供技術支持。
1 材料和方法
1.1 試蟲
棗癭蚊幼蟲采自塔里木大學棗園,十二團十一連棗園,阿克蘇市新和縣,哈密市,張掖市。
1.2 試劑與儀器
TBE 緩沖液(實驗室配制);瓊脂糖(BIOWEST);10×PCR buffer、Taq 酶、DNA Marker(康為世紀);柱式 DNA 提取試劑盒(生工生物工程股份有限公司)等。
1.3 儀器
基因擴增儀( BSW-6T-II 上海啟步生物科技有限公司);紫外凝膠成像儀( Gel Doc XR+上海旦鼎國際貿易有限公司);高速離心機( PICO21 Thermo Fisher);高通量組織研磨器(SCIENTZ-48寧波新芝生物科技股份有限公司);電泳儀(DYCP-32B北京六一生物科技有限公司);電熱恒溫水浴鍋(DK-80上海精宏實驗設備有限公司)等。
1.4 試驗方法
1.4.1 DNA提取 鑒于棗癭蚊蟲體較小,本試驗采取兩種 DNA 提取方法。PCR 緩沖液提取法[12]:取3頭病蟲分別放入標記好的3個1.5 mL EP 離心管中,加入10 μL PCR緩沖液,放置于 20 ℃ 冷凍2~3 min后,用移液槍槍頭研磨勻漿;研磨結束后再次加入40 μL PCR緩沖液和3 μL蛋白酶K,以上操作均需在冰上進行。渦旋振蕩使樣品混勻后,將離心管置于水浴鍋中,56 ℃ 水浴 2 h 后(水浴期間多次翻轉離心管),95 ℃ 水浴5 min,水浴結束后以5 000 r·min-1離心10 min,-20 ℃保存備用。試劑盒提取法:取同樣頭數試蟲分別進行 DNA 提取,根據試劑盒說明進行。
1.4.2 DNA檢測 使用微量核酸檢測儀分別檢測提取的核酸質量和濃度,并進行瓊脂糖凝膠電泳檢測。
1.4.3 引物設計 使用primer 5根據 DjTV-2a 病毒衣殼蛋白(Capsid protein,CP)基因序列設計特異性引物,引物由生工生物工程(上海)股份有限公司合成,預計擴增 DNA 片段長度為 396 bp,引物序列:上游引物(F)5-AGCACTTCCACACACTGAGA-3,下游引物(R)5-AGTACTAGCAAAATGTCCACCA-3。
1.4.4 PCR反應體系優化 使用提取的棗癭蚊圖爾病毒 DNA 為模板,對 DNA 模板用量、引物濃度、dNTP 濃度、Taq 酶用量4個因素進行正交試驗。
PCR反應程序:預變性95 ℃ 3 min;變性95 ℃ 30 s、退火54 ℃ 30 s、延伸72 ℃ 30 s,35個循環;后延伸72 ℃ 3 min。
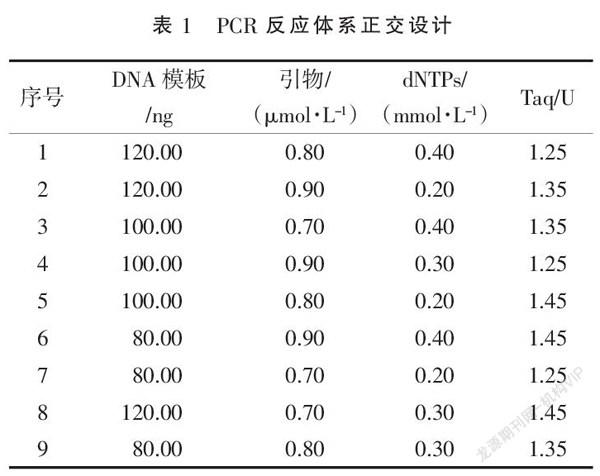
1.4.5 PCR反應體系設計 反應體系采用L9(34)正交設計(表1),對dNTP和模板等用量進行優化,每組重復3次。
1.4.6 退火溫度優化 以期獲得最佳反應體系,針對引物退火溫度進行篩選,根據引物 Tm 值,設置退火溫度46~56 ℃,設置梯度為46,48,50,52,54,56 ℃。
1.4.7 靈敏度檢測 將所使用 DNA 模板按梯度稀釋:5,52,53,54,55倍,后進行凝膠電泳檢測。
1.4.8 瓊脂糖凝膠電泳及測序 取 PCR 產物、DNA Marker 5 μL混合上樣液 1 μL 加入到點樣孔中,于 2% 瓊脂糖凝膠100 V 30 min進行電泳;電泳結果于凝膠成像系統中觀察并保存。將條帶單一、清晰的 PCR 產物送往上海生工測序。
1.5 數據分析
測序序列在 NCBI 進行 Blast 分析,根據 PCR 擴增產物電泳條帶位置、數量及彌散情況等進行檢測方法分析。
1.6 PCR檢測方法的應用
使用上述完善的PCR檢測體系,對塔里木大學棗園,十二團十一連棗園,阿克蘇市新和縣,哈密市,張掖市蟲樣進行PCR檢測。
2 結果與分析
2.1 DNA提取方法
PCR緩沖液提取法與試劑盒提取法的電泳結果詳見圖1。PCR 緩沖液提取法所測得的核酸濃度分別是7.5,10.3,8.6 ng·μL-1,A260/A280值在2.0左右;試劑盒提取測得的核酸濃度分別是47.9,60.7,56.3 ng·μL-1,A260/A280值在1.8左右,經凝膠電泳檢測條帶清晰。因此,本試驗采用試劑盒提取方法。
2.2 PCR擴增及序列分析
PCR 擴增目標產物為396 bp,電泳圖譜顯示位置正確(圖2),經 NCBI 數據庫 Blast分析發現與 DjTV-2a 病毒衣殼蛋白(Capsid protein,CP)基因相似度100%,引物特異性較好。
2.3 正交設計結果
正交設計的9組擴增結果(圖2)差異顯著,不同試驗體系中不同組分對實驗結果得影響各不相同,試驗中引物用量對結果影響較大,表現在不同擴增條帶的差異;其中第3組結果所得條帶最為清晰,第7組結果所得條帶則顯示不明顯;確定最優體系為:模板100 ng,10×PCR buffer 5 μL,引物0.70 μmol·L-1,dNTPs 0.40 mmol·L-1,Taq酶 1.35 U。
2.4 退火溫度
由圖3得知,隨著引物退火溫度的改變,PCR產物條帶差異明顯,在退火溫度在46~56 ℃電泳條帶可見,但在52 ℃(10-12泳道)所得條帶最為清晰明亮,穩定性最好,沒有出現引物二聚體和條帶彌散的現象,因此在優化體系中選擇52 ℃為最佳退火溫度。2.5 靈敏度檢測
對模板DNA進行不同濃度的稀釋,發現隨著稀釋條帶亮度下降,由圖得知當稀釋倍數達到54時,擴增條帶呈現不清晰,但仍能看到相應條帶(圖4)。2.6 優化體系檢驗
利用上述所獲得的優化體系進行PCR擴增,結果(圖5)得到清晰穩定的擴增條帶,說明優化體系在 50 μL 反應體系下,10×PCR buffer 5 μL,引物最佳退火溫度為52 ℃,模板 DNA 量100 ng,引物0.7 μmol·L-1,dNTPs 0.4 mmol·L-1,Taq酶 1.35U穩定,適合作為PCR檢測棗癭蚊圖爾病毒的方法;并將產物送檢測序,序列結果與該病毒基因序列一致。
2.7 檢測結果
使用優化后的PCR反應條件,對各個采集地點和塔里木大學不同采集月份的蟲樣進行檢測,發現:此病毒在塔里木大學和十二團均有發現,且塔里木大學校園內檢測陽性率達到10.15%,其余地域暫時沒有病毒流行(表2);此病毒6月份開始發生,7月份在塔里木大學棗園內大流行,此時檢測陽性率為10.5%(表3)。
3 結論與討論
PCR反應體系中,模板DNA的質量是后續試驗的關鍵[13],本研究用PCR緩沖液法和試劑盒提取法進行比較,在檢測后發現試劑盒提取法所得核酸含量較高。PCR緩沖液法提取DNA缺少漂洗和除雜的過程,經檢測OD值也不理想,可能雜質較高沒考慮作為優化體系模板使用,而試劑盒法有蛋白質、其他雜質的的分離過程,沒有有機物污染,獲得基因組DNA質量較高[14],通常模板用量過高條帶可能出現拖尾,用量過低,擴增條帶則會不清晰[15-18],而且模板DNA若是雜質過多,則會影響Taq酶的活性,引物用量過高或設計原因會產生二聚體和非特異性擴增,而引物用量過低,則會產生擴增產物減少等現象[19-20]。通過PCR試劑組分正交設計與反應條件優化,引物0.70 μmol·L-1,dNTPs 0.4 mmol·L-1,Taq酶 1.35 U的50 μL反應體系和52 ℃退火溫度擴增效果較好。
經過對采集地和塔里木大學內不同采集月份的蟲樣進行檢測,發現塔里木大學內蟲樣陽性率最高,周邊團場次之,繼續對塔里木大學內不同月份蟲樣進行檢測后,發現6月有病毒流行跡象,7月是此病毒大發生的時期,猜測這可能與寄生蜂的出現有關,6月份伴隨棗癭蚊寄生蜂的出現也加速此病毒的傳播速度與傳播范圍。
此病毒具有棗癭蚊生物防治的應用潛力,因此該PCR檢測方法用于后續棗癭蚊圖爾病毒種群分布及媒介寄主鑒定等研究工作,對揭示其傳播生物學具有重要意義。
參考文獻:
[1] JIAO K L, HAN P J, YANG M L, et al. A new species of gall midge (Diptera: Cecidomyiidae) attacking jujube, Ziziphus jujuba in China[J]. Zootaxa, 2017, 4247(4): 487-493.
[2] 章宗江. 棗樹的一種新害蟲——棗癭蚊的研究[J]. 山東農業科學, 1966(2): 51-54.
[3] 袁青鋒, 周運剛, 鄭新疆, 等. 4種殺蟲劑防控紅棗棗癭蚊效果比較[J]. 中國植保導刊, 2015, 35(12): 58-59.
[4] 張仁福, 于江南, 斯迪克·米吉提, 等. 棗癭蚊幼蟲空間分布型及抽樣技術研究[J]. 新疆農業大學學報, 2010, 33(1): 23-26.
[5] 卜文俊. 中國癭蚊科(雙翅目)昆蟲分類研究[D]. 天津: 南開大學, 1990.
[6] 江興培. 中國癭蚊科分類初步研究[D]. 重慶: 西南農業大學, 1990.
[7] 訾莉莉. 阿拉爾墾區棗樹“兩蟲一病”的防治研究[D]. 阿拉爾: 塔里木大學, 2018.
[8] 許瑛. 阿拉爾市棗園4種病蟲害發生動態及黑斑病對果實品質的影響[D]. 石河子: 石河子大學, 2017.
[9] 畢海燕, 朱曉鋒, 阿布都克尤木·卡德爾, 等. 不同藥劑對棗癭蚊的防治效果評價[J]. 新疆農業科學, 2014, 51(5): 915-919.
[10] WANG J, YANG M, XIAO H, et al. Genome analysis of Dasineura jujubifolia toursvirus 2, a novel ascovirus[J]. Virologica Sinica, 2020, 35(2): 134-142.
[11] ARAI E, ISHII K, ISHII H, et al. An ascovirus isolated from Spodoptera litura (Noctuidae: Lepidoptera) transmitted by the generalist endoparasitoid Meteorus pulchricornis (Braconidae: Hymenoptera)[J]. The Journal of General Virology, 2018, 99(4): 574-584.
[12] 宋月, 樊永亮, 武麗娟, 等. 蚜蟲內共生菌基因組DNA提取方法的比較和優化[J]. 植物保護學報, 2014, 41(6): 643-648.
[13] 高麗云, 陳杰, 胡小龍, 等. 金鐵鎖SSR-PCR反應體系的建立與優化[J]. 云南農業大學學報:自然科學, 2019, 34(6): 1024-1032.
[14] 薩姆布魯克 J, 拉塞爾 DW. 分子克隆實驗指南[M]. 黃培堂, 譯. 3版. 北京: 科學出版社, 2002.
[15] 王梅, 趙晨迪, 胡忠良, 等. CYP2C19基因多態性PCR擴增體系的正交優化與驗證[J]. 基因組學與應用生物學, 2019, 38(5): 1990-1996.
[16] 謝家楠, 郭建軍, 金道超. 白背飛虱ISSR-PCR反應體系構建的正交設計優化[J]. 植物保護, 2014, 40(2): 109-112.
[17] 劉永剛, 漆永紅, 趙麗娟, 等. 桃蚜基因組DNA提取及SSR反應體系優化和應用[J]. 植物保護, 2009, 35(4): 96-100.
[18] 張敏哲, 龐保平, 周曉榕, 等. 寬翅曲背蝗SSR反應體系的優化[J]. 內蒙古農業大學學報(自然科學版), 2013, 34(3): 26-31.
[19] 徐顯異, 陸婷, 田嘉, 等. 橡膠草及其近緣種ISSR反應體系及擴增程序的優化[J]. 分子植物育種, 2019, 17(12): 4007-4015.
[20] 賈新平, 孫曉波, 梁麗建, 等. 二月蘭SSR-PCR反應體系的優化及引物篩選[J]. 中國農學通報, 2017, 33(5): 40-46.
收稿日期:2021-08-04
基金項目:兵團財政科技計劃資助(2020DA003,2019DA001));塔里木大學研究生科研創新項目(TDGRI202019)
作者簡介:賀鵬鵬(1995—),男,河南商丘人,在讀碩士生,主要從事農業昆蟲與害蟲防治方面研究。
通訊作者簡介:楊明祿(1976—),男,山東夏津人,教授,主要從事農業昆蟲與害蟲防治方面研究。

