生物絮團系統中溫度突變對日本囊對蝦腸道和水體微生物多樣性的影響
秦海鵬,王 博,廖栩崢,胡世康,孫成波
(廣東海洋大學水產學院,廣東湛江 524088)
0 引言
日本囊對蝦(Marsupenaeus Japonicus)是中國重要的蝦類養殖品種[1-2]。目前日本囊對蝦的養殖主要以池塘養殖為主,養殖密度偏低,同時,又受底質選擇[3]、病害頻發[4]、同類相殘[5]等因素的影響,養殖難度加大。生物絮凝技術(Bio-flocs technology,BFT)是一項有效降低飼料系數、提高養殖成活率并減少養殖尾水排放,解決當前水產養殖業飼料成本高昂和環境污染嚴重等問題的有效替代技術[6]。隨著生物絮團技術成為了中國水產養殖技術研究的熱點,生物絮團相關的研究逐漸廣泛開展。環境微生物群落對水生動物腸道菌群結構的形成有重要的影響[7-8]。環境微生物對蝦腸道內存在演替規律[9-10]。目前的研究表明,長毛對蝦(Fenneropenaeus penicillatus)、凡 納 濱 對 蝦(Litopenaeus vannamei)腸道菌群的結構受到水環境微生物群落的影響[11-13]。外界環境影響了生物絮團菌群的分類學特征及其功能[14],水生環境可以影響微生物群落的組成和豐度[15],溫度是影響活性污泥系統脫氮除磷效果的關鍵因素之一,環境溫度對于氮磷的去除效果有重要影響[16-17]。硝化、反硝化細菌對環境的適宜溫度存在差異[18-19]。微生物有其最適宜的生長溫度,當溫度高于或低于該溫度均會影響其活性,從而影響脫氮除磷效果及其穩定性。本實驗針對溫度突變條件下水質和微生物多樣性的變化情況,探索生物絮團協同面臨溫度突變脅迫時的生物絮團系統的功能和結構的變化,以期為日本囊對蝦的生物絮團系統養殖提供一定的數據參考。
1 材料與方法
1.1 實驗材料
實驗在水體體積250 L的藍色塑料桶中進行,生物絮團用15 μm的篩絹網從鹽度(28.0±0.7)‰水體的養殖池中撈取。日本囊對蝦取自廣東海洋大學水產學院東海島海洋生物研究基地,為同一批蝦苗培養而成,蝦體色正常,表觀健康無病,體長為9.20±0.04 cm、體質量為9.53±0.71 g,實驗前暫養1周。
1.2 實驗設計
實驗將日本囊對蝦隨機分為2個處理組,每組3個平行,實驗對蝦密度為250尾/m3,對照組為經過消毒的潔凈海水,日換水量20%(半封閉養殖系統),實驗組為初始量20 mL/L的生物絮團海水(生物絮團系統),實驗周期35天。在第30天(實驗組與對照組水質保持1周的穩定后)實驗組與對照組進行溫度突變脅迫,溫度驟升10℃。實驗過程中24 h連續充氣。本實驗選取實驗第26天至35天之間的情況進行分析(設定為第1天至第10天)。投喂人工配合飼料(粵海牌對蝦飼料3#料),每天定時投喂(4餐/天),日投喂量為體質量的5%~7%。
1.3 水樣收集
在實驗期間,每天測定氨氮,亞硝酸氮和硝酸氮等水體指標,水質分析的水樣利用真空壓力通過0.45 μm GF/C濾紙過濾得到。
1.4 微生物樣品采集
在實驗溫度突變點(第5天)和突變后(第10天)喂食后,從3個平行組分別隨機選擇5只蝦。在解剖之前,用無菌水和75%乙醇洗滌蝦的體表,將腸分離并置于干冰上的1.5 mL離心管中,并在DNA提取前立即儲存在-80℃冰箱中。通過0.45 μm膜濾器收集生物絮團樣品,并立即儲存在-80℃冰箱中,然后進行分析,水體微生物樣品分別編號為Qa(突變前對照組)、Qb(突變前實驗組)、Ha(突變后對照組)和Hb(突變后實驗組)腸道樣本分別編號為a(突變前對照組)、b(突變前實驗組)、A(突變后對照組)和B(突變后實驗組)。
總基因組DNA從取得的微生物樣品中提取。通過使用特異性引物擴增16S rRNA基因的V4區:515F(5′-GTGCCAGCMGCCGCGGTAA-3′) 和 806R(5′-GGACTACH VGGGTWTCTAAT-3′)。 將 320~350 bp的PCR產物進行再循環以構建擴增子文庫,然后在Illumina Miseq平臺測序。
1.5 序列數據分析
根據Barcode序列和PCR擴增序列從得到的數據中進行分析,對樣品的reads進行拼接和過濾操作,得到高質量的Clean Tags。基于Clean Tags進行操作分類 單 元 (Operational Taxonomic Units,OTUs)聚 類[20]。由OTUs的聚類結果,對每個OTU的特征序列進行物種注釋,從而得到相應的物種注釋信息和豐度情況。同時,對OTUs進行豐度、Alpha多樣性分析等,用來獲取樣品的物種豐富度和均勻度信息、不同的樣品、分組之間的相同和獨有的OTUs信息等[21-22]。
1.6 水質測定方法與數據分析
氨氮,亞硝酸氮和硝酸氮的質量濃度由《養殖水環境化學實驗》中的方法測定[23]。實驗數據使用Graphpad Prism 8.0軟件進行作圖和分析,SPSS 19.0進行顯著性差異分析。
2 結果與分析
2.1 生物絮團系統養殖過程中的氮轉化
氨氮、亞硝酸氮和硝酸氮在溫度突變前后的轉化過程如圖所示。實驗第1天至第5天溫度為20.80±0.53℃,第6天至第10天溫度為30.02±0.71℃。溫度突變對水體中氮轉化通路無顯著影響。對照組與實驗組的氨氮濃度在溫度突變前后均維持在極低水平,突變前后氨氮水平無差異,亞硝酸氮濃度在實驗組和對照組突變前后無差異,在實驗組保持極低水平。實驗組的硝酸氮在溫度突變后有上升的趨勢,溫度突變實驗第5天(突變前)為19.65 mg/L到實驗第10天(突變后)升高到31.54 mg/L,實驗組的累計速率大于對照組。
2.2 水體菌群豐度和多樣性
利用16S rRNA基因V3+V4區域進行Illumina測序,在水體微生物中獲得了4219個OTU,腸道微生物中獲得了3698個OTU,突變前水體和腸道微生物中得到4431個OTU,其中從水體微生物中獲得2953個OTU,突變后水體和腸道微生物中得到4406個OTU,其中從水體微生物中獲得3273個OTU。實驗采用Ace指數、Chao1指數和Observed OTUs計算了基于OTU的菌群豐度指數信息,并采用Shannon指數和Simpson指數來評估菌群多樣性指數,實驗組的Ace指數、Chao1指數、Observed OTUs、Shannon指數和Simpson指數的豐度與多樣性均大于對照組,溫度突變前水體和腸道的Ace指數、Chao1指數、Observed OTUs、Shannon指數和Simpson指數的豐度與多樣性大于突變后。
2.3 溫度突變前后的水體菌群組成差異
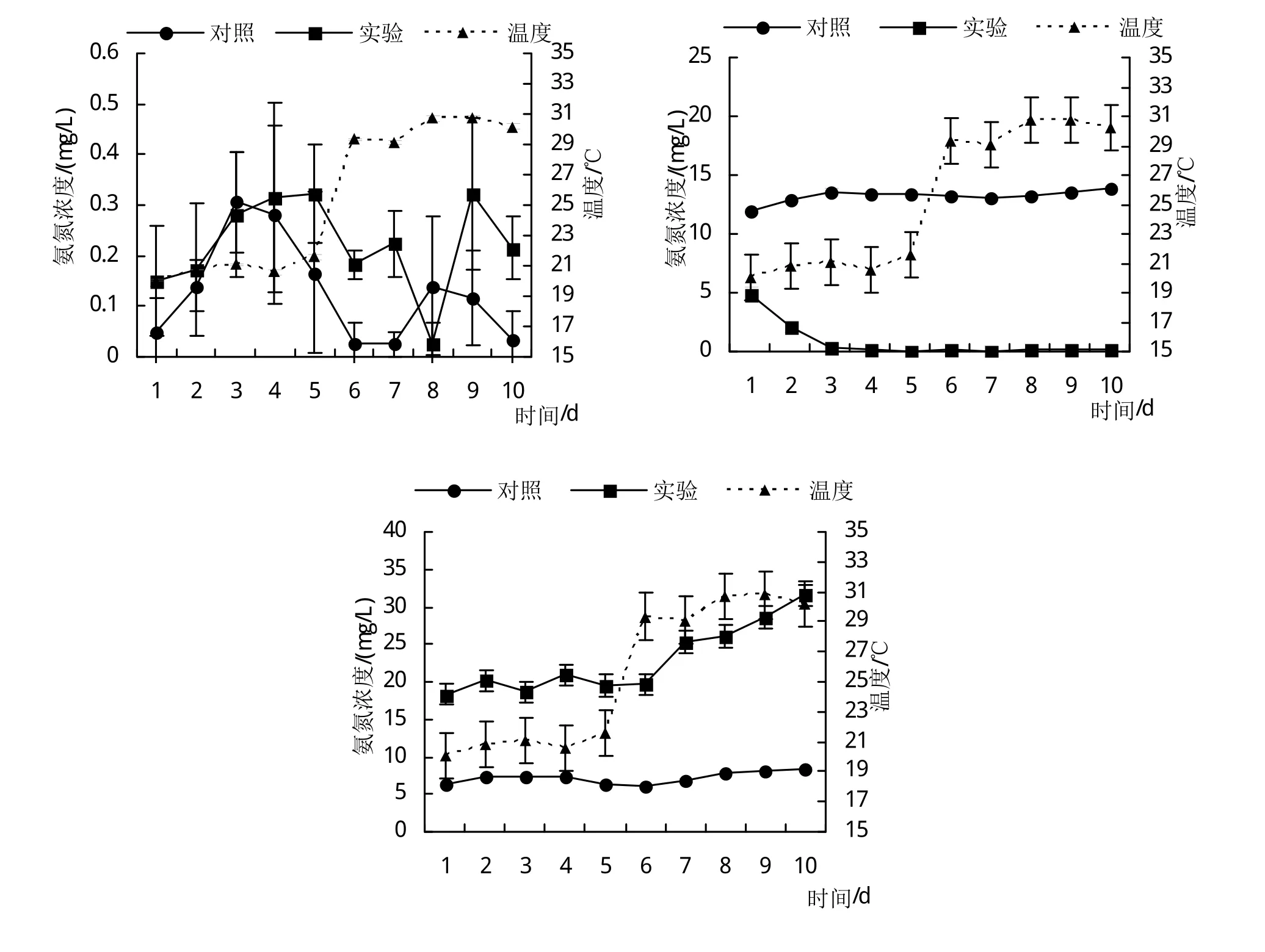
圖1 生物絮團系統中氨氮、亞硝酸氮和硝酸氮的變化

圖2 溫度突變前的水體(Ⅰ)和腸道(Ⅱ)菌群與突變后水體(Ⅲ)和腸道(Ⅳ)菌群韋恩圖
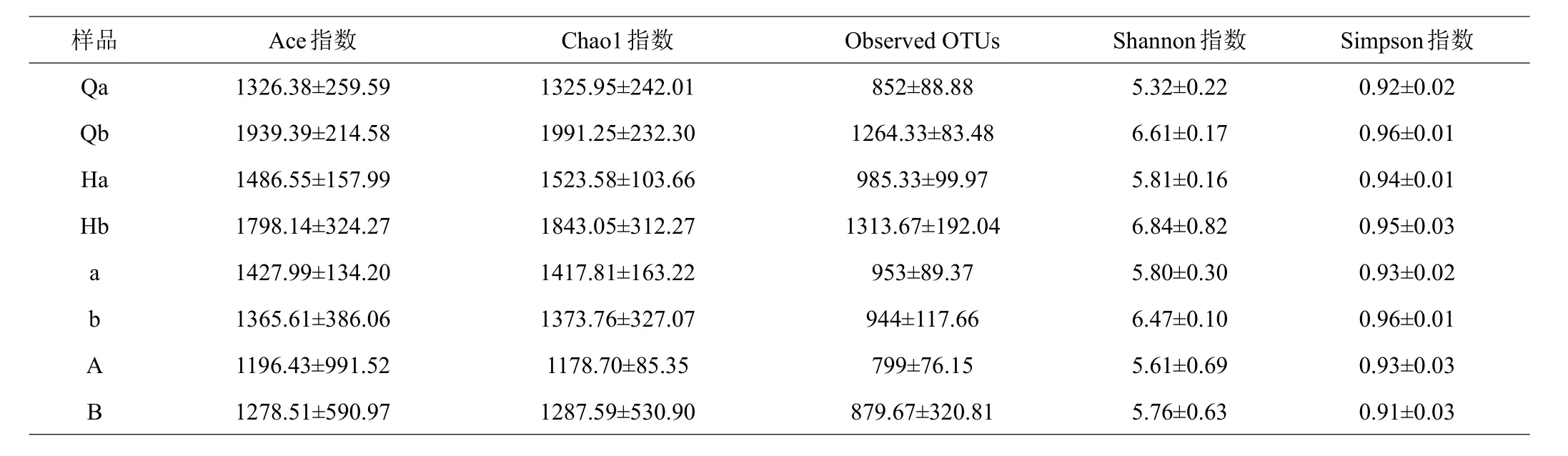
表1 溫度突變前后的腸道和水體菌群多樣性指數
共鑒定出相對豐度在1%以上的6個門11個屬,在門水平上,變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria)、綠彎菌門(Chloroflexi)、酸桿菌門(Acidobacteria)和TM7門是主要的細菌,在實驗周期中實驗組溫度突變前后水體微生物Qb與Hb的菌群結構無差異,對照組Qa的菌群結構中 Proteobacteria(57.36%)與Bacteroidetes(36.45%)分別增加或減少到Ha的Proteobacteria(79.66%)與Bacteroidetes(13.53%),腸道微生物對照組a的菌群結構中 Proteobacteria(84.42%)與 Bacteroidetes(5.66%)分別增加或減少到A的Proteobacteria(82.10%)與Bacteroidetes(15.20%),實驗組b的菌群結構中Proteobacteria(82.50%)與Bacteroidetes(10.02%)分別減少到B的Proteobacteria(78.17%)與Bacteroidetes(7.77%)。在屬水平上,極桿菌屬(Polaribacter)、小紅卵菌屬(Roseivivax)和海命菌屬(Marivita)在對照組的水體微生物Qa與Ha中顯著,在實驗組中豐度極低,三價鐵和硝酸鹽還原細菌(Ardenscatena)、冷蛇菌屬(Psychroserpens)在實驗組豐度高于對照組。實驗組與對照組的腸道微生物發光桿菌屬(Photobacterium)、Vibrio與Marivita在溫度突變后均有所減少,實驗組比對照組的豐度波動相對穩定。
2.4 溫度突變前后菌群種類和豐度差異及距離矩陣PCoA
根據加權和未加權UniFrac距離矩陣PCoA圖分析,可以得到同組的樣本之間圖中物種可以很好的聚在一起,不同組之間可以明確的區分開。實驗組Qb與Hb的距離比對照組Qa與Ha的距離近,實驗組b與B的距離比對照組a與A的距離近,通過LDA值分布柱狀圖的結果分析,得到了不同組間微生物分類相對豐富的差異。LEfSe的LDA值結果表明具有顯著差異的微生物群落在溫度突變前的水體菌群Qa與Qb中最多。根據LDA值分布柱狀圖的結果,突變前的水體菌群在多樣性更為豐富,實驗組比對照組細菌群落溫度突變前后變化差異小。
3 討論
3.1 溫度突變過程中的氮轉化
在溫度突變實驗前的30天,待水體理化因子變化穩定后,對照組水體菌群不能有效轉化水體中產生的的殘餌糞便,無機氮的濃度和總量逐漸增加累積[24-25]。實驗組水體中的氨氮、亞硝酸氮和硝酸氮的產生和去除速率均快于對照組,表明生物絮團能促進水體中的氮轉化進程[26]。在溫度突變實驗過程中,溫度突變對水體中氮轉化通路無顯著影響,實驗組的硝酸氮在溫度突變后有上升的趨勢。這與畢冬[27]、吳鵬等[28]的研究結果不盡相同,分析原因是溫度對水質影響的相關研究都是通過長周期的調控不同溫度來進行的,而在水體理化因子穩定后進行溫度突變實驗尚屬首次。本實驗的結果也證明在水質穩定的條件下,溫度突變并不會對生物絮團系統和半封閉養殖系統的水體氮轉化產生明顯的影響。
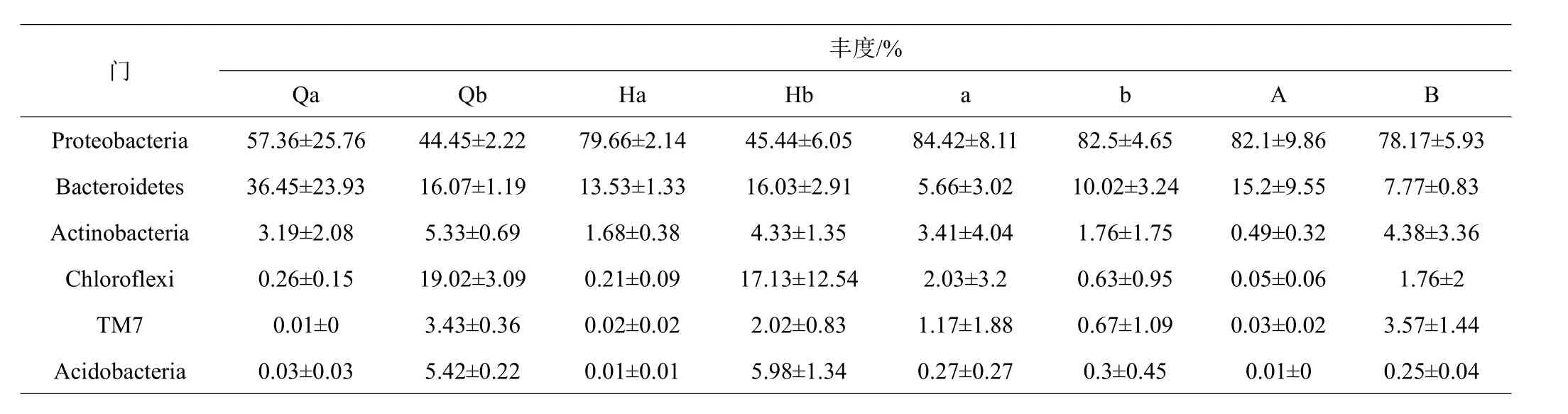
表2 在門水平的菌群相對豐度
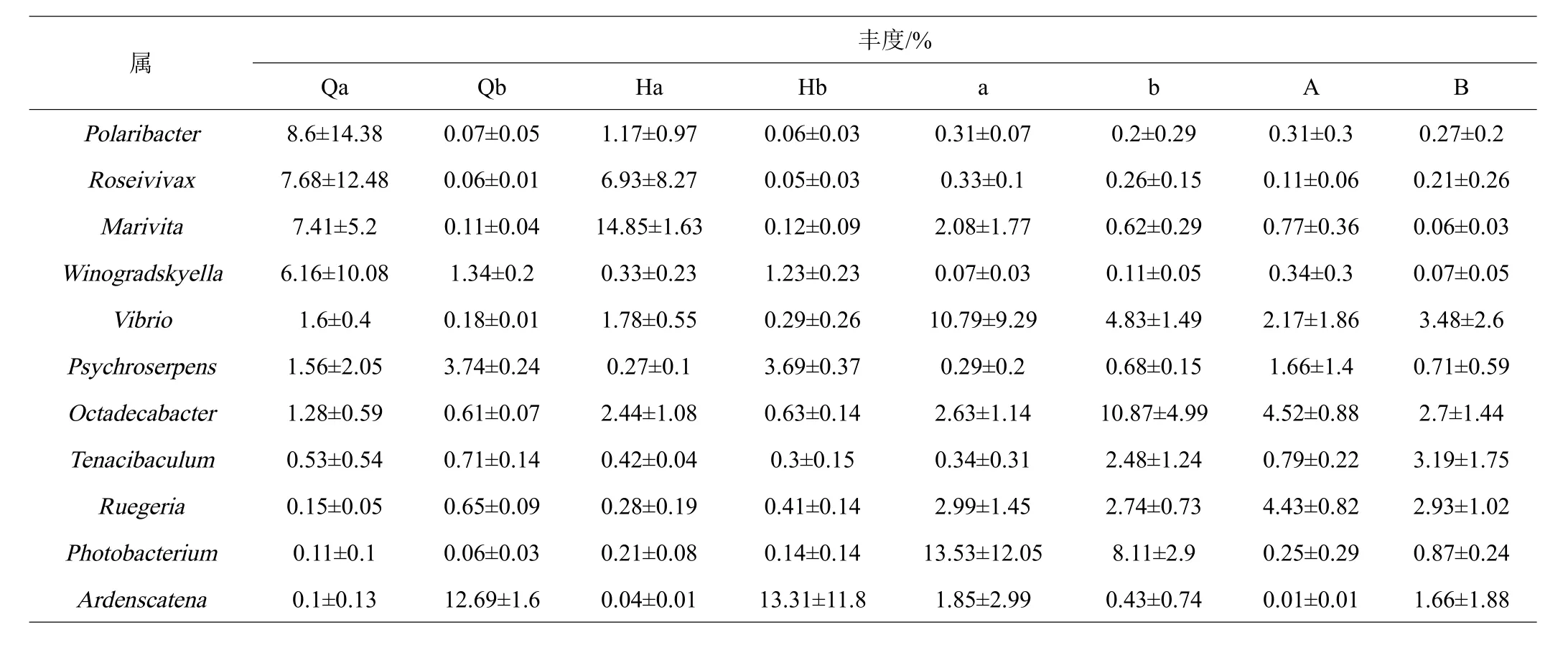
表3 在屬水平的菌群相對豐度
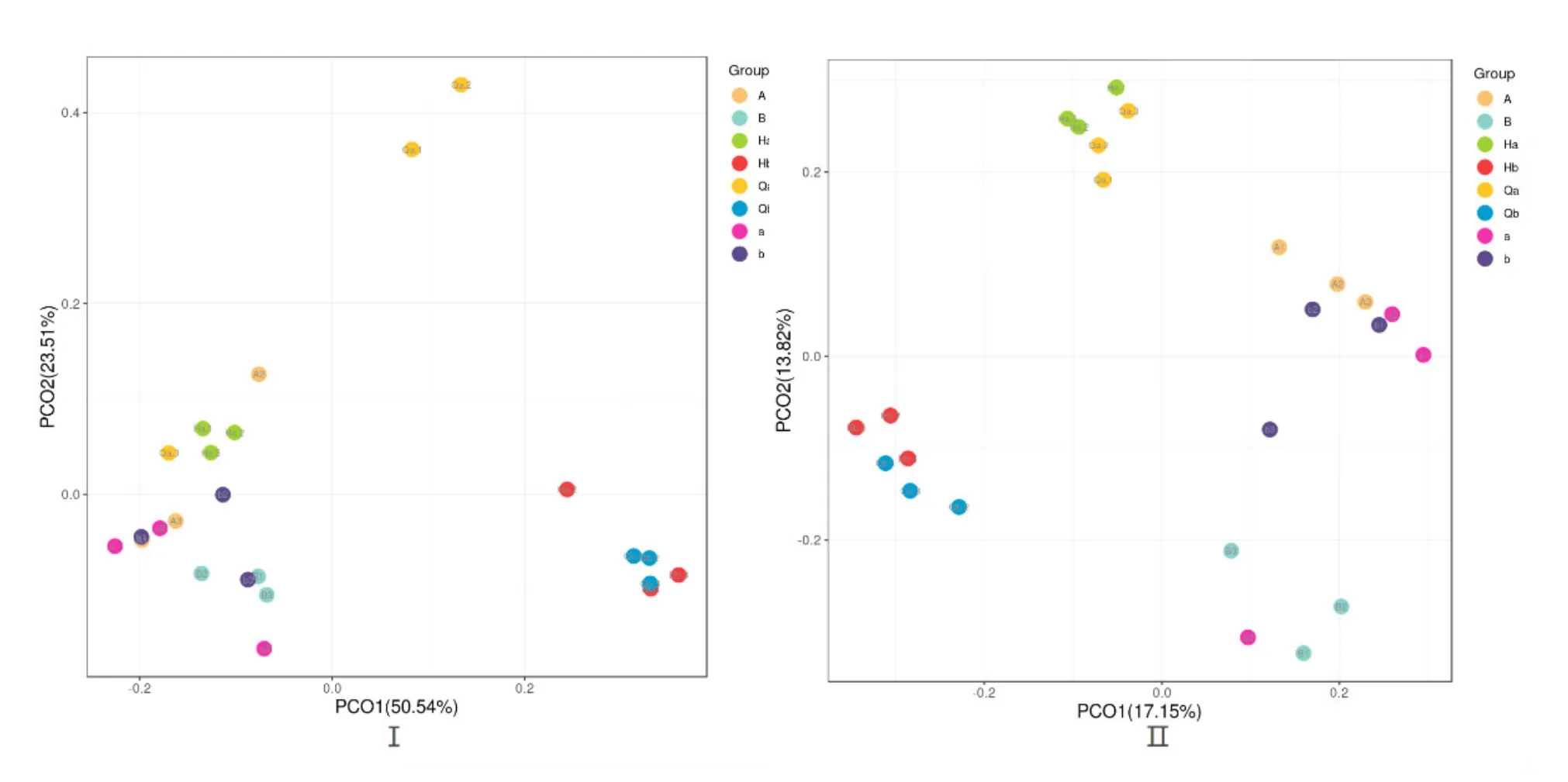
圖3 溫度突變前后菌群的加權(Ⅰ)與非加權(Ⅱ)UniFrac距離矩陣PCoA圖
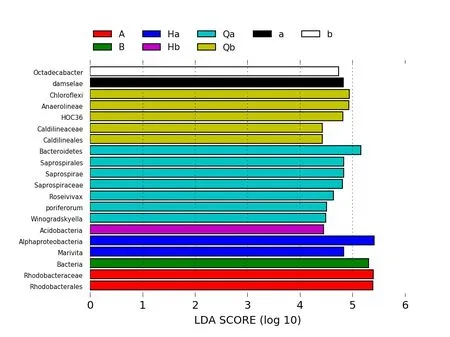
圖4 溫度突變前后菌群的LDA值分布柱狀圖
3.2 溫度突變過程中的微生物豐度和多樣性
本研究利用使用高通量測序分析生物絮團系統中的微生物多樣性變化情況。溫度突變前水體和腸道的豐度與多樣性大于突變后,LEfSe的LDA值計算結果顯示顯示具有顯著差異的細菌群落在溫度突變前的水體菌群Qa與Qb中最多。溫度突變對水體和腸道的微生物群落一定的影響,溫度突變后的水體和腸道的微生物群落在豐度與多樣性均低于突變前[29]。Alpha多樣性的結果表明實驗組的豐度與多樣性大于對照組,實驗組比對照組細菌群落溫度突變前后變化差異小,表明生物絮團的微生物豐度和多樣性具有更高的穩定性[28,30]。
3.3 溫度突變過程中的微生物菌群結構差異
在門水平上Proteobacteria和Bacteroidetes是主要的細菌,在所有水體和腸道樣本中中占很大比例,這與相關的研究結果相類似[31-33]。實驗組溫度突變前后水體微生物的菌群結構無差異,對照組菌群結構中Proteobacteria比例增加,Bacteroidetes減少。水體中大多數的Proteobacteria是養殖系統中的共生細菌[34],在生物絮團系統的尾水處理中,Proteobacteria用于去除水體中的有機物質[35-36]。Proteobacteria在生物絮團的微生物群落組成中有重要的作用[37-38]。因此,在利用生物絮團的養殖模式下,Proteobacteria可以有效地調節養殖水體的水質。Actinobacteria是一種較為常見的益生菌,在特定的環境下可以產生有益的物質[39]。Actinobacteria在實驗組的水體和腸道細菌群落中比例菌高于對照組,且在溫度突變中的波動小于對照組。在屬水平上,Photobacterium與Vibrio在實驗組水體和腸道微生物樣本中比例均低于對照組,且在溫度突變后實驗組與對照組中的含量均有所減少,表明生物絮團可以控制弧菌的數量[40-41]。結果表明生物絮團系統能夠抑制有害細菌的繁殖。對照組高氨氮的環境會破壞對蝦機體免疫系統,導致病原體增加,在腸道中的表現證實了這一結果[42]。
4 結論
經過長期培養后氮轉化通路穩定的生物絮團系統和半封閉養殖系統,溫度突變并不會對水體氮轉化產生明顯的影響。溫度突變對水體和腸道的微生物群落一定的影響,溫度突變后的水體和腸道的微生物群落在豐度與多樣性均低于突變前。生物絮團系統在應對溫度突變中的表現要優于半封閉養殖系統,在微生物群落的豐度與多樣性上均具有更高的穩定性。

