谷氨酸轉運體在帕金森病發病機制中作用的研究進展
馬利芳,梁建慶,2*,何建成,孫 雪,梁 鵬
(1.甘肅中醫藥大學 基礎醫學院,甘肅 蘭州 730000;2.甘肅中醫藥大學 敦煌醫學與轉化教育部重點實驗室,甘肅 蘭州 730000;3.上海中醫藥大學 基礎醫學院,上海 201203;4.蘭州大學 第二臨床醫學院,甘肅 蘭州 730000)
谷氨酸(glutamate,Glu)是參與細胞合成蛋白質和中間代謝過程的一種必需氨基酸,同時也是中樞神經系統(central nervous system,CNS)內的興奮性神經遞質,它所介導的神經傳遞在神經元發育、認知和突觸可塑性方面發揮作用[1]。Glu的興奮性毒性常被認為是帕金森病(Parkinson’s disease,PD)的主要發病機制,但其毒性如何產生的具體機制尚不清晰。對Glu的興奮性毒性研究發現,谷氨酸轉運體是影響興奮性毒性產生的關鍵性因子,因此,谷氨酸轉運體可能參與興奮性毒性過程進而參與PD的發病過程[2]。已知谷氨酸轉運體有兩種,分別是高親和力轉運體,又名興奮性氨基酸轉運體(excitatory amino acid transporters,EAATs)和低親和力轉運體,又名囊泡谷氨酸轉運體(vesicular glutamate transporters,VGLUTs)[3]。正常情況下Glu代謝循環是依靠這兩類轉運體在其中維持平衡的,Glu在細胞質被合成后,VGLUTs將其攝入并存儲在突觸囊泡(synaptic vesicles,SV)內,后經胞吐作用釋放于間隙中,此時一部分Glu會與突觸后膜上的N-甲基-D-天冬氨酸受體(N-methyl-D-aspartic acid receptor,NMDAR)或代謝型谷氨酸受體(metabotropic glutamate receptors,mGluRs)等結合發揮興奮性效應,一部分Glu由EAATs依附轉運至突觸前神經元和星形膠質細胞中。在星形膠質細胞中,谷氨酰胺合成酶(glutamine synthetase,GS)將Glu轉化為谷氨酰胺(glutamine,Gln),然后Gln釋放到突觸間隙,被突觸前神經元攝取重新合成Glu,形成Glu整個代謝循環(圖1)[3]。
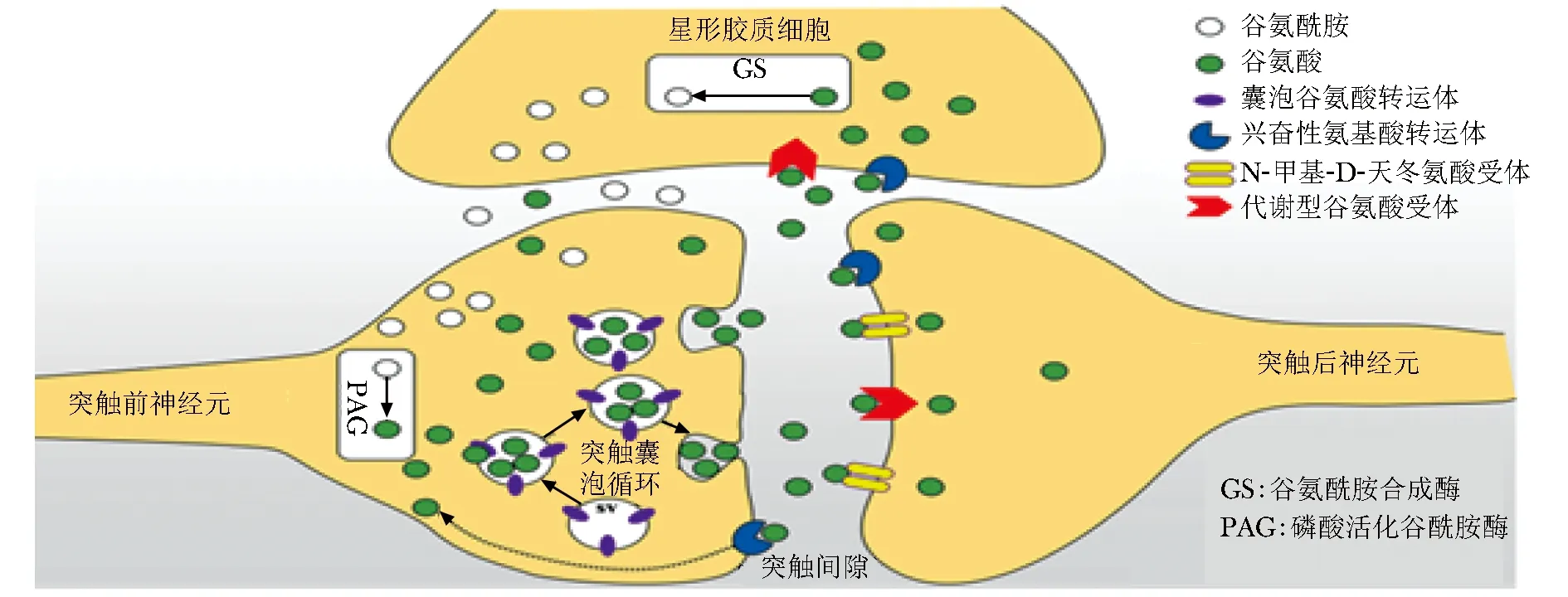
圖1 Glu代謝循環示意圖Fig 1 Schematic diagram of Glu metabolic cycle
在Glu代謝循環中,VGLUTs參與Glu的釋放,EAATs參與Glu的再攝取。無論VGLUTs或EAATs某一方表達功能出現失調,均能影響Glu神經傳遞強度,進而影響興奮性毒性的發生[4]。由此可知,調控兩類轉運蛋白可有效預防興奮性毒性的產生,從而減輕PD中DA能神經元的損傷。因此,本文將谷氨酸轉運體與PD的關系以及在PD發病進程中的作用研究進展進行總結,為揭示PD具體發病機制和防治藥物的研發提供一些依據。
1 高親和力谷氨酸轉運體(EAATs)與PD
PD是一種因興奮性氨基酸增多和抑制性氨基酸減少導致以運動行為障礙為主的神經退行性疾病,其中以Glu為主的遞質增多誘發的興奮性毒性常被認為是PD的主要發病機制,而Glu興奮性毒性的產生主要是由于EAATs在重攝取Glu的過程中發生異常。EAATs是位于神經元和神經膠質細胞胞膜上的轉運蛋白,目前有5種亞型,分別為EAAT1、EAAT2、EAAT3、EAAT4和EAAT5,在嚙齒動物中谷氨酸/天冬氨酸轉運蛋白(glutamateas-partate transporter,GLAST)對應EAAT1,谷氨酸轉運蛋白-1(glutamate transporter-1,GLT-1)對應EAAT2、興奮性氨基酸載體-1(excitatory amino acid carrier-1,EAAC1)對應EAAT3,各亞型蛋白作用在于負責Glu的重攝取[5]。現已證實,PD的患病特征上常顯示出EAATs功能失調,抑制EAATs表達會導致DA能神經元大量死亡,且運動行為障礙加重[6]。綜上,EAATs與PD的發生關系密切。下面將4個亞型蛋白各自在PD發病過程中發揮的作用進行總結。
GLAST是分子質量為66 ku的糖蛋白,含524個氨基酸、10個跨膜片段,主要在黑質致密部上表達[7]。在EAATs各亞型中,GLAST的清除能力雖不及GLT-1,但在短時間缺乏GLT-1的特定狀態下,GLAST可快速替補GLT-1的缺失,避免興奮性毒性的發生。僅此一點就可以認為補充GLAST可改善興奮性毒性損傷神經元過程。在MPTP誘導的PD模型鼠紋狀體內GLAST蛋白和mRNA表達均呈下降趨勢,且模型鼠出現運動協調障礙,這表明通過保護GLAST的表達和功能可以產生神經保護作用,在一定程度上可為治療PD提供實驗理論依據[8]。總之,GLAST在GLT-1功能受損時起代償作用,且GLAST的表達降低可能是PD的發病機制中的產物。
GLT-1是分子質量為73 ku的糖蛋白,含573個氨基酸、8~9個跨膜片段,主要在星形膠質細胞膜上表達,少數也存在于興奮性軸突終末[7]。GLT-1承擔90%胞外Glu的轉運,其表達和功能決定著Glu興奮性毒性是否發生。先前的研究表明,MPTP誘導的PD模型小鼠紋狀體內GLT-1蛋白以及GLT-1基因水平顯著降低[2]。并且在一項PD原發性震顫基因位點評估分析試驗中,GLT-1的基因(SLC1A2)變異體與中國東部漢族人群PD風險降低相關,這提示GLT-1與PD是否患病存在某些特定關聯[9]。此外,黑質致密部內GLT-1缺乏會引起PD小鼠進行性運動障礙和DA神經元死亡,后經GLT-1為靶標干預治療后,PD動物模型體內顯示出神經保護作用,表明靶向敲除黑質GLT-1可建立新型PD小鼠模型[10]。因此,調控GLT-1表達功能有助于了解PD的病情發展以及GLT-1具有作為PD治療靶標的潛力。
EAAC1是分子質量約為70 ku的糖蛋白,含524個氨基酸、10個跨膜片段,主要在CNS中成熟的神經元胞體和樹突上表達[7]。在成熟大腦中,EAAC1對Glu的清除能力并不顯著,但EAAC1丟失則會加重神經元對Glu興奮毒性的敏感性。此外,EAAC1不僅能調控胞外Glu濃度,還作為半胱氨酸轉運蛋白,參與半胱氨酸的攝取以及抗氧化劑谷胱甘肽的合成[11],且EAAC1缺陷小鼠體內谷胱甘肽水平降低、氧化劑水平升高以及對氧化應激的易感性增強、神經元損傷和認知障礙加重,提示EAAC1與PD氧化應激之間的關系較為密切[12]。線粒體功能障礙是PD的主要發病因素,近期體外實驗結果顯示靶向開啟EAAC1和Na+/Ca2+交換器(NCX)功能,可促進DA能神經元的Glu攝取以及改善線粒體功能障礙來限制PD的病理變化[13]。總之,EAAC1與PD中的氧化應激、線粒體功能障礙之間關系緊密。
EAAT4是分子質量為66 ku的糖蛋白,含548個氨基酸,在小腦的浦肯野細胞的樹突和樹突棘上表達。EAAT4和GLAST均位于浦肯野細胞興奮性突觸的四周,多數Glu依靠GLAST攝取,而GLAST攝取后剩余的Glu依靠EAAT4攝取。EAAT4彌補了GLAST在攝取能力的不足,這一點對于清除Glu同樣是至關重要的[14]。同時在PD小鼠中EAAT4水平也表現下降,針對性上調后明顯改善了DA神經元的凋亡數量以及運動行為障礙[15]。現階段EAAT4和PD的相關性研究較少,但EAAT4作為不典型谷氨酸轉運蛋白參與PD的部分仍不容忽視。
2 低親和力谷氨酸轉運體(VGLUTs)與PD
VGLUTs參與Glu能神經傳遞過程,而紋狀體內Glu能亢進是PD的發病特征,因此VGLUTs可能參與Glu能亢進過程影響PD的發生。VGLUTs是Glu能突觸前神經元囊泡質膜上的轉運蛋白,已知VGLUTs有3種亞型,分別為 VGLUT1、VGLUT2和VGLUT3,其作用在于調控Glu滲入突觸囊泡的數量,也就是說VGLUTs是決定進入間隙內Glu數量的關鍵分子,與Glu能突觸傳遞信號的強弱成正比,這便提示著VGLUTs可能參與PD的興奮性毒性作用機制[3]。并且近期有研究認為DA神經元中VGLUTs表達的動態變化可能與DA神經元的脆弱性有關[16]。因此,調控DA能神經元VGLUTs的表達可作為一種新型治療策略以提高DA能神經元在PD退行性疾病中的恢復能力[16]。
VGLUT1是分子質量為61.6 ku的蛋白,含560個氨基酸、6~12個跨膜片段,主要在Glu能突觸的末端上表達,比如大腦皮層、小腦皮質以及海馬等[3]。在VGLUTs中,VGLUT1負責胞外80%的Glu轉運和貯存,在Glu能系統中占主導地位,故而控制VGLUT1的活性可以潛在地調節興奮性Glu神經傳遞的效率以及改變突觸小泡的填充水平。PD是由于紋狀體中的Glu能神經傳遞受到干擾,引起皮質-紋狀體通路亢進引起的疾病。無論是6-OHDA誘導的PD動物模型還是臨床PD患者,皮質神經元末端的VGLUT1的表達和功能均表現增加。此外,以A2A腺苷受體為靶點是近年來改善PD行為障礙的有效途徑,它的作用靶點在于可上調VGLUT1水平來促進紋狀體神經元的皮質Glu能興奮性輸入和抑制紋狀體GABA能信號的升高,進而減輕PD癥狀[17]。因此在治療PD時,應考慮PD中Glu能傳遞過程中VGLUT1的表達變化,這可能是導致PD發生相關運動和認知障礙的關鍵原因。
VGLUT2是分子質量為64.4 ku的蛋白,含582個氨基酸、12個跨膜片段,主要在黑質、丘腦及丘腦下核等部位表達[3]。VGLUT2在丘腦核中比VGLUT1更為活躍,常看作是丘腦紋狀體Glu能輸入的選擇性標記,而丘腦紋狀體Glu能突觸輸入異常又與PD的運動缺陷有關,因此推測VGLUT2的失調與PD有關。在PD中,DA耗竭會導致VGLUT2在Glu能突觸末端密度增加,這一點再次驗證VGLUT2與DA能神經元損傷之間有關聯[18]。此外,中腦DA神經元的一個亞群也表達VGLUT2,VGLUT2基因缺失會加劇MPTP誘導的DA神經元損失以及運動障礙,同樣也會加大DA神經元對PD神經毒素的易感性[19-20],由此可見,DA能神經元中VGLUT2的表達和功能降低,可能會使某些特定個體增加DA能神經元變性的危險。因此,維持DA能神經元中VGLUT2的生理表達和功能可以增加DA神經元不受損傷的概率。
VGLUT3是分子質量為65 ku的蛋白,含589個氨基酸、10個跨膜片段,主要在非Glu能神經元中表達,比如GABA能神經元、膽堿能神經元等[3]。在6-OHDA損傷小鼠紋狀體內DA缺失會增加乙酰膽堿和VGLUT3的表達。紋狀體膽堿能神經元亢進是PD的重要特征,而紋狀體膽堿能神經元內VGLUT3高表達,因此深入研究VGLUT3介導的Glu神經傳遞與膽堿能傳遞之間的關系變得尤為重要。近期研究發現,VGLUT3的基因缺失可改善PD小鼠的運動癥狀以及減弱左旋多巴誘導的運動障礙[21]。這表明除了抑制紋狀體膽堿能傳遞外,抑制或阻斷VGLUT3表達代表了改善PD以及左旋多巴誘導的運動障礙的有效治療策略[22]。
3 問題與展望
谷氨酸轉運體參與Glu能神經傳遞且調控Glu興奮性毒性過程,間接影響著PD的發病,可以說谷氨酸轉運體是PD發病中的關鍵性因子。現以谷氨酸轉運體為作用靶點干預PD的實驗已顯示出谷氨酸轉運體具有治療PD的發展潛力,但僅停留在實驗階段,尚未在臨床上普及應用,并且谷氨酸轉運體除了作用于Glu興奮性毒性的靶點之外,是否影響著PD的其他致病因素有待闡明。今后可以谷氨酸轉運體為主線,將神經遞質轉運體和PD的發病機制聯系起來,為揭示PD的具體機制奠定基礎。

