水環境中人工合成納米銀顆粒的來源、轉化和生態毒性研究進展*
蒲高忠,王柯懿,陳霞霞,莫 凌,曾丹娟
(廣西壯族自治區中國科學院廣西植物研究所,廣西喀斯特植物保育與恢復生態學重點實驗室,廣西桂林 541006)
0 引言
隨著納米科技的飛速發展和納米產品的普及,納米材料將不可避免地向環境排放,對生態環境構成巨大的潛在威脅[1,2]。由于納米材料在水體中的遷移能力更強、影響范圍更廣、影響因素更復雜,因而對其環境行為的研究主要集中在水環境[3,4]。其中,納米銀(AgNPs)因其抗菌特性和對人體的低毒性而被廣泛應用于醫療、消費品和水處理等多個領域[3-5]。因此,AgNPs已成為目前世界上產量最大和應用最廣的納米材料。截止目前,AgNPs的全球產量每年可達600 t,并有持續上升的趨勢[5]。
AgNPs產品的廣泛使用增加了其向水環境釋放和人體暴露的機會。AgNPs本身及其釋放的銀離子(Ag+)均會對環境產生納米毒性,加之Ag+毒性強烈,因而將會對水環境造成更加復雜的毒理效應[1-3]。同時,由于水環境成分復雜,AgNPs進入水環境后,受各種環境因素(如pH、有機質和離子類型等)的影響,其在價態、種類和形態等方面均會發生較大的變化,導致其生態毒理效應進一步復雜化[6-9]。因此,系統闡述AgNPs在水環境中的來源、轉化和毒理效應,將對準確評估和管理AgNPs引起的環境生態風險起著至關重要的作用。
目前,對AgNPs研究進展的綜述主要集中在AgNPs制備、應用、轉化或生物毒理效應等方面,缺乏對其在水環境中的綜合分析。基于此,本文重點綜述水環境中AgNPs的來源與現實環境濃度、可能的遷移轉化規律和水生態毒理效應機制,提出當前研究中存在的不足,并指出今后需要進一步調查的領域,以期為含AgNPs材料的風險評估提供理論依據。
1 水環境中AgNPs來源和濃度
水生態環境中AgNPs的來源可分為兩部分,一部分為含AgNPs產品的排放產生,另一部分由自然環境中的Ag+轉化形成,其中含AgNPs產品的排放是水環境中AgNPs的主要來源(圖1)。據統計,有超過438種產品包含有AgNPs[10],這些產品主要來自紡織品、藥品和服裝等生物殺滅產品[11],以及油漆、木質外墻、納米洗衣機和塑料[12]。AgNPs主要通過AgNPs產品的生產、含AgNPs產品使用和處置過程等進入水環境[13]。通常,現實水環境中AgNPs的濃度往往明顯低于實驗室測試濃度(圖1)。 地表水中AgNPs的預測濃度為0.1-619 ng/L[13],而實際檢測到的地表水中AgNPs濃度為0.3-2.5 ng/L[14],廢水中AgNPs濃度小于12 ng/L[15]。實驗室所模擬AgNPs毒理濃度基本上為1 μg/L到30 mg/L[16-18],對納克每升水平的毒理效應知之甚少。同時,由于毒理學濃度是了解AgNPs歸宿和毒性的重要參數之一,其能影響銀納米粒子的穩定性和歸宿(如溶解、聚集和硫化等),且AgNPs可以在現實環境中長期存在[19],因此開展低濃度(< 1 000 ng/L)和長期暴露(數月至數年)下AgNPs毒理效應的研究,對準確評估AgNPs生態毒理效應具有重要意義。
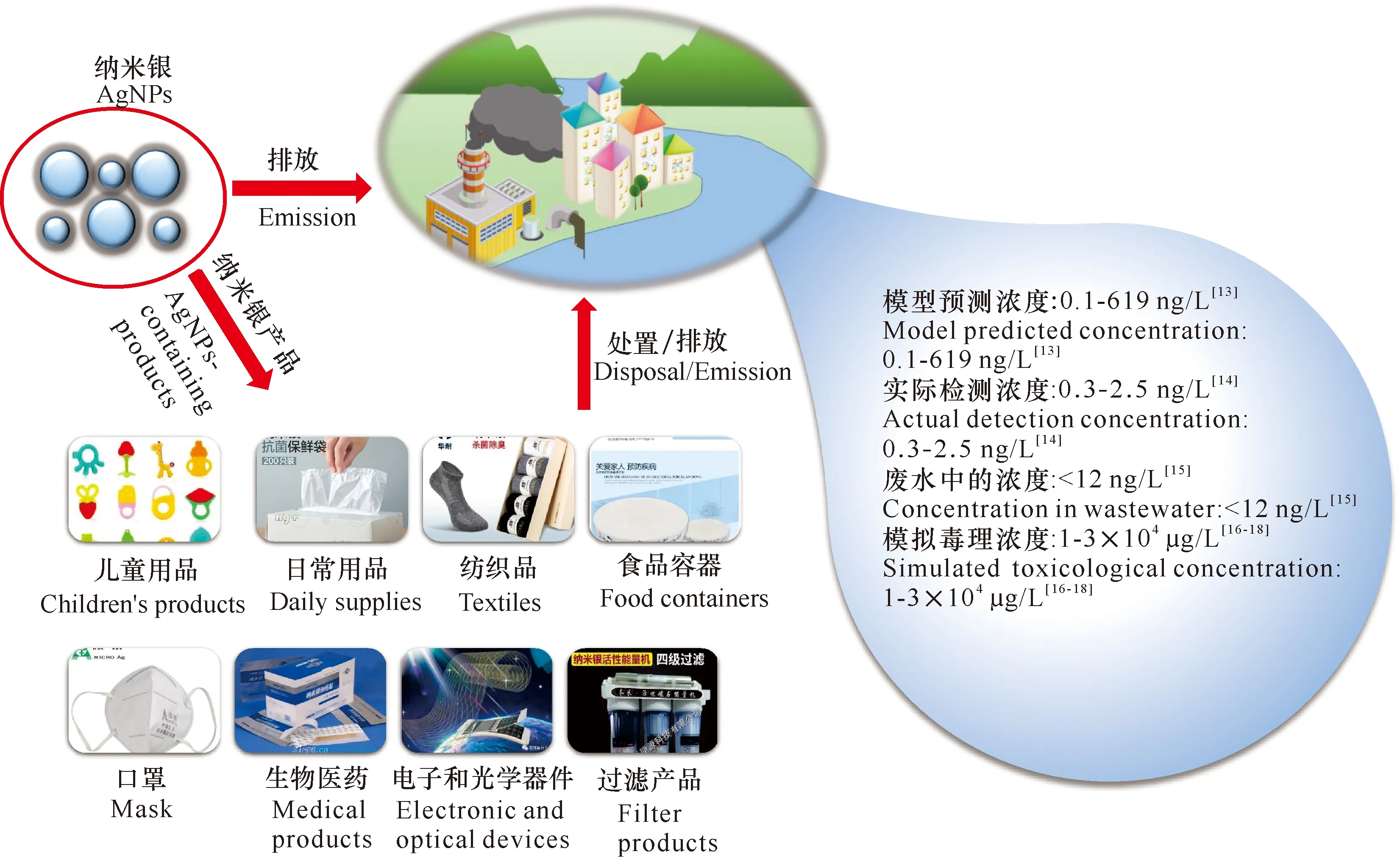
圖1 水環境中納米銀的來源和濃度Fig.1 Source and concentration of AgNPs in aquatic environment
2 水環境中影響AgNPs的因素和AgNPs的轉化機理
一旦進入水環境,AgNPs的歸宿及其對生態系統的毒性將會受到多種因素的影響(圖2a),包括環境(pH、有機質、離子強度、光照、溶解氧和溫度)、生物(生物降解和改性)因素以及AgNPs物理化學性質(濃度、大小、表面電荷、表面涂層和形狀等)[6-9]。
由于易受環境因素的影響,AgNPs會根據其所在環境或生物介質的不同,改變其溶解和聚集狀態,進而改變其生態毒性。在水環境中,AgNPs往往會發生如下幾類轉化行為:氧化溶解、團聚、氧化還原(硫化和氯化)、吸附(圖2b)等。其中,氧化溶解是AgNPs轉化的主要途徑,O2和 H+參與其中[9]。已有研究表明,水環境中pH、有機質、離子強度、光照、溶解氧和溫度等因素均可影響AgNPs的溶解行為[7,13,20-23 ],進而對AgNPs生態毒性產生不同影響[20]。鑒于AgNPs的不穩定性,實際生產應用中往往會根據不同需求對AgNPs進行包被修飾,如聚乙烯吡咯烷酮(PVP)、聚乙烯醇(PVA)和檸檬酸鈉等,這些修飾主要通過靜電作用力和空間位阻調控AgNPs的穩定性及顆粒溶解速率[20,24]。即使包被修飾提高了AgNPs的穩定性,但AgNPs表面的包埋劑常會因吸附解離或降解脫落,進而可能被環境中廣泛存在的腐殖質(HA)、黃腐酸(FA)、胞外聚合物(EPS)和蛋白質等天然有機質取代或者二次包埋[20]。例如,PVP、檸檬酸鹽包埋劑在太陽光和紫外光照射下易發生光解[25,26],因此水環境中大量天然有機質(NOM)更易吸附在AgNPs 表面形成二次包埋[27],進而可能會對AgNPs生態毒性產生不同的影響。AgNPs團聚(包括均質團聚和異質團聚)往往受很多因素的影響,如AgNPs粒徑、形貌、類型及水體pH值等[28]。例如,相對于大粒徑AgNPs,小粒徑AgNPs因其比表面積大,往往會更易團聚[28],而pH可通過降低AgNPs表面的ζ電勢而導致納米顆粒團聚[29]。團聚會改變由AgNPs釋放的Ag+濃度[20,30]及其與細胞表面接觸的有效位點,進而導致AgNPs生物毒性的減弱或增強。硫和氯作為水環境中存在的兩種主要元素,極易與溶液中Ag+發生硫化和氯化反應,分別生成難溶性硫化銀或氯化銀,進而限制可溶性銀的濃度,降低其在環境中的毒性和生物利用度[30-32]。AgNPs的硫化反應在好氧和厭氧條件下均可發生,其發生方式高度依賴于水體中S2-的濃度[33];而AgNPs氯化過程的發生主要依賴于Ag/Cl比,進而形成各種Ag化合物,包括固體AgCl和幾種可溶性AgClx(x-1)-化合物[32,34]。
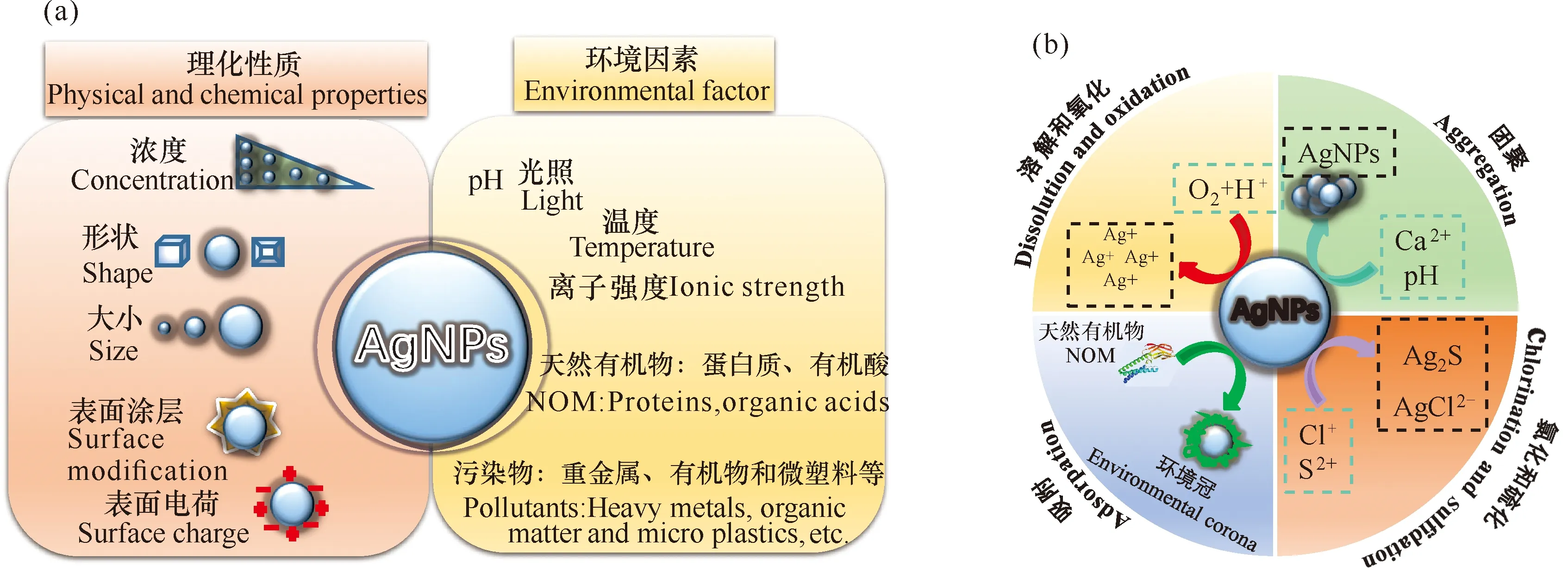
圖2 影響納米銀毒性的各種因素(a)及納米銀在水環境中轉化(b)Fig.2 Various factors affecting silver nanoparticles (a) and its transformation in aquatic environments (b)
除直接排放到環境中的AgNPs外,自然環境中的Ag+也可通過自然或生物轉化形成AgNPs。研究表明,自然光照射條件下,水體中Ag+可被天然有機質、活性氧[35]以及SO2[2]還原成AgNPs。此外,環境生物體(包括微生物、植物、病毒或DNA模板)也能夠將Ag+還原成AgNPs[21,36-38],如利用楓香內生真菌Phomopsisliquidambaris可合成平均粒徑為18.7 nm AgNPs;Gardea-Torresdey等[39]研究發現,紫花苜蓿(Medicagosativa)的根可以吸收Ag+,然后通過特殊渠道運輸至不同的部位合成AgNPs。
水環境是一個復雜而多變的環境,其中不僅存在大量天然有機物(如腐植酸、半胱氨酸和蛋白質等),還有可能存在各種化學污染物(有機污染物、重金屬和微塑料等)。由于其高比表面積和強吸附特性,AgNPs一旦進入水環境,將不可避免吸附這些物質并產生相互作用,形成“環境冠”,進而改變AgNPs的理化特征和生態毒理效應[7,40-42]。例如,Yang等[43]發現腐植酸和半胱氨酸通過不同的機制減少PVP-AgNP的沉積;天然有機物(NOM)的存在降低AgNPs的聚集率[42];一些抗生素(如四環素和慶大霉素)能夠改變AgNPs 的表面電性,促進AgNPs 與菌體結合,并會加速Ag+的釋放[44,45]。
3 AgNPs在水環境中的遷移和生態毒理效應
由于AgNPs體積小,在從原產品向環境的運輸和轉化過程中可能會產生多種毒性風險。一旦進入水環境,AgNPs將會與不同環境因素或生物因素相互作用,并通過直接(水體暴露)或間接作用(食物鏈傳遞)對水生生物產生一系列復雜的生態毒理效應(圖3)。由于AgNPs顆粒自身性質(如形態、粒徑和表面涂層類型等)以及含AgNPs產品材料類型的不同(如塑料用品、紡織產品和醫療用品等),其進入水環境必然會產生不同形式的遷移和轉化,進而改變AgNPs的毒性,最終導致水環境中AgNPs毒理效應和毒理機制的變化。AgNPs本身和其釋放的Ag+對水生動物[46-50]、植物[51,52]和微生物[20,53,54]均可產生納米毒性。另外,AgNPs與生物體之間可能發生相互作用,這可能會導致其通過食物鏈產生潛在毒性,進而通過被取食對人體產生毒害作用。研究表明,長期攝入銀會造成銀中毒,對人體皮膚、神經均有一定的損傷[55,56]。
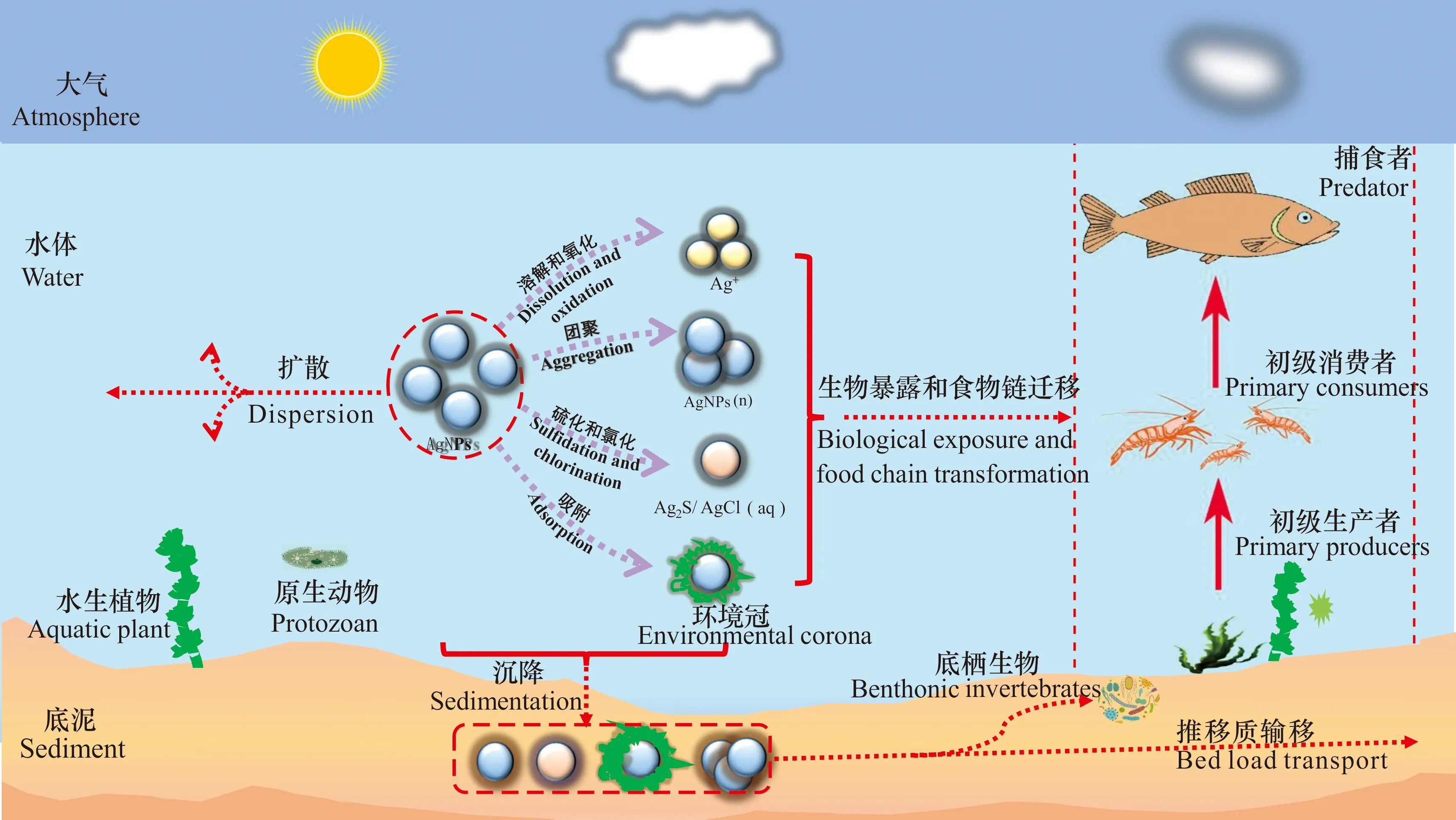
圖3 納米銀在水環境中的遷移和生態毒理效應Fig.3 Transport and ecotoxicological effect of AgNPs in aquatic environment
3.1 AgNPs對微生物及水生態學系統功能的影響
微生物作為水環境中物質和能量循環的主要參與者,對維持健康的水生態系統結構與功能具有重要意義。AgNPs的優良抑菌性無疑是一把雙刃劍。一方面,由于優良的抗菌性,AgNPs被廣泛應用于日常生活中:作為一種廣譜性的抗菌劑,AgNPs能有效抑制革蘭氏陰性菌和陽性菌的生長(雖然對其抗菌效能還存在爭議[57]);另外,除抑菌作用外,AgNPs還能刺激一些特殊菌的增殖,如硫酸鹽還原菌Desulfovibriovulgaris[58]。另一方面,AgNPs優良的殺菌作用是一個嚴重的問題,因為即使濃度很低,也有可能引起水生生態系統中微生物的擾動,從而對更高形式的生命產生連鎖效應。Huang等[59]發現,在人工濕地系統中,即使低濃度AgNPs (50,200 μg/L)的持續暴露,也會影響微生物群落結構和關鍵功能菌。在活性污泥處理系統中,1 mg/L AgNPs對反應器硝化抑制率達到41.4%,同時會顯著降低硝化細菌的豐度[60]。然而,Zhang等[61]發現0.1 mg/L AgNPs 長期處理對膜生物反應器的效能和細胞活性沒有顯著影響,而且硝化細菌的群落結構較為穩定。可見,不同濃度AgNPs在不同生態系統中對微生物群落結構的影響并不一致。
近年來,研究結果發現AgNPs對微生物群落和生態功能水平的毒理效應不僅受環境因素的影響,而且還受到環境因素對AgNPs釋放Ag+濃度的影響。Pradhan等[62]研究AgNPs對歐洲榿木(Alnusglutinosa)葉凋落物降解過程及其相關微生物群落結構和功能的影響,結果發現AgNPs與AgNO3中的Ag+對凋落物降解速率、水生真菌生物量和產孢率的影響無顯著差異,但與對照相比呈現出顯著的抑制效應。隨后,Batista等[63]研究發現溫度的升高促進了凋落物的微生物分解,提高了凋落物降解酶的活性,而低溫則增加了真菌的生物量和多樣性。最近,筆者課題組[18]首次解析了夜間人造光污染和AgNPs復合作用對河流生態系統中凋落物降解及其相關的微生物(真菌和細菌)群落結構、功能的生態毒理機制,認為人造光污染不僅可以改變溪流中AgNPs和凋落物的特性,而且還可以減輕AgNPs對凋落物降解的負面影響。這種減輕作用主要歸因于夜間人造光作用下AgNPs釋放的Ag+濃度和葉凋落物中木質素含量的下降、微生物量的增加及主要水解酶(β-葡萄糖苷酶)活性的增強。該研究不僅強調了評估AgNPs生態毒理效應時應考慮環境因素的重要性,而且為納米材料的生態安全評估提供科學依據和新視野。
有關AgNPs 對微生物的毒理機制研究表明,Ag+的釋放、活性氧(ROS)的產生、對細胞完整的破壞性與膜通透性改變及其與功能蛋白質互作是AgNPs損傷微生物的主要因素[20,56]。但也有研究發現,Ag2SNPs暴露5 d后對淡水生物膜的生物活性和群落組成有明顯影響,認為是其納米毒性而非離子毒性所致[64]。
3.2 AgNPs對水生植物毒理效應
AgNPs對水生植物毒理效應及機制研究主要集中在藻類[65-67]、浮萍[67-69]和水稻等[52,70],且主要集中在對單一物種在短期內的毒理效應方面,并聚焦于AgNPs對植物生長速率、光合作用和生理水平上的氧化脅迫等方面。例如,Oukarroum 等[71]發現AgNPs通過產生活性氧(ROS)降低Chlorellavulgaris和Dunaliellatertiolecta的生長速率、光合作用和細胞活力;Miao等[72]和He等[73]發現,AgNPs對Thalassiosiraweissflogii、Chattonellamarina的生長和生存的影響主要由AgNPs釋放的Ag+所造成。同時,AgNPs對浮游植物的毒理效應隨AgNPs來源、類型和試驗對象(如月牙藻、小球藻和衣藻)的不同而不同[56]。對一些大型水生植物的研究表明,AgNPs暴露可誘導產生過量的ROS,從而引起多不飽和脂肪酸過氧化(稱為脂質過氧化)、細胞膜通透性損傷、細胞結構改變或蛋白質、DNA直接損傷,進而導致植物細胞死亡和生長抑制[74,75]。例如,Yuan等[74]發現,AgNPs暴露后,沉水植物埃格草(Egeriadensa)的膜損傷指數MDA明顯高于出苗的燈心草(JuncuseffususL.),說明AgNPs對沉水植物的脅迫作用更大。Jiang等[66]研究發現,在水環境中,AgNPs主要沉積在表層底泥中,并且在水生植物大量積累銀元素,因此AgNPs可能會通過食物鏈在不同營養級上傳遞。
3.3 AgNPs對水生動物毒理效應
對AgNPs水生動物毒理效應的研究主要集中在水生無脊椎動物(如線蟲、大型溞和貝類等)和魚類中。作為水生食物鏈的主要參與者,無脊椎動物在物質循環、能量轉化以及污染物遷移積累方面均扮演著重要角色。研究發現,AgNPs會對無脊椎動物產生很強的毒性作用,并且AgNPs及其釋放的Ag+對生物的毒理效應與水體pH、離子成分及強度、溶液中大分子物質(如共存污染物和硫元素等)等因素聯系密切[3,4]。一旦進入這些無脊椎動物體內,AgNPs可隨血液循環進入不同組織中,且主要分布在腮、肝胰和腸道上[51]。Yan等[75]發現,AgNPs還可以通過大型蚤(Daphniamagna)母體內轉移到下一代,且顯著抑制F0代和F1代的繁殖能力。
另外,AgNPs對脊椎動物魚類的毒理作用研究顯示,AgNPs對魚類(研究的主要模型為耐寒的淡水魚斑馬魚和咸水魚日本青鳉)的毒性作用主要表現為影響魚類的胚胎發育(導致如眼、尾和心臟的畸形等),破壞鰓的組織結構,產生呼吸和神經毒性等[3,46,48]。AgNPs對魚類會表現出比Ag+更強的生物毒性效應[76],AgNPs對斑馬魚的毒性呈現粒徑效應[48]。此外,由于Ag+可以替代Na+/K+ATPase中的Na+,而AgNPs表面涂層材料會影響Ag+的釋放量,因此其會影響日本青鳉體內的生理平衡[77]。AgNPs對日本青鳉具有一定的亞慢性毒性[78],在日本青鳉體內的組織分布為肝>鰓>腸>腦,毒性主要作用于肝臟、鰓和腸道,其中肝臟損傷最為顯著,即肝臟是AgNPs毒性作用的靶器官[46]。另外發現,0.1 mg/L AgNPs溶液會降低魚類對低氧環境的耐受力,表明氧化損傷可能是AgNPs對魚類產生毒性的一個重要機制[48]。可見,AgNPs可通過水體直接暴露和食物鏈轉移產生毒理效應,甚至還會通過母體轉移對下一代產生毒理效應。
3.4 AgNPs在水生食物鏈的遷移和轉化
截至目前,對AgNPs在食物鏈遷移轉化規律的研究主要集中在少數幾個模式生物之間。例如,對不同包被(巰基、沒食子酸和酪氨酸等)AgNPs沿藻類(Chlamydomonasreinhardtii)→大型溞(Daphniamagna)和沿小球藻(Chlorellavulgaris)→大型溞食物鏈傳遞效應的研究結果表明,AgNPs中的Ag+可沿食物鏈傳遞,且Ag+主要通過食物攝取傳遞[47,79]。Jiang等[66]報道AgNPs從水柱和沉積物向動植物的營養轉移,Chae等[80]報道了納米銀線(AgNWs)從藻類向水蚤和斑馬魚的營養轉移。在河口環境中,由含有AgNPs的消費品中釋放的Ag+被各種生物群(生物膜、無脊椎動物、植物)吸收,通過吸附、遷移和生物積累等過程產生不同的生態毒理效應[81]。可見,在水環境中,AgNPs可沿捕食食物鏈向上傳遞,但由于捕食者與被捕食者的消化生理差異,日益增加的物種復雜性可能改變AgNPs暴露生物敏感性,并可能改變AgNPs誘導的毒性[10]。
4 展望
AgNPs優良的抗菌特性雖然給人類生產生活帶來了諸多便利,但其日益增強的環境釋放也給生態環境帶來潛在生態風險。由于水環境的復雜性,AgNPs一旦進入其中,其理化特征、環境行為及毒理效應將會受到多種因素的影響。迄今為止,雖然已有大量研究報道水環境中AgNPs的來源、遷移轉化和生態毒理效應等,但這些研究存在以下5點問題:(1)報道主要是對總Ag(包括Ag+、AgNPs和AgNPs-Ag+復合物)的評估,而不是環境毒理研究中常用的生物體攝取的各種不同類型的AgNPs[82];(2)對AgNPs生物毒性測定缺乏標準方法以及有效研究技術手段[40,83];(3)AgNPs對單一物種毒理效應和機制的研究主要集中在物種本身的生理變化方面,而較少從分子水平探討其致毒機制[65];(4)報道多數只涉及單一環境因素對AgNPs在水生態遷移轉化和生態毒理效應的研究,而對不同環境因素互作條件下的毒理效應機制知之甚少;(5)對AgNPs在食物鏈中的研究主要集中于二級食物鏈或模式生物上面,不能完全反映真實復雜的生物系統[83]。因此,未來對AgNPs在水環境中的遷移轉化、生物積累及生態毒理機制等研究可從以下5方面入手:
(1)在實際暴露場景和劑量條件下,對環境實際濃度AgNPs在不同實驗尺度(微觀和中觀)和時間(長期和短期)中的水生態遷移轉化和生態毒理效應進行研究;
(2)開發新的AgNPs在復雜環境介質中的表征和量化方法,并提供標準的或可參考的環境管理體系以及安全性實驗方案,建立一個全面、規范的評價體系,這對環境中AgNPs的毒性進行有效評價至關重要;
(3)對AgNPs生態毒理效應進行多組學(包括高通量篩選、預測毒理學和基因組學/表觀遺傳學/代謝組學等)研究,并從分子水平進行探討AgNPs致毒機制,以將AgNPs研究從描述性科學轉向基于機制的毒理學;
(4)開展多因素(包括非生物和生物因素)條件下AgNPs在水環境遷移轉化和生態毒理效應研究,深入探究AgNPs-污染物之間的相互作用,以及環境條件如何使這種相互作用復雜化,最終將這些研究應用于實際生態環境,以評估其在自然環境條件下的總體毒性;
(5)建立完整的實驗條件,加強AgNPs在三級食物鏈尤其是在水環境中常見的食物鏈中遷移轉化規律的研究,進而深入探究原位而非實驗室模擬條件下AgNPs在食物鏈中的傳遞規律及其機制。
在上述研究的基礎上,開發由化學、物理、生物學、數學、統計學和信息學等跨學科科學領域組成的AgNPs毒性數據庫,建立AgNPs生物風險評估體系及環境標準,使其在排放前預處理,從而從根源上降低生態風險。

