ADC圖腫瘤全域紋理分析鑒別腫塊型乳腺導管原位癌/伴微浸潤
鞠 燁 田士峰 張 楠 孫 博 劉鐵利 劉愛蓮 張麗娜
乳腺導管原位癌(ductal carcinoma in situ,DCIS)被認為是乳腺浸潤性導管癌(invasive ductal carcinoma,IDC)的前驅病變。DCIS約占中國新發乳腺癌的10%~15%[1]。美國抗癌聯合會(American Joint Committee on Cancer,AJCC)將浸潤范圍≤1 mm的DCIS定義為DCIS伴微浸潤(DCIS?MI),認為DCIS?MI是DCIS發展到浸潤性乳腺癌的中間階段,具有侵襲和轉移潛能[2]。目前的研究認為,大多數DCIS患者不會復發,而DCIS?MI則趨向于較差的生存預后,在DCIS患者中可能存在被過度治療或治療不足的問題。因此,如何真正將高風險的DCIS與低風險的DCIS區分開仍是乳腺腫瘤學界研究的熱點和難點[3]。
DCIS的影像研究既往主要集中在DCIS分級及與浸潤性癌的影像學分類研究方面,多采用動態增強磁共振成像(dynamic contrast?enhanced magnetic resonance imaging,DCE MRI)和彌散加權成像(diffusion weighted imaging,DWI)手段,并已取得初步成果[4-5]。DCIS的DCE MRI表現多樣,以非腫塊強化多見,但DWI因受空間分辨率、感興趣區(region of interest,ROI)勾畫等因素影響,其在非腫塊強化病灶中的診斷價值尚待挖掘[4-5]。機器學習和深度學習方法結合了定性和定量的MRI特征,近年來已在浸潤性乳腺癌治療前后的評估方面獲得了令人鼓舞的結果[6],但尚未見利用紋理分析對腫塊型強化的DCIS和DCIS?MI進行腫瘤全域的DWI影像特征研究的報道。本研究擬利用表觀彌散系數(apparent diffusion coefficient,ADC)圖腫瘤全域紋理分析,無創鑒別腫塊型DCIS和DCIS?MI這兩種早期乳腺癌分型,為臨床診療給予影像學支持,以期提高治療效果并準確預估風險。
方 法
1.臨床資料
回顧性收集2016年10月至2019年10月在大連醫科大學附屬第一醫院住院并經手術病理檢查明確為乳腺DCIS或DCIS?MI的女性患者,術前均完成MRI常規及DWI檢查。納入標準:①均行腫塊切除術,并經病理檢查證實為DCIS或DCIS?MI;②患者均有詳細且完整的臨床病歷資料;③DCE MRI顯示為單發腫塊強化;④DWI圖像滿足ADC值測量需要。最終有48例納入研究(20例設為DCIS組,28例設為DCIS?MI組),腫瘤位于左側者22例(DCIS組8例,DCIS?MI組14例),右側者26例(DCIS組12例,DCIS?MI組14例),年齡31~77歲,平均(44.8±13.1)歲。
2.MRI檢查方法
采用GE Signa Excite HDxt 3.0 T全身磁共振掃描儀,8通道乳腺專用線圈,患者取俯臥位,乳房自然下垂,懸于線圈內。每個研究對象先行常規平掃序列,于DCE掃描前行DWI序列。
平掃序列:①軸位頻率預飽和反轉恢復(STIR)序列,重復時間(TR)4 450 ms,回波時間(TE)68 ms,層厚5 mm,層間距1 mm,視野(FOV)32 cm×32 cm,矩陣288×224,序列掃描時間為293 s;②矢狀位T2快速自旋回波(FSE)抑制脂肪(FatSat)序列,TR 2 140 ms,TE 85 ms,層厚5 mm,層間距1 mm,FOV 20 cm×20 cm,矩陣288×224,序列掃描總時間56 s。DCE掃描:采用軸位三維T1加權成像(T1WI)FSPGR序列(即volume imaging for breast assessment,VIBRANT),TR 3.9 ms,TE 2.1 ms,翻轉角、層厚、層間距分別為13°、4.4 mm、3 mm,矩陣256×170,FOV為32 cm×32 cm。DCE掃描時,經肘正中靜脈團注對比劑釓噴酸葡胺,注射劑量為0.2 mmol/kg,速率為2.5 mL/s。注射對比劑后25 s開始第1期DCE圖像采集,連續進行30期,采集時間為18 s/期。DWI序列:軸位單次激發自旋平面回波序列,TR 5 625 ms,TE取最小值,層厚5 mm,層間距1 mm,FOV 32 cm×32 cm,矩陣128×128,序列掃描時間為225 s。b值=1 000 s/mm2,激勵次數(NEX)為2。
3.圖像分析與數據采集
由2名分別具有5年和10年乳腺診斷經驗的醫師共同閱片,意見有分歧時經討論達成共識。第一步,測量DCE上病灶最大徑,使用Functool功能軟件(AW 4.6后處理工作站)獲取病灶ADC圖;第二步,將ADC圖像導入Omni?Kinetics軟件,沿腫瘤邊緣逐層勾畫感興趣區(ROI),需同時在AW 4.6工作站上參照DCE及DWI圖像觀察病變,以保證準確勾畫腫瘤邊界;第三步,描繪完成后軟件系統自動融合所有層面的圖像,獲得中位數、平均值、標準差、偏度、峰度、均勻性、能量、熵、慣性矩、相關性和逆差距等參數。
4.統計學分析
結 果
48例腫塊強化病灶最大徑1.1~3.5 cm,平均(2.40±0.67)cm。強化病灶最大徑和年齡在DCIS組與DCIS?MI組間的差異均無統計學意義(表1)。DCIS和DCIS?MI典型病例病灶影像如圖1和圖2所示。
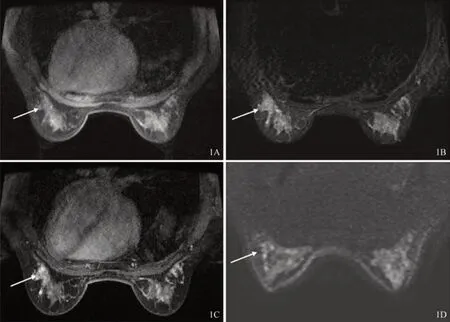
圖1 左側DCIS病例(女性,52歲)影像
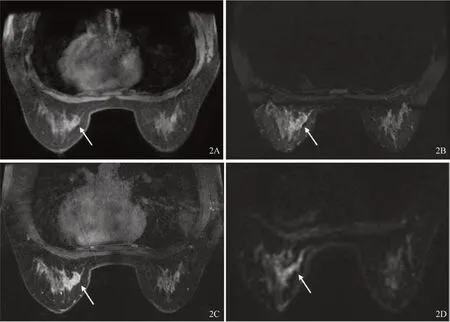
圖2 左側DCIS-MI病例(女性,44歲)影像
表1 DCIS組與DCIS?MI組基線資料比較
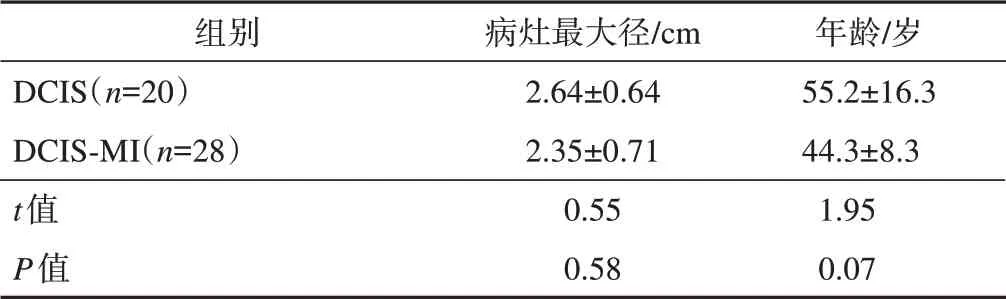
表1 DCIS組與DCIS?MI組基線資料比較
組別DCIS(n=20)DCIS?MI(n=28)t值P值病灶最大徑/cm 2.64±0.64 2.35±0.71 0.55 0.58年齡/歲55.2±16.3 44.3±8.3 1.95 0.07
中位數、平均值、偏度、峰度、均勻性、慣性矩、相關性和逆差距符合正態分布,標準差、能量、熵為偏態分布,檢驗結果詳見表2。DCIS組的標準差、熵、相關性、逆差距小于DCIS?MI組,均勻性、能量、慣性矩大于DCIS?MI組,差異均有統計學意義(P<0.05);2組之間的中位數、平均值、偏度、峰度差異均無統計學意義(P>0.05)。
表2 各參數在DCIS組與DCIS?MI組間的比較±s,M(P25,P75)
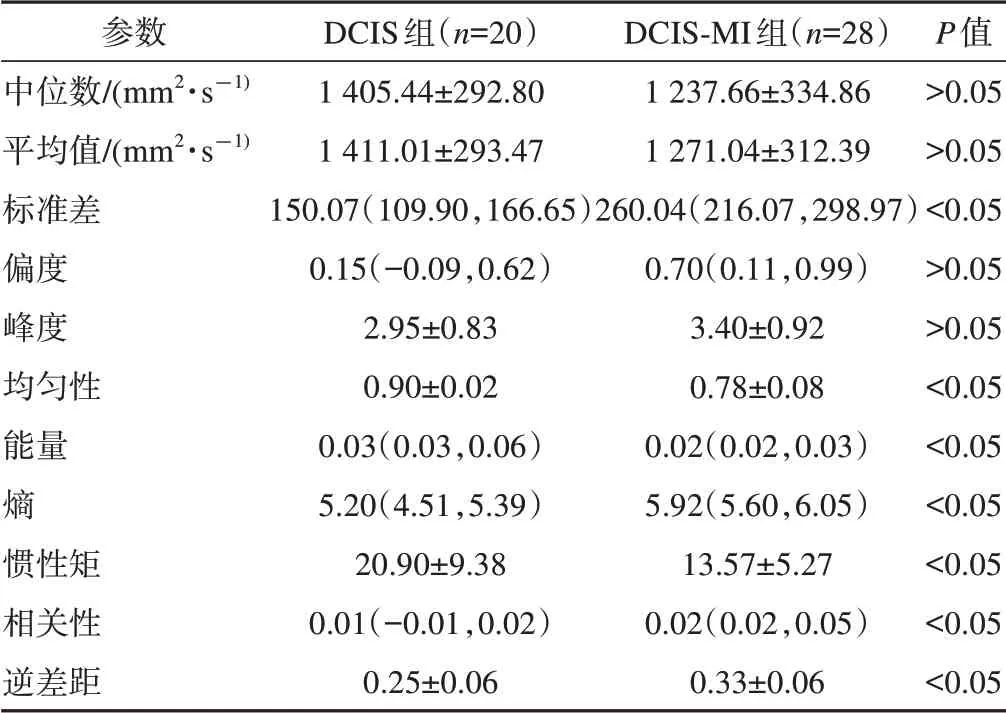
表2 各參數在DCIS組與DCIS?MI組間的比較±s,M(P25,P75)
參數中位數/(mm2·s-1)平均值/(mm2·s-1)標準差偏度峰度均勻性能量熵慣性矩相關性逆差距DCIS組(n=20)1 405.44±292.80 1 411.01±293.47 150.07(109.90,166.65)0.15(-0.09,0.62)2.95±0.83 0.90±0.02 0.03(0.03,0.06)5.20(4.51,5.39)20.90±9.38 0.01(-0.01,0.02)0.25±0.06 DCIS?MI組(n=28)1 237.66±334.86 1 271.04±312.39 260.04(216.07,298.97)0.70(0.11,0.99)3.40±0.92 0.78±0.08 0.02(0.02,0.03)5.92(5.60,6.05)13.57±5.27 0.02(0.02,0.05)0.33±0.06 P值>0.05>0.05<0.05>0.05>0.05<0.05<0.05<0.05<0.05<0.05<0.05
圖3為各參數(標準差、均勻性、能量、熵、慣性矩、相關性、逆差距)鑒別2組病灶的ROC曲線,其曲線下面積(AUC)分別為0.99、0.99、0.86、0.94、0.74、0.74、0.84,其中標準差、均勻性、能量、熵值具有較高的診斷效能。
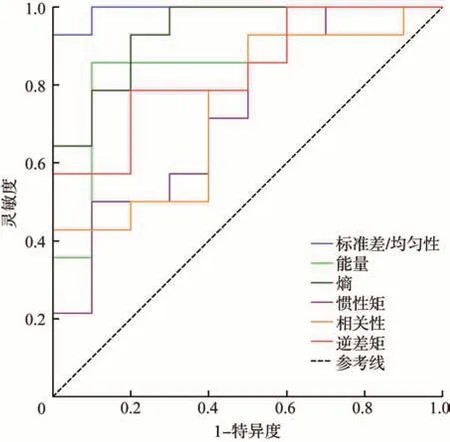
圖3 各參數ROC曲線
討 論
目前的研究表明,DCIS?MI患者的腫瘤特異性生存率、無病生存率和總生存率均較DCIS患者差,死亡率也高于DCIS患者[1-2]。DCIS?MI與DCIS的術前影像鑒別診斷有助于預測患者的預后,并為臨床治療提供幫助與指導。如果能夠早期發現上述病變,及時進行干預,可以有效減緩其進展,對改善患者愈后具有重要價值。在磁共振動態增強圖像中,大部分典型的非腫塊型DCIS?MI主要呈節段分布、不均勻或簇環狀強化,少數腫塊型DCIS?MI表現為邊緣呈毛剌狀或不規則,內部強化特點為不均勻或邊緣強化,非腫塊樣純DCIS趨向于線樣分布,內部強化特點一般較均勻,腫塊型DCIS往往邊緣清晰,內部強化特點均勻或不均勻,但往往腫塊型強化的DCIS?MI與DCIS不易鑒別[4-5]。DWI作為不使用對比劑、無創的磁共振功能成像技術之一,利用活體組織中本身存在著水分子彌散運動的原理,將定性與定量分析結合起來快速成像,可發現早期的細胞水平變化,相較于形態學變化更為敏感,同時也能及早發現微循環灌注的變化。ADC值主要反映水分子在細胞內、細胞間隙及血管內的彌散情況,與惡性細胞的核質比和密度情況相關,隨著后者的變化而變化,也能反映組織在微環境的結構情況及組織類型的情況,因此可以通過ADC值來反映腫瘤異質性程度[7]。
張勇等[6]將ADC值紋理分析初步應用于乳腺原位癌與浸潤性乳腺癌鑒別診斷中,發現DWI圖像的直方圖參數(最大強度值)在乳腺原位癌與浸潤性乳腺癌及不同分級的浸潤性乳腺癌有所差異,因此認為其可以用于疾病的診斷,并且對預后具有預測價值。這項研究選取的是腫瘤最大層面進行處理測量,并未測量全腫瘤ADC值,這與以往研究存在共同的局限性,即在腫瘤一層或幾層圖像上選取ROI并計算平均值,但是涉及范圍較窄,僅以一層或者是幾層的結果為依據,并不能反映全腫瘤的實際情況。由于選取的范圍較窄,計算的ADC值也較為局限,只是反映腫瘤局部的簡單平均值,獲得的一致性結果與實際情況會存在差異,因此會出現低估問題[8-9]。本研究使用全腫瘤ADC值的測量方法,避免了僅在局部區域進行ROI勾畫所導致的測量誤差,獲得的一致性結果可以更全面反映腫瘤的整體狀況。該測量方法已經在神經、腹部及子宮腫瘤等的研究中推廣[8-11],但在乳腺腫瘤中的應用報道較少。在本研究中,我們通過對腫塊型DCIS和DCIS?MI的全腫瘤ADC值的紋理分析,獲得的評價結果為腫塊型DCIS與DCIS?MI的鑒別診斷提供了可靠依據。
由像素不同導致灰度不同,進而呈現出一定的規律,即反映圖像上的灰度變換,就是所謂的紋理。如果將這些灰度級的變化進行量化,那么必然能夠反映一定區域的紋理特征,再通過數據法等方法獲取紋理參數。數據法相對最為常用,主要針對圖像中的像素,通過計算并確定每個像素的局部特征,再利用其空間分布情況獲取參數,其中又包括了多種方法。一階參數包括峰度值、偏度值、最大值、最小值、標準差,主要用于總體紋理特征的描述。本研究中標準差在DCIS組和DCIS?MI組之間差異有統計學意義,數據離散程度通過標準差評價,DCIS組與DCIS?MI組病例的全腫瘤體積下ADC值具有差異,標準差能反映出細微的差異性。本研究中DCIS組和DCIS?MI組在ADC圖的峰度值和偏度值差異沒有統計學意義,利用直方圖得到的峰度值和偏度值,其中偏度、峰度反映圖像像素值(本研究中代表ADC值)的分布情況,偏度值的正負反映直方圖的不對稱性,當數據大部分集中在直方圖的左側時,偏度值為正值;當大部分的數據集中在直方圖的右側時,偏度值為負值。峰度反映參數值的分布集中情況,峰度值越高代表參數值分布越集中,反之,分布越分散,說明ADC值可能在整個腫瘤體積內不同區域之間變化很大[12]。兩者差異沒有統計學意義的原因可能是由于DCIS?MI是指浸潤范圍不差過1 mm的DCIS,而這一圖像特征難以在ADC圖上通過像素直方圖曲線中心的偏離反映出來,所以差異不具有統計學意義。
紋理分析二階法主要用于局部紋理特征的描述,在此過程中需要應用灰度共生矩陣完成。該方法常用于腫瘤異質性的分析當中,能夠借此了解灰度分布混亂程度,從而獲得較為準確的結果,包括均勻度、相關性等。熵值用于反應灰度分布隨機性,二者呈現明顯正相關,該值的增高表明腫瘤異質性越高。能量,即角秒,用于度量灰度均勻程度,以此判斷其平滑程度,同樣也與腫瘤異質性密切相關,并且二者呈現明顯負相關。如果分布均勻,那么紋理則較粗,能量值大,異質性則較低。腫瘤內部完全均勻時熵值最小,腫瘤內部非均勻時熵值增大[13-15]。均勻度值表示圖像ROI中各離散值平方和的測度,主要用于度量圖像異質性,二者具有明確的正相關性,如果較為均勻則意味著異質性更高,提示離散度更高,范圍有所加大。本研究結果發現,DCIS的均勻度及能量值明顯高于DCIS?MI,差異具有統計學意義,而DCIS?MI的熵值高于DCIS。這一結果定量證明了DCIS?MI組較DCIS組的腫瘤內部更為不均質及復雜。
本研究具有一定局限性。我們選擇腫塊型強化的DCIS和DCIS?MI單發病灶進行DWI的紋理特征研究,最大徑及年齡在DCIS組和DCIS?MI組間差異無統計學意義,在避免DWI對于非腫塊強化病灶測量誤差的同時,也造成病例選擇的偏倚,需今后納入非腫塊強化病灶結合DCE形態學特征擴大研究對象;此外,由于是回顧性研究,無法獲取手術切除過程中更為詳細的信息,需要今后將臨床病理信息如組織學及術中特征等與圖像紋理分析相結合,獲得更全面的結果。本研究樣本量雖小,但結果顯示基于ADC圖的腫瘤全域紋理分析有助于鑒別腫塊型強化的DCIS和DCIS?MI,從影像組學的角度反映出DCIS?MI比DCIS具有更大的異質性,其中DCIS?MI的標準差值、均勻度值和熵值都顯著高于DCIS,而DCIS的能量值顯著高于DCIS?MI。這些研究結果可為反映早期乳腺癌的影像生物學特征提供新的思路,具有一定的臨床應用價值。

