磁敏感加權成像上微出血灶和髓靜脈擴張對急性缺血性卒中后出血轉化的預測價值
李姣姣 郝霄竹 藺璐奕 孫成鳳 李嬋嬋
急性缺血性卒中溶栓治療后繼發的出血轉化(hemorrhage transformation,HT)是嚴重并發癥,可加重神經功能障礙,導致高死亡率、高致殘率[1-6],因此早期預測HT意義重大[7-8]。隨著磁敏感加權成像(susceptibility weighted imaging,SWI)的廣泛應用,微出血灶和髓靜脈擴張受到越來越多的關注。微出血灶是在SWI上直徑2~5 mm的圓形低信號影,邊界清楚,病理學是腦小血管周圍少量出血形成含鐵血黃素沉積[9-12]。SWI的另一大優勢是能靜脈成像,特別是對小靜脈的顯示更為優越。對于急性缺血性卒中患者,微出血灶的存在和梗死側髓靜脈擴張是否是發生HT的獨立危險因素,仍不明確。本研究對76例單側大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)的急性缺血性卒中患者的SWI圖像進行分析,并對患者進行短期影像隨訪,旨在探討SWI圖像上微出血灶和髓靜脈擴張對急性缺血性卒中后發生HT的預測價值。
方 法
1.1 研究對象
回顧性連續收集2016年1月至2020年12月上海市靜安區中心醫院(復旦大學附屬華山醫院靜安分院)和復旦大學附屬華山醫院神經內科急診收治的單側MACO急性缺血性卒中患者,其診斷依據《中國急性缺血性腦卒中診療指南2014》進行。入組標準:①患者年齡大于18歲且小于85歲。②卒中癥狀為前循環癥狀。③入院時美國國立衛生研究院卒中量表(National Institute of Health stroke scale,NIHSS)評分為4~22分。④卒中癥狀發病時間明確,發病4 h內溶栓治療之前行CT/CT血管成像(CT angiography,CTA)/MRI平掃(包括SWI)。⑤頭顱CT平掃排除顱內合并出血。⑥CTA證實梗死側大腦中動脈(middle cerebral artery,MCA)M1完全閉塞,對側無頭頸部血管閉塞。⑦卒中癥狀發病3周內行CT或SWI隨訪。排除標準:①合并其他顱腦疾病,如變性、腫瘤、寄生蟲、蛛網膜囊腫等。②有顱腦手術史。③對碘對比劑過敏、有磁共振檢查禁忌證、檢查不能合作等其他原因而導致無法獲得清晰完整影像學資料的患者。本研究經醫院倫理委員會審核通過。
2.掃描方法
2.1 CTA檢查
成像設備為256層CT掃描儀(Brilliance iCT;Phillips Medical Systems,Cleveland,USA)。先掃描側位定位圖,使用雙腔高壓注射器以5 mL/s的速率通過肘正中靜脈注射50 mL離子型碘對比劑(Ultraist,含 碘 量370 mg/mL;Bayer Healthcare,Berlin,Germany),采用自動觸發技術,注射對比劑8 s后啟動自動追蹤觸發掃描。參數如下:球管電壓120 kV,電流150 mA,層厚9 mm,準直64 mm×0.625 mm,螺距0.7,視野220 mm×220 mm,矩陣512×512,尾向頭掃描,掃描范圍從顱底至顱頂。
2.2 MRI平掃
MRI檢查設備為3.0 T超導磁共振掃描儀(Verio;Siemens AG,Erlangen,Germany)。彌散加權成像(diffusion weighted imaging,DWI)采用單次激發平面回波脈沖序列,重復時間4 800 s,回波時間74 ms,平均1次,彌散敏感系數(b)值分別為0和1 000 s/mm2,掃描時間37 s,視野240 mm×240 mm,矩陣256×256,橫斷面掃描范圍從顱頂至枕骨大孔,層厚6 mm,間隔2 mm,層數16層。SWI序列重復時間28 s,回波時間20 ms,翻轉角150°,視野240 mm×240 mm,矩陣256×256,層厚1.2 mm,間距0,層數72。
3.圖像后處理方法及分析
3.1 CTA圖像
CTA原始圖像由256 CT自帶的Phillips Brilliance Workspace portal軟件進行后處理及重建,分別以最大密度投影和容積再現技術顯示,重建出覆蓋全腦的容積CTA圖像。
3.2 SWI圖像
根據是否存在微出血灶將患者分為微出血灶陽性組和微出血灶陰性組。微出血灶陽性判斷標準是SWI圖像上腦實質內2~5 mm的圓形低信號影,邊界清楚,排除鈣化和血管流空信號影(圖1)[12]。根據是否存在梗死側髓靜脈擴張將患者分為髓靜脈擴張組和無髓靜脈擴張組。梗死側髓靜脈擴張判斷標準是梗死側髓靜脈數量超過且直徑大于對側(圖2)[13]。由2名神經影像學醫師對SWI圖像上微出血灶和髓靜脈擴張進行分析,意見不一致時經討論達成一致。
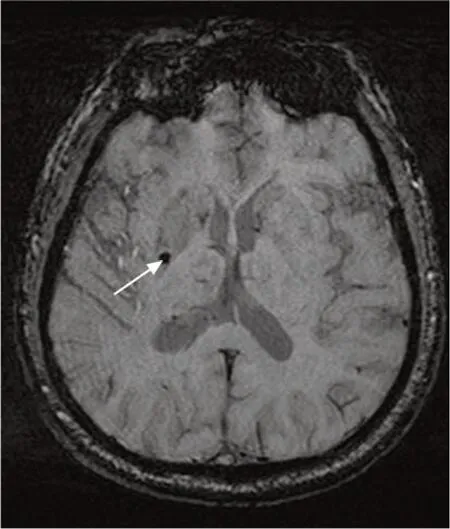
圖1 微出血灶
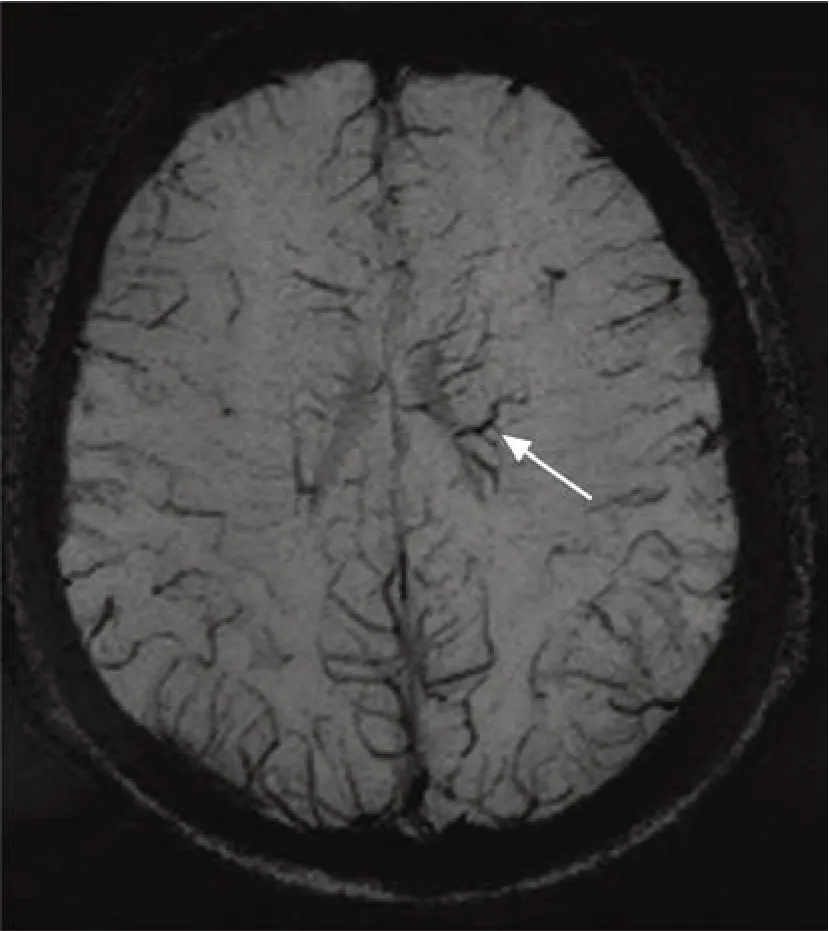
圖2 梗死側髓靜脈擴張
3.3 急性缺血性卒中后HT
確定標準為發病后首次影像學檢查未發現腦內急性出血,隨訪(圖3)發現梗死灶邊緣或內部不同范圍的CT高密度灶或SWI序列低信號灶(對照CT除外鈣化灶)。由2名神經影像學醫師(不同于對SWI圖像進行分析的2名神經影像學醫師)對隨訪圖像進行分析,意見不一致時經討論達成一致。
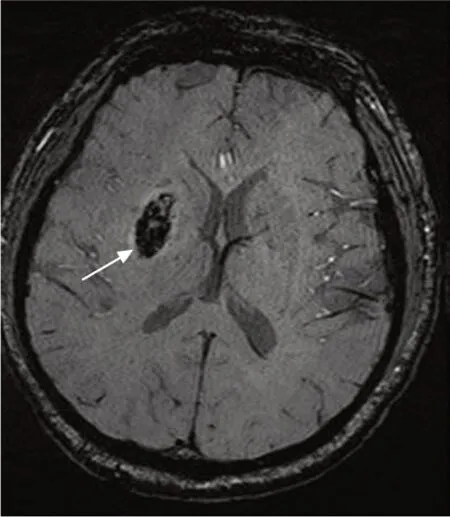
圖3 急性缺血性卒中后發生出血轉化(HT)
4.統計學分析
采用SPSS 21.0軟件分別對微出血灶陽性組和微出血灶陰性組、髓靜脈擴張組和無髓靜脈擴張組組間變量差異進行統計分析,其中計量資料采用t檢驗,計數資料采用Fisher確切概率法。以發生HT為因變量行單因素和多因素logistic回歸分析。P<0.05為差異有統計學意義。
結 果
符合條件的76例MCAO急性缺血性卒中患者,男47例,女29例,平均年齡(63.1±14.2)歲。其中,微出血灶陽性組46例,微出血灶陰性組30例,2組間變量比較,差異無統計學意義(表1);髓靜脈擴張組15例,無髓靜脈擴張組61例,2組間變量比較,差異無統計學意義(表1)。
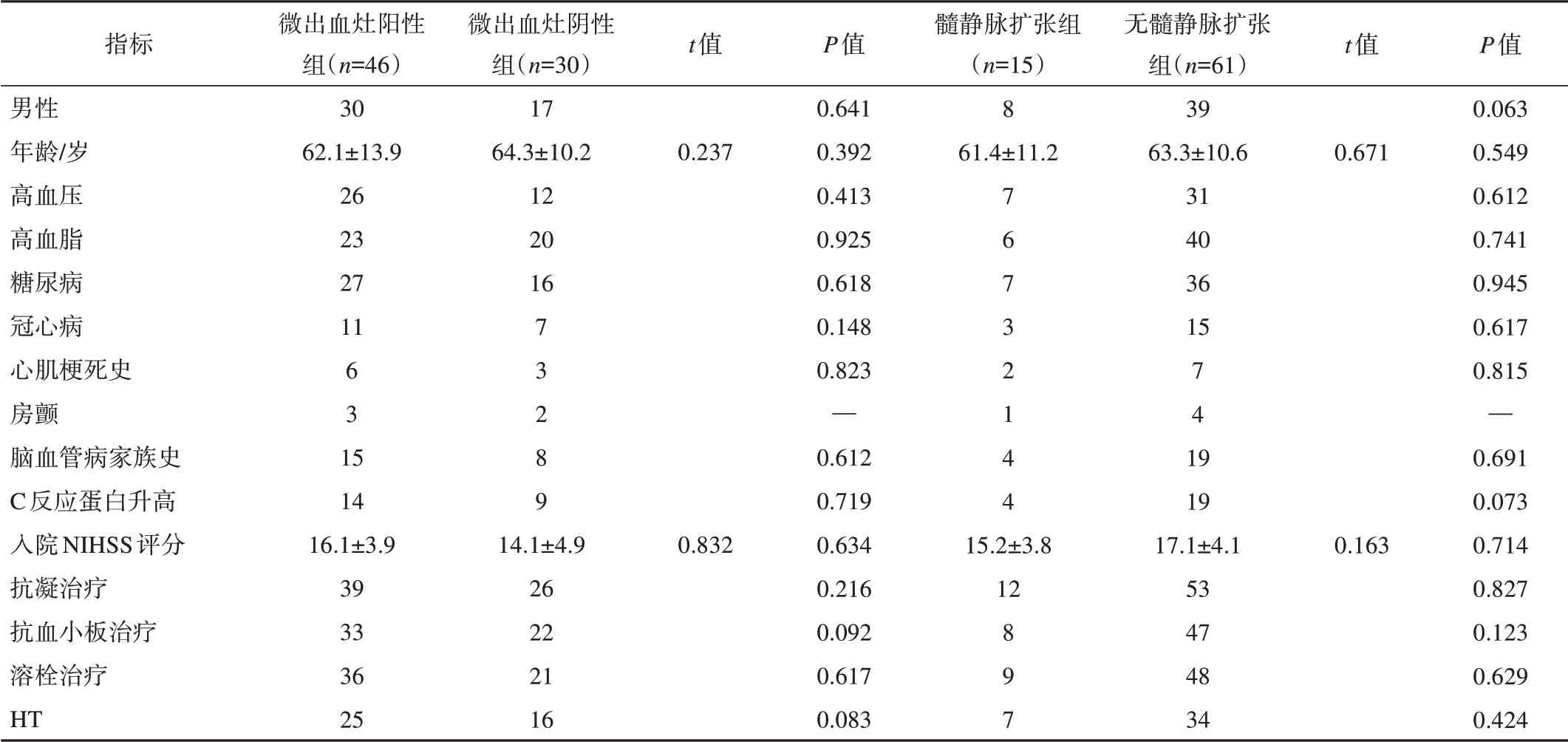
表1 組間變量比較
臨床治療后影像隨訪發生HT者41例。以年齡、入院NIHSS評分、微出血灶和髓靜脈擴張為自變量,以HT為因變量行單因素和多因素logistic回歸分析,結果(表2)顯示微出血灶和髓靜脈擴張均不是急性缺血性腦卒中后HT的獨立預測因子。
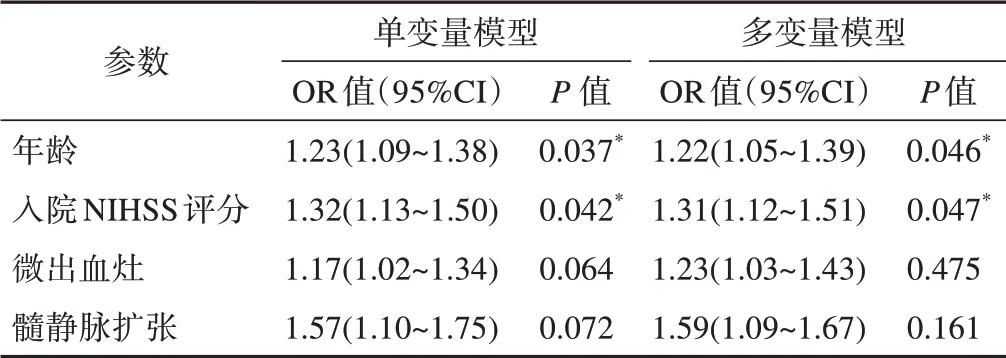
表2 單變量和多變量logistic回歸分析
討 論
HT是急性缺血性卒中后CT/MRI圖像上新發現的顱內出血,其發生與多種機制有關,包括血腦屏障受損、局部炎性反應、缺血再灌注(氧化應激)和側支循環建立等,其中血腦屏障受損是HT的核心特點[7]。HT的發生嚴重影響功能恢復,并與較高的病死率獨立相關[2-3,5]。
靜脈溶栓治療后按出現HT的部位分為梗死內實質出血和遠端實質出血。有研究[2]認為梗死內實質出血是由閉塞血管內的再灌注和血管損傷引起的,而遠端實質出血可能是廣泛存在的出血性腦小血管病引起的。微出血定義為腦小血管周圍含鐵血黃素沉積,是一種易出血的病理狀態,主要歸因于腦淀粉樣變(cerebral amyloid angiopathy,CAA)和高血壓性血管病[12]。CAA相關微出血負擔與遠端實質出血相關,而非CAA相關的微出血負擔與梗死內實質出血相關。在SWI上檢測到微出血是出血性小血管病變的標志。在最近的一項薈萃分析[7]中,靜脈溶栓前存在微出血灶的患者其HT的發生率與沒有微出血灶的患者其HT發生率差異沒有統計學意義,我們的結果與之一致,并且我們的結果顯示微出血灶不是急性缺血性腦卒中后HT的獨立預測因子。
SWI對靜脈的成像依賴于血氧飽和度形成的磁敏感差異,不受血流速度的干擾,是無須注射造影劑的靜脈成像新技術,尤其對小靜脈的成像具有獨到優勢,可顯示直徑1 mm以下的小靜脈,并進行半定量評估[13-14]。缺血性腦卒中急性期,缺血區血液供應減少,血流緩慢,此時靜脈內的去氧血紅蛋白濃度升高,因此小靜脈容易產生對比而顯影,缺血越嚴重,小靜脈顯示得越多、越清晰。缺血性腦梗死急性期后,閉塞大血管再通或二級側支循環建立,隨著梗死區血液供應得到不同程度改善,靜脈內含氧血紅蛋白含量亦隨之增多,導致SWI上靜脈顯示不佳。我們的結果顯示梗死側髓靜脈擴張不是急性缺血性腦卒中后HT的獨立預測因子。
目前可獲得的關于微出血灶與HT的關系、髓靜脈擴張與HT的關系結論不一致,有必要進行更多的前瞻性研究以確認微出血和髓靜脈擴張的臨床意義,并確定其在各種情況下用于卒中后HT的預測模型。
本研究的不足主要有兩點。一是屬于回顧性研究,病例數較少,未能對微出血灶按數目、部位進一步細分,未能將HT分為癥狀性顱內出血和無癥狀性顱內出血分別進行研究,也未能納入更多臨床預測因素,如血壓、血糖、腦血管病家族史等。二是沒有對患者進行遠期隨訪,探討微出血灶、髓靜脈擴張與卒中后遠期神經功能結局的關系。總之,急性缺血性腦卒中后SWI能夠檢出微出血灶和髓靜脈擴張,但微出血灶和髓靜脈擴張均不是HT的獨立預測因子。

