多囊卵巢綜合征患者甘油三酯葡萄糖乘積指數與非酒精性脂肪性肝病患病風險的關系
傅佳蓉 朱雨宸 虞 潔 劉 偉 陶 弢
上海交通大學醫學院附屬仁濟醫院內分泌科,上海 200127
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是一種復雜的生殖內分泌代謝異常疾病[1],易伴發肥胖、胰島素抵抗(insulin resistance,IR)、糖調節受損和心血管疾病等代謝疾病[2-3]。35%~70%的PCOS 患者同時罹患非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)[4]。NAFLD 指除外其他導致肝臟脂肪積聚的繼發因素,經影像或組織學檢查存在肝臟脂肪變的證據[5]。NAFLD 診斷的金標準包括肝組織活檢或質子核磁共振波譜法,但這些方式存在侵入性或成本高等不足[6],而常規超聲對肝臟輕度脂肪變的敏感性較弱[7],因而采用其他無創、經濟并準確的標志物作為NAFLD 診斷的輔助工具對初期篩查具有重要意義。
甘油三酯葡萄糖乘積指數(triglyceride-glucose index,TyG)和脂質蓄積指數(lipid accumulation product,LAP)、內臟 脂肪指數(visceral adiposity index,VAI)同屬于新型代謝指數,可作為評估IR、2 型糖尿病和心血管疾病發生風險的標志物[8-10]。而以IR 為主的代謝危險因素與NAFLD 發病密切相關[11]。本研究主要旨在分析PCOS 患者TyG 與NAFLD 的關系,同時與VAI 和LAP 比較,為進一步研究TyG 在PCOS 患者中對NAFLD 的預測作用提供依據。
1 對象與方法
1.1 研究對象
選擇2017 年1 月至2020 年12 月就診于上海交通大學醫學院附屬仁濟醫院(以下簡稱“我院”)內分泌科的PCOS 患者。納入標準:①年齡18~45 歲;②符合2003 年鹿特丹標準[12]的初發PCOS;③臨床資料完整。NAFLD 診斷依據2012 年美國胃腸病協會和肝病協會聯合發布的《非酒精性脂肪性肝病診療指南》[13]。排除標準:①其他與PCOS 臨床表現相似的疾病包括先天性腎上腺皮質增生等;②過量飲酒;③包括病毒性和自身免疫性、遺傳、藥物導致的其他肝病;④妊娠哺乳期;⑤近3 個月曾用降脂類或改善IR 的藥物。最終納入350 例PCOS 患者,根據是否患有NAFLD將其分為NAFLD 組(201 例),非NAFLD 組(149 例)。
1.2 研究方法與觀察指標
患者在行75 g 口服葡萄糖耐量試驗及同步胰島素激發試驗前1 d 夜間8:00 后禁食。測量并計算空腹狀態下患者的腰臀比和體重指數(body mass index,BMI)。于早卵泡期檢測患者游離睪酮指數(free androgen index,FAI)、性激素結合球蛋白(sex hormone-binding globulin,SHBG)、抗米勒管激素(anti-Müllerian hormone,AMH)。另收集患者谷丙轉氨酶(glutamic-pyruvic transaminase,GPT)、谷草轉氨酶(glutamic-oxaloacetic transaminase,GOT)、γ-谷氨酰轉移酶(gamma-glutamyl transferase,GGT)、甘油三酯(triglyceride,TG)、總 膽固醇(total cholesterol,TC)、高密度脂蛋白膽固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白膽固醇(low density lipoprotein-cholesterol,LDL-C)、空腹血糖(fasting blood glucose,FPG)。血液化驗和B超由我院生化室、免疫室、核醫學科和超聲醫學科完成。使用羅氏試劑及羅氏Hitachi D2400/E170 分析儀測定肝功能和血糖血脂,化學發光免疫法測定血胰島素和性激素(羅氏Elecsys 自動分析儀)。胰島素抵抗和敏感性評估分別依據穩態模型評估胰島素抵抗(homeostasis model assessment-IR,HOMA-IR)指數[14]和Matsuda 指數[15]。采用梯形積分法分別估算血糖曲線下面積(area under the blood glucose curve,AUCglu)和胰島素曲線下面積(area under the insulin curve,AUCins)評價葡萄糖口服負荷后血糖波動和胰島素分泌情況。TyG=ln[(TAG×FBG)/2][16];LAP=(腰圍-58)×TG[17];VAI=腰圍/(36.58+1.89×BMI)×TG/0.81×1.52/HDL-C[18]。
1.3 統計學方法
采用SPSS 26.0 對所得數據進行統計學分析,Kolmogorov-Smirnov 檢驗計量資料的正態性,符合正態分布的計量資料采用均數±標準差()表示,組間比較采用t 檢驗,偏態分布計量資料的描述以中位數(四分位數)[M(P25,P75)]表示,組間比較采用Mann-Whitney U 檢驗。采用Spearman 相關系數分析相關性。采用logistic 回歸分析影響因素。以P <0.05 為差異有統計學意義。
2 結果
2.1 兩組臨床資料比較
NAFLD 組年齡、BMI、腰臀比、FAI、GPT、GOT、GGT、TG、TC、LDL-C、FBG、HOMA-IR 指 數、AUCglu、AUCins、TyG、LAP、VAI 均 高 于 非NAFLD 組,SHBG、AMH、HDL-C、Matsuda 指數低于非NAFLD 組,差異有統計學意義(P <0.05)。見表1。
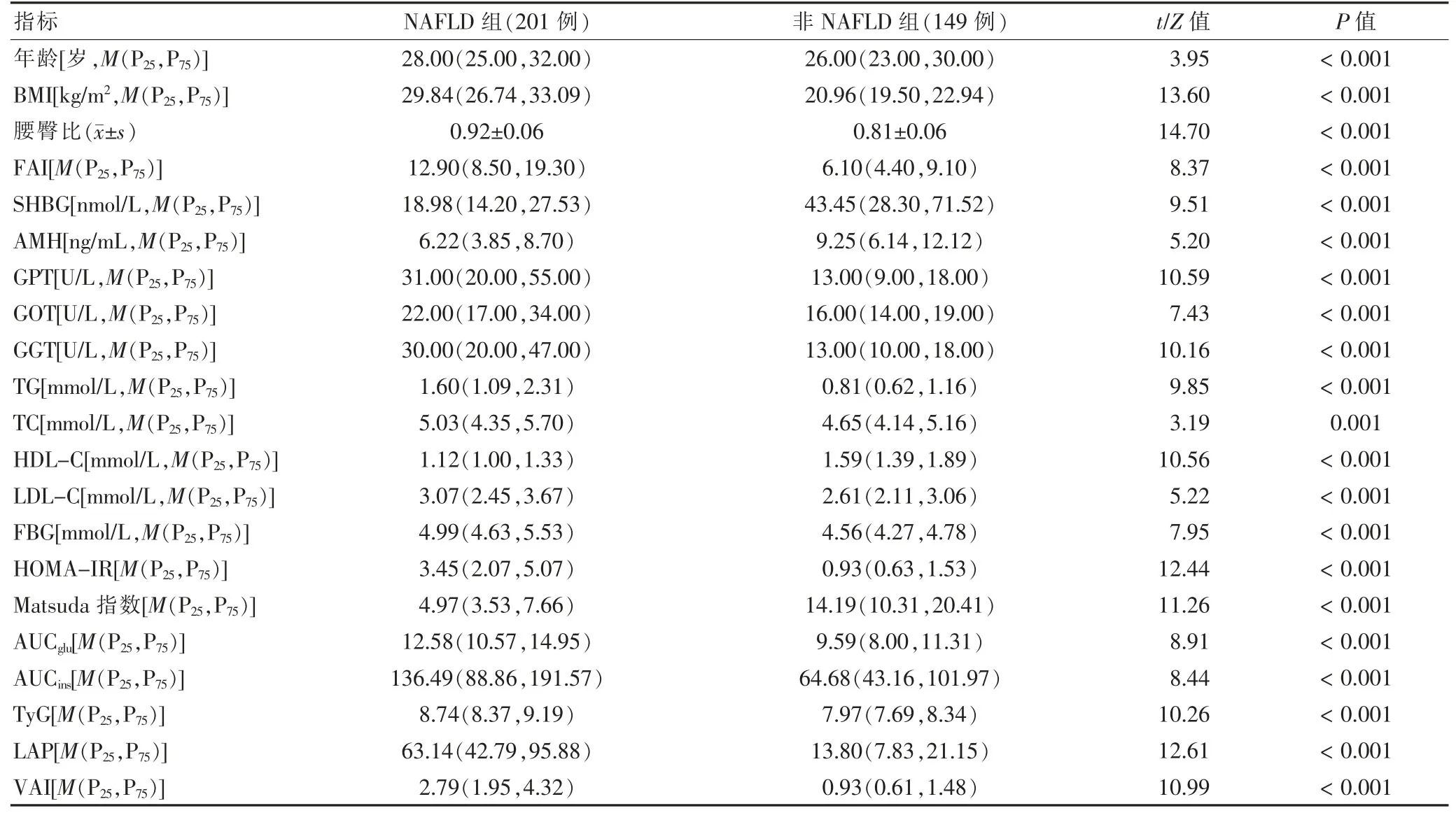
表1 兩組臨床資料比較
2.2 TyG 和代謝生殖指標的相關性分析
在肝功能方面,TyG 與GPT、GOT 和GGT 呈正相關(rs=0.54,0.43,0.66,P <0.05)。在糖脂方面,TyG與TC、LDL-C、AUCins呈正相關(rs=0.40,0.40,0.52,P <0.05),與HDL-C 呈負相關(rs=-0.57,P <0.05)。在生殖方面,TyG 與FAI 呈正相關(rs=0.45,P <0.05),與SHBG、AMH 呈負相關(rs=-0.38,-0.14,P <0.05)。
2.3 PCOS 患者發生NAFLD 影響因素分析
將PCOS 患者是否發生NAFLD 作為因變量(發生=1,未發生=0)進行單因素logistic 回歸。結果顯示年齡(OR=1.09,95%CI:1.04~1.14)、BMI(OR=1.63,95%CI:1.48~1.80)、HOMA-IR(OR=4.01,95%CI:2.95~5.46)、FAI(OR=1.19,95%CI:1.13~1.25)、GPT(OR=1.09,95%CI:1.07~1.12)、TyG(OR=10.86,95%CI:6.32~18.68)、LAP(OR=1.08,95%CI:1.06~1.10)、VAI(OR=3.16,95%CI:2.35~4.23)均為NAFLD 的危險因素(P <0.05)。為比較TyG、LAP 和VAI 與PCOS 患者發生NAFLD 的關系,避免各指數之間的相互影響,將其分別按四分位數分層(TyG:≤7.95=1,>7.95~8.44=2,>8.44~8.92=3,>8.92=4;LAP:≤15.85=1,>15.85~40.80=2,>40.80~72.53=3,>72.53=4;VAI:≤0.93=1,>0.93~1.91=2,>1.91~3.26=3,>3.26=4),以是否發生NAFLD為因變量(發生=1,未發生=0),將研究對象分別納入各指數的4 個亞組,并進行多因素logistic 回歸,校正混雜因素,結果顯示TyG>7.95、LAP>15.85、VAI>1.91均為PCOS 患者發生NAFLD 的獨立危險因素(OR >1,P <0.05)。見表2。
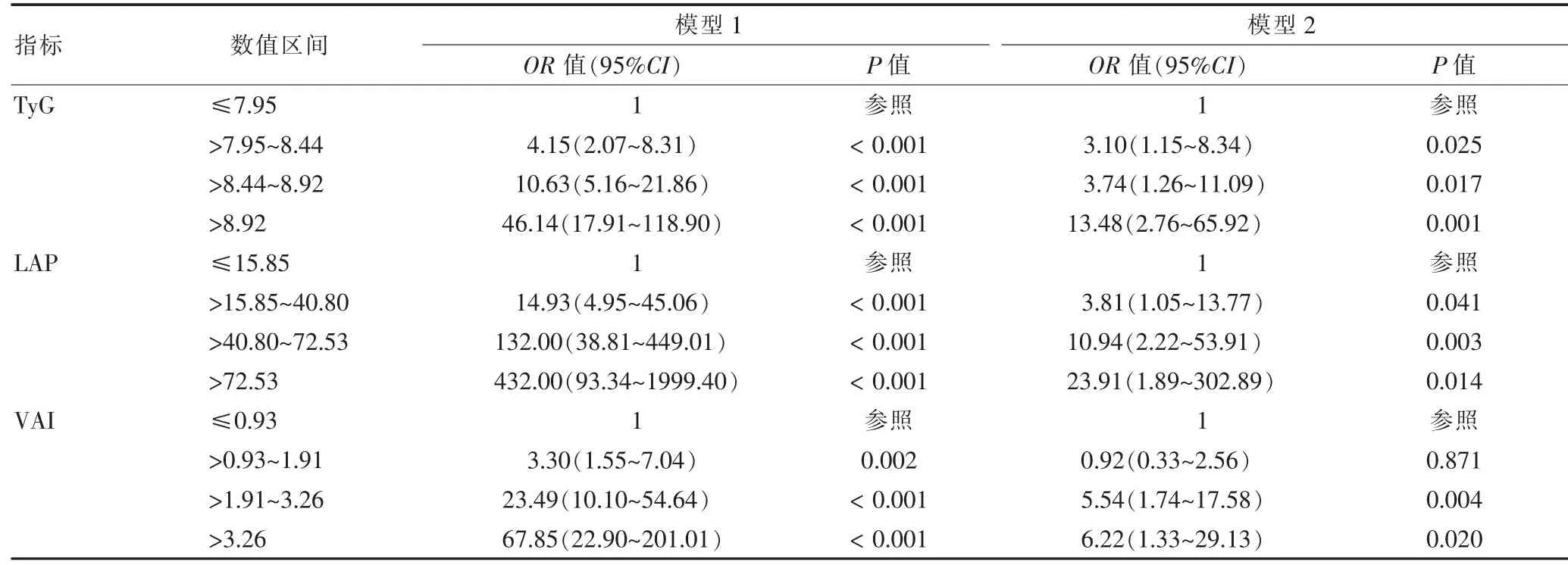
表2 PCOS 患者發生NAFLD 影響因素分析
3 討論
本研究在國內較大樣本的PCOS 人群中明確TyG 與NAFLD 的關系。PCOS 伴NAFLD 者TyG、LAP和VAI 均高于不伴NAFLD 的PCOS 患者,有研究報道TyG 與NAFLD 的發病風險有關[19]。本研究中,單因素logistic 回歸結果提示TyG 是NAFLD 的危險因素,校正混雜因素后,TyG>7.95 為PCOS 伴NAFLD 的獨立危險因素。在韓國的一項研究中提出TyG 在成人中對NAFLD 的預測作用優于HOMA-IR 指數[20]。
本研究發現TyG 與AUCins呈正相關,提示TyG升高與體內胰島素分泌水平增多有關。IR 會導致肝臟攝取過多的游離脂肪酸,受血糖和胰島素升高的刺激,通過轉錄因子固醇調節元件結合蛋白1c 和碳水化合物反應元件結合蛋白誘導的脂質合成增多,加劇異位沉積[21-22]。NAFLD 患者肝臟脂肪變性與骨骼肌IR的相關性高于肝臟IR,其在血糖升高時更易于進入肝臟轉化為脂質[23-24]。本研究在校正HOMA-IR 指數等因素后,升高的LAP 和VAI 仍然與NAFLD 風險增加有關,提示這兩種指數可能與NAFLD 患病獨立于IR有關。在沒有IR 或血脂紊亂的情況下,Patatin 樣磷脂酶結構域蛋白3 的常見序列變異(I148M)與脂肪性肝病關系密切[25-26],提示在部分人群中NAFLD 的發病可能不歸咎于IR。
本研究具有一定的局限性:肝穿刺活檢是NAFLD確診的金標準,但因有創性,尚無法大規模用于臨床篩查[6],B 超仍是臨床診斷NAFLD 的最常用手段;但人體TAG 水平易受外界和飲食因素干擾。本研究為觀察性研究,后續需要縱向研究跟蹤PCOS 患者以明確因果關系。
綜上所述,本研究在PCOS 患者中發現TyG 指數升高是NAFLD 患病的獨立危險因素,可作為PCOS 患者篩查NAFLD 的一個輔助工具。

