大亞灣西南海域尖筆帽螺2020年7月暴發期內的分布特征*
劉 岱 應軻臻 蔡中華 黃洪輝 畢洪生
大亞灣西南海域尖筆帽螺2020年7月暴發期內的分布特征*
劉 岱1應軻臻2蔡中華1黃洪輝3畢洪生4①
(1. 清華大學深圳國際研究生院 深圳 518055; 2. 深圳市綠洲光生物技術有限公司 深圳 518057; 3. 中國水產科學研究院南海水產研究所 廣州 510300; 4. 馬里蘭大學環境中心 美國馬里蘭州 20688)
尖筆帽螺是一種分布廣泛的翼足類生物, 在食物網與生物地球化學循環中起著重要作用。2020年7月, 大亞灣出現高密度尖筆帽螺, 給當地生態安全帶來潛在風險。文章利用浮游生物成像儀(PlanktonScope), 以定點的方式對大亞灣西南海域的環境因子與尖筆帽螺密度進行采樣, 并對大亞灣高密度尖筆帽螺的分布特征進行研究。結果顯示: 在水平方向上, 尖筆帽螺主要分布于西部灣口及長灣附近海域, 其他海域分布相對較少; 在垂向上, 尖筆帽螺多分布于高溫低鹽的表層, 低溫高鹽的下層水體分布較少; 體長分布方面, 灣口西部及其北側海域尖筆帽螺體長較長, 小辣甲西側、北側海域尖筆帽螺體長偏短, 灣口中部海域體長遠小于其他區域。通過分析結果發現, 此次大亞灣灣內高密度尖筆帽螺存在隨外海海流輸入的可能; 溫鹽分布結果表明, 尖筆帽螺多出現在海水表層, 其垂直分布可能也受海水分層及海流的影響。通過對尖筆帽螺分布特征的歸納與討論, 可以為后續該種生物的進一步溯源提供參考。
大亞灣; 尖筆帽螺; 分布特征; 浮游生物成像儀; 水下成像系統; 近海生物暴發
翼足類是腹足綱的一個單系分支, 在海洋食物網、生物地球化學循環與海洋酸化中扮演著重要角色(Howes, 2014; Manno, 2019; Kohnert, 2020)。翼足類常隨海流漂移的特性, 使它對不同水團有重要的指示作用(Chen, 1970)。尖筆帽螺()是一種分布廣泛的翼足類生物, 南北緯50度范圍內均有分布(Burridge, 2017), 在我國東海與南海的各個季節也有觀測到較多種群(戴燕玉, 1995; 徐兆禮, 2005)。尖筆帽螺廣泛的水平分布可能與其水平運動能力弱、隨海流移動且溫鹽適應范圍廣的特性有關(Sakthivel, 1974; 齊鐘彥等, 1986; Xu, 2006)。在垂直分布方面, 尖筆帽螺傾向于生活在海水表層, 總豐度往往與表層水溫和海流有關(齊鐘彥等, 1986; Xu, 2006), 這種垂直分布特征可能與其捕食活動有關, 尖筆帽螺在近岸的大規模出現經常與浮游植物的暴發(Sakthivel, 1974)和浮游動物的高生物量期吻合(Peter, 1978), 意味著尖筆帽螺可能更傾向于生活在浮游植物較為密集的上層水體。在種群豐度方面, 尖筆帽螺由于個體的繁殖可以發生在生命周期的早期, 不需要成長為成熟的雌性個體(Lalli, 1989), 其繁殖周期可能較短, 能夠在適宜條件下實現快速地繁殖, 具備大規模暴發的條件。
目前, 尖筆帽螺的暴發日漸頻繁。自20世紀60年代起, 尖筆帽螺在世界范圍內的觀測記錄開始增多, 并在2010年后出現大幅度增長(GBIF, 2020)。2020年7月, 在南海北部大亞灣地區發現尖筆帽螺成群聚集, 暴發成“潮”, 給當地生態安全帶來潛在風險(Hunt, 2008)。為研究大亞灣灣內尖筆帽螺的來源, 需要通過采樣得到尖筆帽螺的分布狀況。然而傳統的浮游生物網與聲吶探測等采樣手段, 都面臨諸多缺點與挑戰。浮游生物網對于斑塊狀分布的生物采樣效率低下, 在拖網采樣中也難以獲得物種精確地水平分布信息; 對于淺海生物, 浮游生物網難以獲得樣本精確地垂直分布信息, 且在采樣過程中容易出現掛網、漏網等問題, 給數據的準確度帶來影響(Remsen, 2004; Howes, 2014)。而聲吶探測則不具備分辨生物個體的能力, 甚至同種生物的不同個體都需要不同頻率才能準確分辨, 同時易受外界干擾, 如近表層的聲波反射(Robison, 2004)。因此我們需要一種新的采樣方式來克服傳統采樣方式的缺點。
浮游生物成像儀(PlanktonScope)是基于浮游生物可視化成像系統(ZOOplankton VISualization, ZOOVIS)而發展的遠心背影水下成像系統(Bi, 2013; Song, 2020), 該系統能在濁度較高的復雜水體環境中對微小生物形成有效成像, 具有寬視野、大縱深、高分辨率等特點, 已在白令海、中國南海、東海、黃海、深圳灣、大亞灣等多個海域成功應用(Bi, 2017; Song, 2020)。浮游生物成像儀能夠通過原位成像的方式準確獲得尖筆帽螺的垂直分布情況以及在海洋中的活動狀況, 并可以通過人工智能系統智能分辨所拍圖片中浮游生物的種類與數量, 有效克服了傳統采樣方式所面臨的困境。
本研究通過浮游生物成像儀在大亞灣海域的定點垂直投放, 獲得尖筆帽螺在采樣站點的密度和垂直分布情況, 并通過插值法預測尖筆帽螺在大亞灣西北部海域的分布, 追溯尖筆帽螺的可能來源, 為后續應對尖筆帽螺的爆發提供參考。
1 材料與方法
1.1 研究海域與采樣方法
本次研究的采樣時間為2020年7月4日, 范圍為大亞灣22.56°—22.68°N, 114.50°—114.70°E范圍內海域(圖1)。采樣方法為利用裝有EXO (EXO1 Multiparameter Sonde)的浮游生物成像儀(PlanktonScope)在研究海域內的10個點位(S1—S10)進行定點垂直投放, 投放深度為0—12 m。投放時, 先將裝有EXO的成像儀緩慢投放至近底部, 停留數分鐘后再緩慢拉起進行回收, 過程中浮游生物成像儀以10 Hz的頻率進行圖像采樣, 采樣原位圖如圖2所示; EXO則以1 Hz的頻率實時測定海水的溫度、鹽度、深度和葉綠素濃度等指標, 得到海水的理化特征數據。

圖1 大亞灣采樣站點圖

圖2 浮游生物成像儀原位采樣圖片
利用EXO采集到的溫度與鹽度數據, 結合海水熱力學方程(TEOS-10)(Feistel, 2010; Wright, 2010), 計算出各個水層的海水密度, 并對1 m水深間隔的溫度與鹽度進行聚類分析。
將EXO采集到的溫度、鹽度、葉綠素濃度數據以1 m為間隔, 計算出不同水深的溫度、鹽度和葉綠素濃度; 將不同深度的環境因子求平均值, 作為當前采樣站點對應的環境因子的數值; 最后使用Matlab (R2020b, Mathworks Inc.)工具箱Design and Analysis of Computer Experiments (DACE)中的克里金插值法(Kriging) (Lophaven, 2002), 對采樣海域溫度、鹽度和葉綠素濃度的空間分布情況進行插值計算。其中回歸模型選用0階多項式, 即假設采樣區域滿足二階平穩性假設:

式中,1()是位置的函數,1()=1表示估計值僅與距離相關。
相關模型選用球狀模型(Spherical):



式中,(,,)表示與隨機過程總協方差有關的函數,(,w–x)表示其在第個點上的分量;表示已知點與未知點的位置函數,w、x為其在第個點上的分量,w?x反映已知點與未知點之間的距離,反映計算值隨距離衰減的速率, 上限值設為1.5, 下限值設為0.1, 初始猜測值設為0.5。
1.2 圖像獲取與生物提取
浮游生物成像儀每小時能夠采集約36 000張圖片, 圖像處理包括三部分: 第一步是利用動態下采樣(Cheng, 2020)和自適應閾值法對潛在目標物進行提取及增強(Bi, 2015; Cheng, 2019); 第二步是基于卷積神經網絡(CNN)的特征提取和描述; 第三步是多分類SVM模型進行分類(Cheng, 2019)。
首先利用自適應ROI提取(adaptive ROI extraction)獲得圖片中的潛在目標物。該方法將最大穩定極值區域(maximally stable extremal regions, MSER)和Sauvola局部二值化法相結合, 首先計算圖像的平均信噪比 (mean signal-to-noise ratio, MSNR), 計算公式如下:

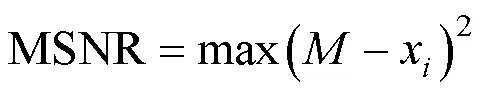
式中,代表像素數,x代表第個像素的像素值。如果MSNR>0.1, 圖片有較高的對比度, 則利用MSER方法對圖片進行二值化處理; 如果MSER≤0.1, 說明圖片對比度較低, 則利用Sauvola局部二值化法對圖片進行二值化處理, 以1像素的步長, 1%—3%圖片尺寸的大小對圖片進行分割, 根據公式(4), 通過對(,)/(,)與設定閾值的大小進行比較, 來確定所有像素的二值化(Cheng, 2019)。

式中,(,)為每個矩形框的閾值大小,(,)為矩形框內的平均像素值,為整個圖片所有像素的最大標準差, 對灰度圖像來說, 這個值為128。(,)為矩形框內所有像素的標準差, k為固定值0.34。
然后利用ROI增強實現目標物特征的進一步增強。該步驟在提取ROI的基礎上, 采用基于斷點鏈接的降噪算法來實現目標特征增強。對自適應ROI提取步驟中所劃分的矩形框, 設矩形框內的像素數為N, 如果以某像素為中心的矩形框內, 0.75N數量的像素點都為目標物, 那么該像素也會被認定為目標物的一部分(Cheng, 2019)。
在取得目標區域(ROI)后, 將目標區域以外的像素值保存在數組back中, 目標區域的數值設為0。對其中的所有非0像素值按以下公式進行增強, 對背景進行銳化:
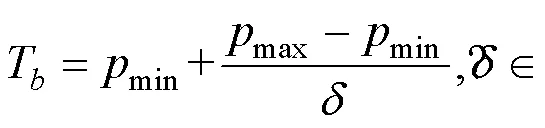

式中,T表示目標物背景強度,min為區域內最低像素值,max為區域內最大像素值,為3到4之間的常數,為原非0像素值,′為增強后的像素值(Cheng, 2019)。
其次是利用卷積神經網絡(CNN)中的卷積層和全連接層對上述步驟得到的ROI進行特征學習, 并利用訓練集中的樣本調整CNN, 最后將全連接層的輸出作為多分類SVM模型訓練與分類的輸入(Cheng, 2019)。
1.3 尖筆帽螺密度統計方法
浮游生物成像儀采用平行光背影成像技術, 根據成像區間(8 cm×9 cm)和景深(5 cm), 可以估算清晰成像的水層體積為0.36 L。每張圖片中清晰成像的尖筆帽螺數量即為0.36 L海水中尖筆帽螺的數量, 反映的尖筆帽螺密度為:
, (6)
其中為尖筆帽螺密度, 單位為ind./m3;為圖片中清晰成像的尖筆帽螺數量。
對于尖筆帽螺在垂直方向上的分布, 選用1 m的深度間隔, 根據EXO所采集的深度數據, 收集1 m深度間隔范圍內所有的圖片, 統計圖片數量dep、所有圖片中尖筆帽螺總數量dep, 得到該1 m水層內尖筆帽螺的密度dep為:

以1 m為間隔, 對于所有采樣站點不同深度的尖筆帽螺密度求平均值, 得到該采樣站點尖筆帽螺的平均密度ave為:
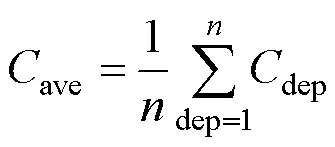
并根據每個采樣站點的平均密度, 使用DACE工具箱對尖筆帽螺在采樣海域的水平分布情況進行預測(Lophaven, 2002), 其中回歸模型選用0階多項式, 即假設采樣區域滿足二階平穩性假設:

式中,1()是位置的函數,1()=1表示估計值僅與距離相關。
相關模型選用高斯模型(Guass):

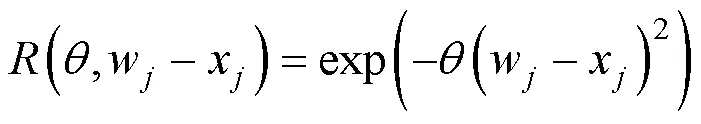
式中,(,,)表示與隨機過程總協方差有關的函數,(θ,w?x)表示其在第個點上的分量;為表示已知點與未知點的位置函數,w、x為其在第個點上的分量,w?x反映已知點與未知點之間的距離,反映計算值隨距離衰減的速率, 上限值設為1.5, 下限值設為0.1, 初始猜測值設為0.5。
1.4 尖筆帽螺體長統計方法
1.4.1 尖筆帽螺體長測量樣本選取 對于所有采樣站點通過ROI提取與神經網絡分類后的單個尖筆帽螺圖像, 按照圖像清晰、體長完整、避免重復與覆蓋的原則進行挑選(表1)。尖筆帽螺總數量小于10 000的站點, 挑選所有符合要求的單個尖筆帽螺圖像; 尖筆帽螺數量大于10 000的站點, 利用隨機數法按照上述原則進行挑選, 直至數量達到500張。由于S1、S4站點尖筆帽螺數量過少, S8站點無數據, 因而不進行挑選。
1.4.2 模型建立與體長計算 從已挑出的尖筆帽螺圖片中, 隨機挑選約300張圖片, 用于建立公式模型(表1)。每個站點二次挑選的圖片數量依據各個站點一次挑選出的圖片數量占總挑出圖片數的比例來決定, 每個采樣站點二次挑選的圖片數量num為:

其中,1為特定站點一次挑選挑出的單個尖筆帽螺圖片數量,A為一次挑選挑出的單個尖筆帽螺圖片總數量。二次挑選占總挑出圖片數量的18%—20%, 用于代表整體的體長狀況。二次挑選同樣通過隨機數法來完成。
對二次挑選得到的單個尖筆帽螺圖片進行二值化處理, 選出其中的最大連通區域, 并生成矩形框。成像儀采集到的圖像每像素長度為31 μm, 據此可以得到矩形框的長邊長度。尖筆帽螺與體長可由以下公式估算測量:

其中,為尖筆帽螺體長的估算測量值,1為矩形框長邊長度。為與最大連通區域具有相同標準二階中心矩的橢圓的長軸與矩形框長邊的夾角, 用于反映圖像上尖筆帽螺主軀干的朝向。同時手動在每張圖片上選取尖筆帽螺頭尾兩點, 計算出兩點間距離L, 作為圖像中尖筆帽螺的實際體長。對體長的估算值與體長的實際值L進行一元線性回歸, 得到體長估算修正公式:
表1 各個采樣位點一次挑選、二次挑選圖片挑選情況

Tab.1 Number of images selected in the first and second round at different sampling sites

檢驗0.01, 證明兩者線性關系顯著。利用該模型, 可測量出一次挑選中所有尖筆帽螺的體長, 并對不同站點體長分布進行聚類分析, 將體長與溫度、鹽度、葉綠素濃度進行多元線性回歸。
2 結果
2.1 環境因子
對于溫度分布, 在水平方向上, S3站點平均溫度最高, S1、S2、S4、S5、S7站點次之, S6、S9、S10站點平均溫度相對較低(圖3a)。在垂直方向上, S1—S5、S7站點隨深度增加, 溫度降低較為平緩; S6、S9、S10站點在水深5—6 m的水層內溫度急劇下降(圖4a)。
對于鹽度分布, 在水平方向上, S6站點平均鹽度最高, S7、S9站點相對較高, S2、S5、S10次之, S1、S3站點鹽度相對較低, S4站點鹽度最低(圖3b)。在垂直方向上, S2、S3、S5、S7站點鹽度隨深度變化較小; S1、S4、S6站點鹽度隨水深增加而增加, S6站點在6 m水深處鹽度變化較大, 而S1、S4站點鹽度隨深度變化較為緩慢; S9、S10站點在水深5 m處鹽度變化較大, 5 m水深以上的水層與5m水深以下的水層, 鹽度變化較為平緩(圖4b)。
對于葉綠素濃度分布, S1、S4站點葉綠素濃度最高, 且隨深度增加而增大, 在3 m水深處達到穩定; S6、S9站點葉綠素濃度相對較高, 約為S1、S4站點的一半, 且隨深度增加而增大, 在7 m水深處達到穩定; S3、S5、S10站點葉綠素相對較低, 約為S6、S9站點的一半, S3、S5站點葉綠素濃度隨深度增加而增大, S10則是各個水層葉綠素濃度相對均勻, 變化較小。S2、S7站點葉綠素濃度偏低, S7站點幾乎為0 (圖3c, 4c)。
2.2 尖筆帽螺水平分布狀況
各采樣站點的尖筆帽螺平均密度存在較大差異。其中S9站點尖筆帽螺密度最高, 超過3 000 ind./m3; S3站點相對較高, 約為1 000 ind./m3; S2、S4、S6、S7、S10站點尖筆帽螺密度介于200—500 ind./m3之間。S5站點尖筆帽螺密度較小, 不足100 ind./m3; S1站點未發現尖筆帽螺。根據克里金插值法, 對尖筆帽螺在采樣區域的分布進行預測, 結果如圖3d所示, 可以看出灣口西部海域尖筆帽螺密度最高, 長灣附近密度相對較高, 大鵬澳海域內未發現尖筆帽。
2.3 尖筆帽螺垂直分布狀況
在不同采樣站點中, 尖筆帽螺密度垂直分布的差異較為顯著。其中S1點未發現尖筆帽螺; S2、S5、S6三個站點尖筆帽螺在采樣水層的底部分布較多, 而S4、S7、S9、S10四個站點則在采樣水層的上部分布較多, S3站點尖筆帽螺在整個水層內均勻分布。在深度超過5 m的站點中, S7、S9、S10站點尖筆帽螺主要分布在5 m以上水層, S6站點則主要分布在5 m以下水層(圖4d)。
根據不同水層溫度、鹽度與尖筆帽螺密度, 以及利用海水熱力學方程(TEOS-10)得到的海水密度(Feistel, 2010; Wright, 2010), 可以得到尖筆帽螺主要分布的溫度區間為27.50—32.50 °C, 鹽度區間為32.50—34.50, 密度區間為1 019.50— 1 021.50 kg/m3(圖5)。

圖3 采樣海域溫度(a)、鹽度(b)、葉綠素濃度(c)、尖筆帽螺密度(d)水平分布圖
注:為尖筆帽螺密度, 單位為ind./m3

圖4 采樣位點溫度(a)、鹽度(b)、葉綠素濃度(c)、尖筆帽螺密度(d)垂直分布圖

圖5 尖筆帽螺密度溫鹽變化圖
注: rho為海水密度, 圓圈大小表示尖筆帽螺密度, 單位為ind./m3
2.4 尖筆帽螺體長分布狀況
尖筆帽螺在不同站點體長的分布情況既存在相似性, 也存在一定差異。S2、S3、S5、S6、S7、S9站點體長在9—12 mm范圍內的個體最多, 平均體長相近。其中S2站點體長長于12 mm的個體偏多; S3、S7兩個站點體長短于9 mm的個體偏多。S10站點體長在6—9 mm范圍內的個體最多, 平均體長偏短(圖6, 7)。
利用圖6中各個站點的體長分布占比進行聚類分析, 可以發現S3與S7站點的體長分布最為接近; S5、S6、S9站點的體長分布相差相對較小; S2、S10站點與其他站點相比, 體長分布相差較大(圖8)。將體長與溫度、鹽度、葉綠素濃度進行多元線性回歸, 分析結果2<0.4, F檢驗值>0.1, 體長與環境因子的線性相關性并不明顯。
3 討論
3.1 灣口海域尖筆帽螺分布與來源
尖筆帽螺本身水平運動能力較弱, 其分布受海流影響較大(Sakthivel, 1974; 齊鐘彥等, 1986), 且從圖3可以看出, 尖筆帽螺水平分布與環境因子的關系并不明顯, 因而灣口海域不同地點尖筆帽螺密度的差異, 可能主要受海流影響。武文等(2017)的研究表明, 灣口西部大辣甲西南側海域(S9)往復流較弱, 余流較強流向灣內。從溫度與鹽度分布(圖3a, 3b)也可看出, 該片海域表現出低溫高鹽的特征, 受外來海水入侵的特征明顯(韓舞鷹等, 1991), 因而灣外的尖筆帽螺可能更易隨海流進入, 并在此處滯留, 形成高密度區域(圖3d)。

圖6 尖筆帽螺體長分布圖

圖7 各站點尖筆帽螺體長最小值、平均值與最大值
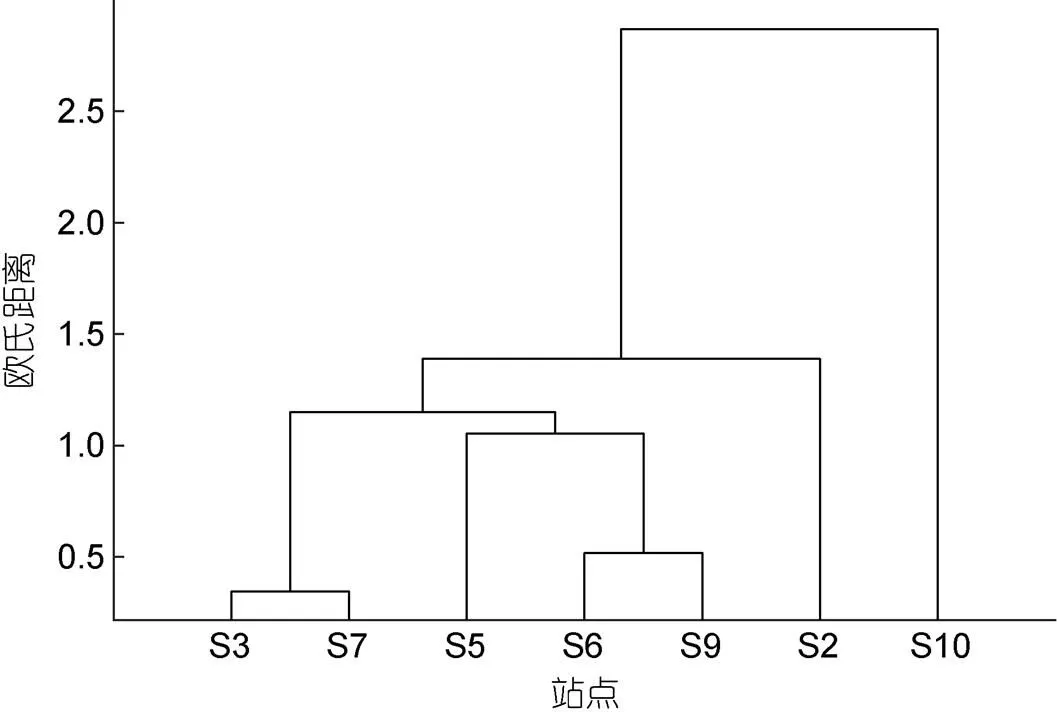
圖8 采樣位點尖筆帽螺體長聚類分析
灣口中部海域(S10)往復流較強, 余流較弱斜向灣外東南方向(武文等, 2017)。此處相比灣口西部溫度相對較高, 鹽度相對較低, 可能是由于往復流較強受灣內與灣外海水影響均較大。受往復流影響, 尖筆帽螺可能更難在此處滯留, 密度較小(圖3d)。
3.2 灣內西南側海域尖筆帽螺分布與來源
對于灣內西南側海域, 尖筆帽螺在長灣附近分布較多, 大鵬澳內部分布較少, 其余海區平均密度相近(圖3d)。通過尖筆帽螺溫鹽分布(圖5)可以發現, 尖筆帽螺更偏向于出現在高溫低鹽的水體, 長灣附近受核電站溫排水影響, 水體溫度較高, 同時距灣口相對較遠, 鹽度偏低, 尖筆帽螺可能更傾向于在此處聚集。同時該片海域流速較大, 余流較強, 尖筆帽螺可能更易在此處淤積(吳仁豪等, 2007; 武文等, 2017)。大辣甲北部S7附近海域尖筆帽螺密度低于長灣海域, 但體長分布與長灣相近(圖6, 7, 8), 且流經長灣的海流與流經大辣甲北部的海流均源于西部灣口(武文等, 2017; Zhang, 2019), 兩片海域尖筆帽螺來源可能存在一定聯系。
大辣甲西部S5、S6站點附近海域尖筆帽螺密度相對較低, 且體長分布與灣口西部(S9)相似, 平均體長相當(圖7, 8)。體長回歸分析表明, 尖筆帽螺體長與溫度、鹽度和葉綠素濃度等環境因子無明顯線性相關性, 這意味著尖筆帽螺體長分布可能受海流影響較大。灣口西部海域存在較強的指向灣內的余流, 因而該片海域的尖筆帽螺可能隨海流進入灣內, 滯留于大辣甲西部。
3.3 影響尖筆帽螺垂直分布因素
尖筆帽螺垂直分布受諸多因素影響, Karakas等(2020)發現尖筆帽螺具備垂直運動能力, 且受捕食活動和環境變化等因素驅動, 可能會對尖筆帽螺的垂直分布產生較大影響。在捕食活動方面, 尖筆帽螺以浮游植物為食(Howes, 2014), 從圖4c、4d中可以看出, S6站點尖筆帽螺密度與與葉綠素濃度變化趨勢相近, 但在尖筆帽螺密度較高的S9站點, 變化趨勢則相反, 浮游藻類分布與尖筆帽螺密度分布相關性并不明顯, 表明尖筆帽螺垂直分布在不同的環境條件下可能對食物的響應不同。在環境方面, 從圖5可以看出尖筆帽螺主要分布于溫度偏高, 鹽度偏低的水域, 該類型的水域主要出現在海水表層, 這與Xu等(2006)的研究一致。同時溫鹽的變化受海流影響較大, 多項研究表明, 粵東地區夏季存在上升流, 低溫高鹽的海水易入侵大亞灣, 導致灣內海水分層(韓舞鷹等, 1988; 曾剛等, 1992; Zhang, 2019); Zhang等(2019)則發現大亞灣西南部海域夏季表層海流與深度平均海流方向并不一致。從圖4a、4b圖中可以看出, 西部灣口及附近海域水深5—6 m處存在溫鹽變化較大的水層, 可能存在海水分層的現象。不同水層海流流向的差別, 可能是大辣甲西部海域尖筆帽螺在采樣水層的下層分布較多的原因之一; 同時海流流速與垂直混合強度, 也可能會對尖筆帽螺的垂直分布帶來影響。
4 結論
本文通過利用浮游生物成像儀與EXO等設備對大亞灣西南海域進行圖片及環境因子采樣, 獲得溫度、鹽度、葉綠素濃度等環境因子和尖筆帽螺在該片海域的分布情況, 得到以下結論:
(1) 利用浮游生物成像儀, 能夠獲得尖筆帽螺精細的水平、垂直分布特征。在水平方向上, 尖筆帽螺主要分布于西部灣口及長灣附近海域, 存在外源輸入的可能。在垂直方向上, 尖筆帽螺多分布于表層, 但在大辣甲西側海域, 尖筆帽螺在下層水體分布相對較多, 可能受溫鹽與海水分層影響。
(2) 在大亞灣海域內, 尖筆帽螺高豐度多出現于溫度較高、鹽度較低水層, 且該類溫鹽特征多出現于海水表層; 在低溫高鹽水域, 尖筆帽螺分布較少, 豐度較低。
(3) 尖筆帽螺在不同海域體長分布不同。大鵬澳東側海域長個體偏多, 西部灣口體長適中, 靠近內側的小辣甲西部、南部海域體長偏短, 灣口中部海域體長遠小于其他區域。體長大小的分布與溫度、鹽度和葉綠素濃度相關性并不明顯, 可能與海流存在一定關系。
齊鐘彥, 林光宇, 張福綏等, 1986. 中國動物圖譜: 軟體動物第三冊. 北京: 科學出版社
吳仁豪, 蔡樹群, 王盛安等, 2007. 大亞灣海域潮流和余流的三維數值模擬. 熱帶海洋學報, 26(3): 18—23
武 文, 嚴聿晗, 宋德海, 2017. 大亞灣的潮汐動力學研究——I.潮波系統的觀測分析與數值模擬. 熱帶海洋學報, 36(3): 34—45
徐兆禮, 2005. 東海浮游翼足類(Pteropods)種類組成和多樣性研究. 生物多樣性, 13(2): 168—173
韓舞鷹, 馬克美, 1988. 粵東沿岸上升流的研究. 海洋學報, 10(1): 52—59
韓舞鷹, 馬克美, 1991. 大亞灣海水混合交換特征. 海洋科學, (2): 64—67
曾 剛, 李 立, 許金殿等, 1992. 大亞灣西部和北部淺水區夏半年的溫、鹽度分析. 臺灣海峽, 11(1): 28—34
戴燕玉, 1995. 南海中部翼足類和異足類生態的初步研究. 海洋學報, 17(6): 111—116
Bi H, 2017. Hongsheng Bi. 2014. Framework for mobile deployment of the ZOOplankton Visualization and Imaging System (ZOOVIS) and Dual-frequency IDentification SONar system (DIDSON) in the Bering Sea, July-August 2017. Research Workspace. 10.24431/rw1k57s, version: 10.24431_rw1k57s_20210316T191058Z
Bi H S, Cook S, Yu H, 2013. Deployment of an imaging system to investigate fine-scale spatial distribution of early life stages of the ctenophorein Chesapeake Bay. Journal of Plankton Research, 35(2): 270—280
Bi H S, Guo Z H, Benfield M C, 2015. A semi-automated image analysis procedure forplankton imaging systems. PLoS One, 10(5): e0127121
Burridge A K, Goetze E, Wall-Palmer D, 2017. Diversity and abundance of pteropods and heteropods along a latitudinal gradient across the Atlantic Ocean. Progress in Oceanography, 158: 213—223
Chen C, Hillman N S, 1970. Shell-bearing pteropods as indicators of water masses off cape hatteras, north carolina. Bulletin of Marine Science, 20(2): 350—367
Cheng X M, Cheng K C, Bi H S, 2020. Dynamic downscaling segmentation for noisy, low-contrast in situ underwater plankton images. IEEE Access, 8: 111012—111026
Cheng K C, Cheng X M, Wang Y Q, 2019. Enhanced convolutional neural network for plankton identification and enumeration. PLoS One, 14(7): 0219570
Feistel R, Wright D G, Jackett D R, 2010. Numerical implementation and oceanographic application of the thermodynamic potentials of liquid water, water vapour, ice, seawater and humid air – Part 1: background and equations. Ocean Science, 6(3): 633—677
GBIF, 2020. GBIF.org (17 July 2020) GBIF occurrence download. https://doi.org/10.15468/dl.rfkdyz
Howes E L, Bednar?ek N, Büdenbender J, 2014. Sink and swim: a status review of thecosome pteropod culture techniques. Journal of Plankton Research, 36(2): 299—315
Hunt B P V, Pakhomov E A, Hosie G W, 2008. Pteropods in Southern Ocean ecosystems. Progress in Oceanography, 78(3): 193—221
Karakas F, Wingate J, Blanco-Bercial L, 2020. Swimming and sinking behavior of warm water pelagic snails. Frontiers in Marine Science, 7: 556239
Kohnert P C, Cerwenka A F, Brandt A, 2020. Pteropods from the kuril-kamchatka trench and the sea of okhotsk (Euopisthobranchia; Gastropoda). Progress in Oceanography, 181: 102259
Lalli C M, Gilmer R W, 1989. Pelagic Snails: the Biology of Holoplanktonic Gastropod Mollusks. Stanford: Stanford University Press
Lophaven S N, Nielsen H B, S?ndergaard J, 2002. Aspects of the matlab toolbox DACE. Technical University of Denmark
Manno C, Rumolo P, Barra M, 2019. Condition of pteropod shells near a volcanic CO2vent region. Marine Environmental Research, 143: 39—48
Peter K, Paulinose V, 1978. Swarming of creseis acicula rang (Pteropoda) in the Bay of Bengal. Indian Journal of Marine Sciences, 7(2): 126—127
Remsen A, Hopkins T L, Samson S, 2004. What you see is not what you catch: a comparison of concurrently collected net, Optical Plankton Counter, and Shadowed Image Particle Profiling Evaluation Recorder data from the northeast Gulf of Mexico. Deep Sea Research Part I: Oceanographic Research Papers, 51(1): 129—151
Robison B H, 2004. Deep pelagic biology. Journal of Experimental Marine Biology and Ecology, 300(1—2): 253—272
Sakthivel M, Harida P, 1974. Synchronization in the occurrence of Trichodesmium bloom and swarming of Creseis acicula Rang (Pteropoda) and Penilia avirostris Dana (Cladocera) in the area off Cochin. Mahasagar, 7: 61—67
Song J T, Bi H S, Cai Z H, 2020. Early warning ofblooms usingplankton imaging system: an example from Dapeng Bay, P.R. China. Ecological Indicators, 112: 106123
Wright D G, Feistel R, Reissmann J H, 2010. Numerical implementation and oceanographic application of the thermodynamic potentials of liquid water, water vapour, ice, seawater and humid air – Part 2: The library routines. Ocean Science, 6(3): 695—718
Xu Z L, Li C J, 2006. Study on abundance variation of pteropods in the East China Sea. Acta Oceanologica Sinica, 25(1): 100—107
Zhang H, Cheng W C, Chen Y R, 2019. Importance of large-scale coastal circulation on bay-shelf exchange and residence time in a subtropical embayment, the northern South China Sea. Ocean & Coastal Management, 168: 72—89
OUTBURST OFIN SOUTHWEST DAYA BAY IN JULY 2020
LIU Dai1, YING Ke-Zhen2, CAI Zhong-Hua1, HUANG Hong-Hui3, BI Hong-Sheng4
(1. Tsinghua Shenzhen International Graduate School, Shenzhen 518055, China; 2. Oasis Photobio Tech LTD., Shenzhen 518057, China; 3.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences, Guangzhou 510300, China;4. University of Maryland Center for Environmental Science, Maryland 20688, USA)
is a widely distributed pteropod and an important link of food web in biogeochemical cycle. In July 2020, high-densityoccurred in the Daya Bay, Hainan, South China Sea, which likely had considerable impact on local food web structure. In this study, an in-situ optical underwater plankton imaging systems, the PlanktonScope was deployed to determinedensity and environmental parameters in the bay. Spatial distribution ofwas investigated. Results show thatwas distributed in greater density mainly in the west bay mouth and Changwan than in other areas. In vertical direction,was distributed mainly in the surface layer with higher temperature and lower salinity than those in deeper water columns. The body length ofwas greater in the west bay mouth than those in the north and west area of Xiaolajia, and that in the middle of bay mouth was much shorter than other areas’. Therefore, the high-densityoutburst in Daya Bay might come from an outside source through current. The T-S diagram shows thatwas more likely to appear in the surface water and affected by the stratification of seawater and current. This study provided a reference for further tracing of the species.
Daya Bay;; distribution feature; PlanktonScope; underwater imaging system; coastal organism outburst
* 國家重點研發計劃項目,2017YFC1403601號, 2020ZLHY0403號, 2018YFC1407501號; 山東省重大科技創新工程項目, 2019JZZY020708號; 中國水產科學研究院基本科研業務費項目, 2020TD15號。劉 岱,碩士研究生,E-mail: 785426610@qq.com
畢洪生,博士,E-mail: hbi@umces.edu
2021-04-11,
2021-07-06
Q959.2
10.11693/hyhz20210400086