陳皮對高膽固醇血癥大鼠的預防作用及其機制
俞靜靜, 杜宇忠, 蘇 潔, 顏美秋, 笈文娜, 吳玉蘭, 陳素紅, 呂圭源*
(1.浙江中醫藥大學,浙江 杭州 310053;2.浙江工業大學,浙江 杭州 310014)
高膽固醇血癥是冠狀動脈粥樣硬化、心肌梗死、腦卒中等多種心腦血管疾病的直接誘因[1],而心血管疾病每年的致死率均高于其他疾病因素,已成為全球死亡的主要原因[2]。動脈粥樣硬化主要是由于血清膽固醇異常升高,低密度脂蛋白膽固醇等脂質顆粒在動脈血管壁的沉積所致[3],臨床治療常以他汀類降脂藥物為主,主要通過抑制羥甲基戊二酰輔酶A還原酶活性,阻斷人體細胞里的羥甲戊酸的代謝途徑,減少總膽固醇和低密度脂蛋白膽固醇的合成,加速血清內的膽固醇清理速度,抑制肝臟中載脂蛋白的合成,從而起到降脂保護心血管的作用[4]。
中醫古籍中的“膏”“脂”類似于現代醫學中的“血脂”[5],現代中醫藥治療大多從痰濁、瘀血入手。陳皮為蕓香科植物橘CitrusreticulateBlanco及其栽培變種的干燥成熟果皮,性溫,味辛、苦,入脾、肺經,具有理氣健脾,燥濕化痰之效[6],課題組前期發現該藥材具有降脂藥效,同時可避免口服西藥所致肝腎損傷等不良反應。本實驗探索陳皮對高膽固醇血癥大鼠的預防作用及機制,以期為今后相關治療提供參考。
1 材料
1.1 動物 48只健康雄性SD大鼠,SPF級,體質量(400±20)g,由浙江省醫學科學院實驗動物中心提供,動物生產許可證號SCXK(浙)2008-0033,動物合格證號0007835,基礎飼料喂養,自由飲水。
1.2 試劑與藥物 陳皮(批號120601,浙江中醫藥大學中藥飲片有限公司);辛伐他汀分散片(批號3137813,20 mg/片×7片,廣州南新制藥有限公司)。豬油(農華豬油,批號20140214,杭州世紀聯華超市);膽固醇(杭州誠信醫療儀器有限公司);去氧膽酸鈉(Sodium deoxycholate)(批號130801,上海伯奧生物科技有限公司);丙賽優(丙硫氧嘧啶片)(批號31131210,精華制藥集團股份有限公司);聚山梨酯80(吐溫-80)(批號20130301,溫州清明化工有限公司);1,2-丙二醇(批號20110705,如皋市化學試劑廠有限公司)。血清總膽固醇(TC)、谷丙轉氨酶(ALT)、天冬氨酸氨基轉移酶(AST)、尿酸(UA)、肌酐(Cr)試劑盒(批號20140417、20140401、20140403、20140407、20140226(寧波美康生物科技股份有限公司);載脂蛋白A1(ApoA1)、載脂蛋白B(ApoB)、羥甲基戊二酰輔酶A還原酶(HMGCR)、膽固醇7α羥化酶(CYP7α1)、卵磷脂膽固醇脂酰轉移酶(LCAT)、酰基輔酶A-膽固醇酰基轉移酶(ACAT)ELISA試劑盒(批號20140601A)(上海源葉生物科技有限公司)。
1.3 儀器 TBA-40FR全自動生化儀(日本東芝醫療系統株式會社);MoorFLPI散斑全幀實時掃描成像系統/固態恒溫激光發射器(英國Moor公司);Microcl17微量離心機(美國Thermo公司);DS-671電子計重天平(上海寺岡電子有限公司);PK-324電熱恒溫水浴鍋(上海精宏實驗設備有限公司);KQ-500DE數控超聲波清洗器(昆山市超聲儀器有限公司);WH-861渦懸混合器(太倉市科教器材廠);FB2204B電子天平(上海精科天美儀器有限公司);純水系統(杭州永潔達凈化科技有限公司)。
2 方法
2.1 藥液制備 取陳皮飲片,加10倍95%乙醇提取3次,每次1 h,趁熱過濾,合并提取液,提取液減壓濃縮至適量,加少量吐溫-80(使其終體積分數約3.0%)并加熱超聲使其均勻溶解,再加水至0.5 g/mL,蒸餾水稀釋至0.25、0.125 g/mL,即得高、中、低3個劑量組。取辛伐他汀分散片,置錐形瓶內,加蒸餾水超聲使溶解,制得0.4 mg/mL溶液。
2.2 模型建立 配制脂肪乳劑,方法為取25 g豬油放在100 mL燒杯里,放在磁力攪拌器上加熱,待溫度升到100 ℃時,加入10 g膽固醇融化,加入1 g丙賽優充分攪勻,加入25 mL吐溫-80制成油相;在另一燒杯中加入30 mL蒸餾水、20 mL丙二醇,放在電爐上加熱至60 ℃,加入2 g去氧膽酸鈉充分攪拌至完全溶解,制成水相,將水相加入油相,充分混勻后加蒸餾水至100 mL,即得脂肪乳劑[7]。造模時,脂肪乳劑與雙蒸水按1∶1比例稀釋,其間除正常組灌胃給予蒸餾水外,其余各組每天下午分別灌胃給予相應體積的脂肪乳劑(1 mL/100 g),每天1次。
2.3 分組與給藥 48只大鼠隨機分為正常組,模型組,陽性對照組(4×10-3g/kg辛伐他汀)及陳皮95%乙醇提取物高、中、低(5、2.5、1.25 g/kg)劑量組,正常組和模型組灌胃給予相應體積蒸餾水,各給藥組灌胃給予相應藥液,連續4周,每天觀察記錄大鼠活動狀態,每3 d稱定1次體質量。
2.4 血脂、肝腎功能指標檢測 末次給藥后,10%水合氯醛麻醉大鼠,腹主動脈取血(取血前禁食不禁水12 h),3 500 r/min低溫離心10 min,吸取血清,全自動生化分析儀檢測血清TC、LDL-c水平,以評價醇提物對血脂的調節作用;血清AST、ALT水平,以評價肝細胞受損后醇提物對其改善程度;血清Cr、UA水平,以評價醇提物對腎功能的改善作用。
2.5 尾部微循環檢測 給藥后4周,采用MoorFLPI散斑全幀實時掃描成像系統的激光多普勒技術,檢測各組微循環血流量。在實驗環境安靜(27 ℃)及清醒狀態下,將大鼠尾部置于掃描頭正下方視野處,選定約1 cm處5×5像素面積的區域,檢測皮下1 mm血流量,持續2 min(儀器參數為掃描距離35 cm,掃描速度每秒25幀圖像,掃描精度低分辨率),實驗過程中務必保證大鼠安靜。
2.6 ELISA法檢測血清相關因子水平 末次給藥后,10%水合氯醛麻醉大鼠,腹主動脈取血(取血前禁食不禁水12 h),37 ℃水浴靜置1 h后3 500 r/min離心10 min,分離血清,ELISA法檢測血清ApoA1、ApoB、HMGCR、CYP7α1、ACAT、LCAT水平。
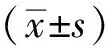
3 結果
3.1 大鼠一般體征、體質量、臟器系數、肝臟狀態 正常組大鼠皮毛光澤,行動靈活,進食量及大便正常;模型組大鼠食量減少,皮毛發黏,大便稀溏。給藥期間,與正常組比較,模型組及各給藥組大鼠體質量無明顯變化(P>0.05)。給藥4周后,與正常組比較,模型組大鼠各臟器系數均增加(P<0.01);與模型組比較,陳皮95%乙醇提取物高、中劑量組心、脾、腎、肝系數降低(P<0.05,P<0.01),低劑量組僅心、腎系數降低(P<0.05),見表1。

表1 陳皮95%乙醇提取物對高脂大鼠體質量和臟器系數的影響
由圖1可見,與正常組比較,模型組大鼠肝臟發白、腫脹,肉眼可見明顯白色點;與模型組比較,各給藥組都能明顯改善大鼠肝臟狀態。

注:1~6分別為正常組、模型組、陽性對照組、陳皮95%乙醇提取物高劑量(5 g/kg)組、陳皮95%乙醇提取物中劑量(2.5 g/kg)組、陳皮95%乙醇提取物低劑量(1.25 g/kg)組。
3.2 大鼠血脂指標 給藥4周后,與正常組比較,模型組大鼠血清TC、LDL-c水平升高(P<0.01);與模型組比較,陳皮95%乙醇提取物各劑量組大鼠血清TC、LDL-c水平降低(P<0.01),并呈一定的量效關系,見圖2。

注:與正常組比較,△△P<0.01;與模型組比較,*P<0.05,**P<0.01。
3.3 大鼠血清ApoA1、ApoB水平 給藥4周后,與正常組比較,模型組大鼠血清ApoA1水平降低(P<0.01),ApoB水平升高(P<0.01);與模型組比較,陳皮95%乙醇提取物高劑量組大鼠血清ApoA1水平升高(P<0.01),ApoB水平降低(P<0.01),見圖3。

注:與正常組比較,△△P<0.01;與模型組比較,**P<0.01。
3.4 大鼠血清肝功能指標 給藥4周后,與正常組比較,模型組大鼠血清ALT、AST活性升高(P<0.05);與模型組比較,陳皮95%乙醇提取物高劑量組可降低大鼠血清ALT、AST活性(P<0.05),中劑量組僅降低ALT活性(P<0.05),見圖4。

注:與正常組比較,△P<0.05;與模型組比較,*P<0.05。
3.5 大鼠血清腎功能指標 給藥4周后,與正常組比較,模型組大鼠血清UA、Cr水平增加(P<0.01);與模型組比較,陳皮95%乙醇高劑量組大鼠血清UA水平降低(P<0.05),而對血清Cr水平無明顯影響(P>0.05),見圖5。

注:與正常組比較,△△P<0.01;與模型組比較,*P<0.05。
3.6 大鼠尾部微循環血流量 給藥4周后,與正常組比較,模型組大鼠尾部微循環血流量減少(P<0.01);與模型組比較,陳皮95%乙醇提取物高劑量組大鼠尾部微循環血流量增加(P<0.05),見圖6。

注:與正常組比較,△△P<0.01;與模型組比較,*P<0.05。
3.7 大鼠血清HMGCR、CYP7α1活性 給藥4周后,與正常組比較,模型組大鼠血清HMGCR活性升高(P<0.01),CYP7α1活性降低(P<0.01);與模型組比較,陳皮95%乙醇提取物高劑量組大鼠血清HMGCR活性降低(P<0.01),見圖7。

注:與正常組比較,△△P<0.01;與模型組比較,**P<0.01。
3.8 大鼠脂質代謝轉運酶 給藥4周后,陳皮醇提物對LCAT、ACAT活性無明顯影響(P>0.05),見圖8。

注:與正常組比較,△P<0.05,△△P<0.01。
4 討論
隨著現代生活水平的提高、膳食結構的改變和生活方式的轉變,高脂血癥的發病率正日漸增高,且呈年輕化趨勢[8]。氣機升降正常,臟腑功能有序可凈化多余的脂濁[9]。陳皮作用于脂代謝紊亂疾病中可調暢氣機,疏利水氣血津液的運行,防止氣滯痰濁淤血,對高脂血癥具有一定的改善作用。
《景岳全書》有“腎主水,水泛亦為痰”之說,《醫學入門》有“痰源于腎”之論。《血證論》有“木之性主于疏泄,食氣入胃,全賴肝木之氣疏泄之而水谷乃化”。可見,高脂血癥與肝腎功能密切相關。苗杰等[10]通過鏡檢尿液有形成分發現腎小管上皮細胞脂肪變性和脂肪管型,這可能是腎功能受高脂血癥影響的表現。隨著高脂血癥患者的日益增多,其中不乏有酒精肝、脂肪肝之輩[11],此類人群血脂升高同時伴有肝功能異常。通過檢測模型大鼠血清AST、ALT、Cr、UA水平發現,陳皮醇提物具有一定的降尿酸作用和肝保護作用。陳皮在改善高脂血癥疾病過程的同時,還可改善肝腎功能。
脂蛋白可直接參與血漿脂質轉運清除代謝過程[12]。ApoA1是HDL的載脂蛋白,可使游離的TC發生酯化,驅動膽固醇的逆向轉運,減少膽固醇在細胞內的堆積,并促進動脈粥樣硬化斑塊狀膽固醇的清除,參與介導HDL對血管壁的保護作用[13]。ApoB是LDL-c的主要蛋白,在脂類的轉運和代謝過程中起著極其重要的作用[14]。ApoB/ApoA1的比例可能為預測心血管不良事件發病率的重要指標[15]。陳皮醇提物在調控模型大鼠ApoA1和ApoB水平的同時,可增加大鼠微循環血流量,充分起到降脂和保護心血管的作用。結論與已有報道一致[16]。
HMGCR是膽固醇合成的限速酶,參與膽固醇的合成[17]。調控HMGCR活性是維持體內膽固醇穩態的關鍵步驟[3]。目前他汀類藥物主要是通過調控HMGCR活性,減少膽固醇的內源性合成,達到降脂的目的。實驗中發現陳皮同樣具有抑制HMGCR活性,降低TC和LDL-c水平的作用,結合陳皮降尿酸和肝保護作用,推測陳皮是治療高膽固醇血癥的有效藥物。實驗期間同時檢測了血清CYP7α1、ACAT和LCAT的活性,以期從多靶點、多層面的角度深入研究其降膽固醇機制,但是效果并不明顯。究其原因可能為CYP7α1是膽固醇在肝臟轉化為膽汁酸的限速酶[18];ACAT是細胞內膽固醇酯化的關鍵酶,負責調節細胞內游離膽固醇和酯化膽固醇的平衡,LCAT可將細胞外HDL的游離膽固醇酯化[19]。實驗選用血清作為檢測材料,而這些指標主要是在肝細胞中表達,其作用機制有待進一步研究。
綜上所述,陳皮醇提物在改善高膽固醇血癥疾病過程中,表現出與他汀類藥物相同的治療效果,同時陳皮還具有保護肝腎功能,改善體內主要臟器腫大和增加微循環血流量的作用,充分體現出中醫藥多層面、不良反應小的優勢和特色。其作用機制可能是通過調控HMGCR的活性,抑制內源性膽固醇合成,同時調控載脂蛋白的水平,減少膽固醇的蓄積,起到降低血液中LDL-c和TC作用。

