黃芪甲苷通過RhoA/ROCK2通路對腦膜炎大鼠皮質神經元的保護作用
于 倩,安喆妮
(湖南省兒童醫院,湖南 長沙 410007)
細菌性腦膜炎(bacterial meningitis,BM)多發于新生兒期,是由不同病原菌引起的中樞神經系統感染性疾病[1]。B族溶血性鏈球菌(group B hemolytic strepto coccus,GBS)是引起新生兒腦水腫、血腦屏障損傷、神經系統損傷及死亡的主要致病菌[2]。RAS同源基因家族成員A(RAS homologous gene family member A,RhoA)/Rho相關螺旋卷曲蛋白激酶2(Rhorelated spiral coiled protein kinase 2,ROCK2)通路可抑制神經元內信號轉入、收斂細胞骨架網絡、抑制軸突生長,從而參與神經元突起的延長和再生過程[3],且抑制RhoA/ROCK2通路對神經有保護作用[4]。但RhoA/ROCK2通路在BM神經系統損傷中的調控作用,還未見報道。黃芪甲苷是中藥黃芪中的主要活性成分之一,現代藥理研究發現黃芪甲苷能顯著抑制中樞神經系統炎癥損傷,并能夠通過調控mTOR、炎癥、氧化應激、線粒體自噬等多種途徑,來抑制神經元凋亡、促進神經元再生及修復,并發揮神經保護作用[5]。但黃芪甲苷是否對BM引起的神經損傷有保護作用,還未見報道。本研究擬建立大鼠BM模型,對此進行驗證,并探究其發揮神經保護作用是否與RhoA/ROCK途徑有關,以期為黃芪甲苷的開發應用及BM的臨床治療提供實驗依據。
1 材料和方法
1.1 實驗動物 3周齡健康SPF級SD新生大鼠100只,體質量約50 g,雌雄不限,購自福州海王福藥制藥有限公司,生產許可證號:SCXK(閩)2020-0001,動物使用許可證號:SYXK(閩)2020-0006。所有大鼠于本院動物房中常規飼養,飼養條件:室溫(23±2)℃,濕度(55±10)%,自然光照。本實驗經本院動物倫理委員會批準同意,符合3R原則。
1.2 藥物與試劑 黃芪甲苷鈉標準品(上海寶曼生物科技有限公司,批號:20190413);腫瘤壞死因子(TNF-α)酶聯免疫吸附(ELISA)試劑盒(武漢伊萊瑞特生物科技股份有限公司,批號:20190303);神經元特異性烯醇化酶(NSE)ELISA試劑盒(北京百奧萊博科技有限公司,批號:20190403);降鈣素原(PCT)ELISA試劑盒(上海撫生實業有限公司,批號:20190523);兔抗大鼠RhoA抗體(美國abcam公司,貨號:ab187027);ROCK抗體(美國abcam公司,貨號:ab134181);勿動蛋白-A(Nogo-A)抗體(美國abcam公司,貨號:ab62024);溶血磷脂酸(LPA)抗體(美國abcam公司,貨號:ab23698);雞抗大鼠微管相關蛋白2(MAP2)抗體(美國abcam公司,貨號:ab5392);TUNEL染色試劑盒(北京伊塔生物科技有限公司,批號:20190304);鬼筆環肽染色液(廣州宏新生物技術有限公司,批號:20190416)。
1.3 主要儀器 SMZ745型光學顯微鏡(日本尼康公司);GIS-500型化學發光成像儀(杭州米歐公司號);ASA-602S腦立體定向儀(深圳安科高技術股份有限公司);Mini-PROTEAN Tetra Cell蛋白電泳儀(美國伯樂公司);M-Blot快速轉膜儀(南京中科通儀科技有限公司);JEM-F200透射電鏡儀器(日本電子株式會社)。
1.4 造模與分組 取SD新生大鼠80只,參照文獻[6]方法制備GBS菌液,將大鼠麻醉后,用腦立體定向儀向大鼠小腦延髓池注入濃度為1×108cfu/L的GBS菌液50 μL,建立BM模型。感染后24 h,抽取腦脊液并檢測腦脊液中TNF-α水平,若TNF-α水平高于正常腦脊液10倍以上,視為造模成功。共80只大鼠造模成功,將造模成功的大鼠隨機分為模型組、黃芪甲苷組、RhoA激動劑組、黃芪甲苷+RhoA激動劑組,每組20只。另取20只大鼠,于腦側室相同部位注入等量生理鹽水,作為正常對照組。
1.5 實驗給藥 參照文獻[7]將黃芪甲苷用生理鹽水稀釋成濃度為4.00 mg/mL的混懸液,黃芪甲苷組大鼠按10 mL/kg的劑量經腹腔注射給藥3 d,2次/d;RhoA激動劑參照文獻[8]設置劑量,RhoA激動劑組大鼠用微量注射器于小腦延髓池注入濃度為50 μmoL/L的RhoA激動劑溶液(按1 mL/kg劑量,每只大鼠約50 μL)1次;黃芪甲苷+RhoA激動劑組大鼠腹腔注射黃芪甲苷溶液的同時經小腦延髓池注射RhoA激動劑溶液;模型組及正常對照組大鼠經腹腔注射及經小腦延髓池注射等量生理鹽水。
1.6 觀察指標
1.6.1 大鼠一般行為觀察 給藥期間觀察各組大鼠毛色、行為活動及死亡狀況。
1.6.2 大鼠腦脊液中TNF-α、NSE及PCT水平 0.3%戊巴比妥鈉麻醉大鼠,用腦立體定向儀,從小腦延髓池穿刺進針后回抽腦脊液50 μL,取1 mL腦脊液,按ELISA試劑盒說明書檢測TNF-α、NSE及PCT水平。
1.6.3 大鼠腦皮質組織神經元超微結構 將大鼠用0.3%戊巴比妥鈉麻醉后,采用尾靜脈空氣栓塞法處死,開顱取腦,冰上分離腦皮質組織,剪取1 mm3腦皮質組織,用4%戊二醛固定后,送于電鏡室處理后,電鏡下觀察腦皮質組織神經元結構變化。剩余腦皮質組織分成兩部分,一部分置于-80 ℃冰箱保存備用,另一部分置于4%多聚甲醛中固定備用。
1.6.4 大鼠腦皮質神經元細胞凋亡率 取“1.6.3”項下4%多聚甲醛中固定的腦皮質組織,常規透明、浸蠟、包埋后,切成5 μm的間斷連續切片。取部分切片,按TUNEL染色試劑盒說明書方法進行染色后,置于顯微鏡下觀察神經元染色情況,凋亡細胞被染為紅棕色,用Image J圖像分析軟件統計檢測細胞凋亡率。
1.6.5 F-actin在神經元細胞中分布情況 取“1.6.4”項下部分切片石蠟切片,脫蠟及抗原修復后,加入曲拉通(Triton)透化30 min,滴加IgG標記的MAP2(1∶200)抗體,室溫孵育過夜后,滴加相應二抗溶液,室溫避光孵育1 h后,加入2 mg/mL FITC標記的鬼筆環肽溶液室溫避光染色3 h后,用抗熒光淬滅劑封片,熒光共聚焦顯微鏡觀察腦皮層神經元中F-actin分布情況。
1.6.6 MAP2與RhoA共表達水平 取“1.6.4”項下部分切片,脫蠟及抗原修復后,加入曲拉通(Triton)透化1 h,加入一抗(MAP2、RhoA,1∶200),4 ℃孵育過夜后,加入二抗[羊抗兔-FITC(綠)和山羊抗雞IgG(紅)]室溫避光孵育2 h,DAPI顯色,封片,用熒光顯微鏡觀察并拍照,并通過Image Pro Plus 5.0圖像分析系統測定陽性染色細胞數目。
1.6.7 大鼠腦皮質組織ROCK2陽性表達水平 取“1.6.4”項下部分切片石蠟切片,于37 ℃條件脫蠟、水化、抗原修復后,加入一抗(ROCK2,1∶500),4 ℃孵育過夜后,加入羊抗兔二抗(1∶1 000),4 ℃孵育3 h,后進行DAB顯色及蘇木精溶液復染、透明、封片,于光鏡下觀察拍照,用Image Pro Plus 5.0圖像分析系統分析單位面積內棕褐色區域積分光密度值。
1.6.8 大鼠腦皮質組織Nogo-A、LPA蛋白相對表達水平 取“1.6.4”中-80 ℃保存的腦皮質組織,4 ℃解凍后,冰上勻漿分離提取蛋白,用BCA法檢測蛋白總濃度。取50 μg蛋白進行電泳、轉膜反應,并加入一抗(Nogo-A、LPA,1∶800,內參β-actin,1∶1 000),4 ℃孵育過夜,加入HRP羊抗兔二抗(1∶3 000)室溫孵育2 h,用增強化學發光法顯色,以化學發光成像儀觀察條帶并拍照,以Image-J軟件分析各組蛋白相對表達。
1.7 統計學方法 采用SPSS 22.0軟件進行分析,計量資料以“均數±標準差”()表示,單因素方差分析行多組間比較,SNK-q檢驗行進一步組間兩兩比較,P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠一般行為觀察 正常對照組大鼠無死亡,飲食及活動正常;模型組和黃芪甲苷+RhoA激動劑組大鼠有4只死亡,活動量減少;黃芪甲苷組大鼠無死亡,活動量稍有增加;RhoA激動劑組大鼠有8只死亡,活動量進一步減少。
2.2 各組大鼠腦脊液中TNF-α、NSE、PCT水平比較 與正常對照組比較,模型組大鼠腦脊液中TNF-α、NSE、PCT水平明顯升高(P<0.05);與模型組比較,黃芪甲苷組大鼠腦脊液中TNF-α、NSE、PCT水平明顯降低(P<0.05),RhoA激動劑組大鼠腦脊液中TNF-α、NSE、PCT水平明顯升高(P<0.05);黃芪甲苷+RhoA激動劑組大鼠腦脊液中NSE、PCT水平明顯高于黃芪甲苷組(P<0.05);黃芪甲苷+RhoA激動劑組大鼠腦脊液中NSE、PCT水平與模型組比較,差異無統計學意義(P>0.05)。(見表1)
表1 各組大鼠腦脊液中TNF-α、NSE、PCT 水平比較()

表1 各組大鼠腦脊液中TNF-α、NSE、PCT 水平比較()
注:與正常對照組比較,aP<0.05;與模型組比較,bP<0.05;與黃芪甲苷組比較,cP<0.05
2.3 各組大鼠腦皮質神經元細胞超微結構變化比較 正常對照組大鼠腦皮質神經元結構正常;模型組及黃芪甲苷+RhoA激動劑組大鼠腦皮質神經元損傷,可見線粒體腫脹、內質網擴張等細胞器壞死現象;黃芪甲苷組大鼠神經元較為規整,且細胞器壞死減少;RhoA激動劑組大鼠神經元損傷及細胞器變形壞死進一步加重。(見圖1)

圖1 各組大鼠腦皮質組織神經元超微結構圖(×15 000)
2.4 各組大鼠腦皮質神經元細胞凋亡率比較 模型組大鼠腦皮質神經元細胞凋亡率明顯高于正常對照組(P<0.05);黃芪甲苷組大鼠腦皮質神經元細胞凋亡率明顯低于模型組(P<0.05);RhoA激動劑組大鼠腦皮質神經元細胞凋亡率明顯高于模型組和黃芪甲苷組(P<0.05);黃芪甲苷+RhoA激動劑組大鼠腦皮質神經元細胞凋亡率明顯高于黃芪甲苷組(P<0.05);黃芪甲苷+RhoA激動劑組大鼠腦皮質神經元細胞凋亡率與模型組比較,差異無統計學意義(P>0.05)。(見圖2、表2)

圖2 大鼠腦皮質組織TUNEL 染色圖(×400)
表2 各組大鼠腦皮質組織神經元細胞凋亡率比較(,%)
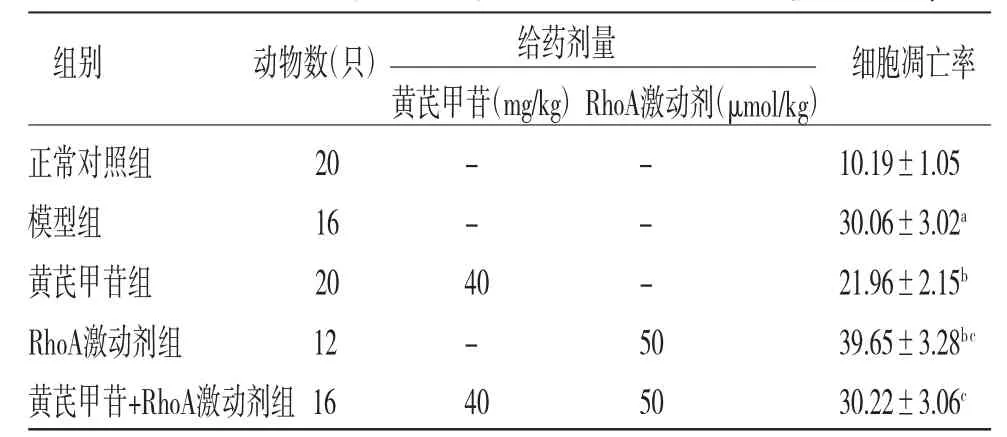
表2 各組大鼠腦皮質組織神經元細胞凋亡率比較(,%)
注:與正常對照組比較,aP<0.05;與模型組比較,bP<0.05;與黃芪甲苷組比較,cP<0.05
2.5 黃芪甲苷對大鼠腦皮質神經元細胞骨架重排的影響 F-actin為細胞骨架重排的標志分子,熒光染色顯示:正常對照組大鼠腦皮質神經元細胞胞漿中F-actin熒光表達較弱;模型組和黃芪甲苷+RhoA激動劑組大鼠F-actin的纖維形態及排列異常,出現大量板狀偽足和應力纖維;黃芪甲苷組大鼠神經元細胞漿中F-actin分布減少,神經元形態與正常對照組相近;RhoA激動劑組大鼠F-actin的纖維形態及排列異常現象進一步加重。(見圖3)

圖3 鬼筆環肽染色法檢測F-actin在神經元中的分布圖(×1000)
2.6 各組大鼠腦皮質組織RhoA與MAP2陽性表達比較 MAP2標記的神經元顯紅色熒光,RhoA可陽性表達于神經元細胞漿中。模型組大鼠RhoA+MAP2+陽性表達數目高于正常對照組(P<0.05);黃芪甲苷組大鼠RhoA+MAP2+陽性表達數目低于模型組(P<0.05);RhoA激動劑組大鼠RhoA+MAP2+陽性表達數目高于模型組和黃芪甲苷組(P<0.05);黃芪甲苷+RhoA激動劑組大鼠RhoA+MAP2+陽性表達數目高于黃芪甲苷組(P<0.05)。(見圖4、表3)

圖4 各組大鼠腦皮質組織RhoA與MAP2免疫熒光雙染圖(×200)
表3 各組大鼠腦皮質組織RhoA 與MAP2 陽性表達水平比較()

表3 各組大鼠腦皮質組織RhoA 與MAP2 陽性表達水平比較()
注:與正常對照組比較,aP<0.05;與模型組比較,bP<0.05;與黃芪甲苷組比較,cP<0.05
2.7 各組大鼠腦皮質組織中ROCK2陽性表達比較 ROCK2在正常對照組大鼠腦皮質組織神經元中呈弱陽性表達;與正常對照組比較,模型組大鼠腦皮質組織中ROCK2陽性表達明顯升高(P<0.05);與模型組比較,黃芪甲苷組大鼠腦皮質組織中ROCK2陽性表達明顯降低(P<0.05);RhoA激動劑組大鼠腦皮質組織中ROCK2陽性表達明顯高于模型組和黃芪甲苷組(P<0.05);黃芪甲苷+RhoA激動劑組大鼠腦皮質組織中ROCK2陽性表達明顯高于黃芪甲苷組(P<0.05)。(見圖5、表4)
表4 各組大鼠腦皮質組織ROCK2 陽性表達水平比較()

表4 各組大鼠腦皮質組織ROCK2 陽性表達水平比較()
注:與正常對照組比較,aP<0.05;與模型組比較,bP<0.05;與黃芪甲苷組比較,cP<0.05

圖5 各組大鼠腦皮質組織ROCK 蛋白的免疫組化染色圖(×200)
2.8 各組大鼠腦皮質組織Nogo-A、LPA蛋白表達比較 與正常對照組比較,模型組大鼠腦皮質組織中Nogo-A、LPA蛋白相對表達量明顯升高(P<0.05);與模型組比較,黃芪甲苷組大鼠腦皮質組織中Nogo-A、LPA蛋白相對表達量明顯降低(P<0.05);RhoA激動劑組大鼠腦皮質組織中Nogo-A、LPA蛋白相對表達量明顯高于模型組和黃芪甲苷組(P<0.05);黃芪甲苷+RhoA激動劑組大鼠腦皮質組織中Nogo-A、LPA蛋白相對表達量明顯高于黃芪甲苷組(P<0.05)。(見圖6、表5)

圖6 各組大鼠腦皮質組織Nogo-A、LPA 蛋白免疫印跡圖
表5 各組大鼠腦皮質組織Nogo-A、LPA 蛋白相對表達量比較()

表5 各組大鼠腦皮質組織Nogo-A、LPA 蛋白相對表達量比較()
注:與正常對照組比較,aP<0.05;與模型組比較,bP<0.05;與黃芪甲苷組比較,cP<0.05
3 討 論
BM病死率及病殘率較高,據流行病學分析,GBS感染引起的BM,可導致約10%的患兒死亡,35%左右的患兒發生神經系統后遺癥[1]。目前研究發現,BM不良預后,與GBS等致病菌感染腦膜及皮質組織后,引起的神經元損傷及凋亡有關[9]。胡婧婧等[10]認為細菌感染后引起的炎癥刺激及中樞神經損傷是導致BM患兒死亡和傷殘的主要原因,并認為BM患兒腦脊液中神經元損傷后釋放物質——NSE水平及炎癥敏感且特異的標志物——PCT等水平越高,預示BM預后及轉歸越差。TNF-α是細菌感染標志物,DINIZ A M M等[11]發現BM患者血清及腦脊液中TNF-α水平明顯高于正常人群。本研究經新生大鼠側腦室注射GBS后,大鼠腦脊液中TNF-α水平增多的同時,NSE及PCT水平也高于正常對照組,且大鼠死亡、神經元結構損傷及凋亡現象也顯著增加,提示GBS感染后,大鼠出現神經元凋亡及損傷現象,表明造模成功。臨床上常采用抗生素及糖皮質激素藥物來改善BM神經并發癥和延緩死亡進程,但隨著致病菌進化、耐藥菌增加等多種因素的產生,BM的診治問題也日益突出[12]。現代藥理發現,中藥黃芪中的活性成分黃芪甲苷具有抗鏈球菌作用[13],且對神經元也有保護作用[5],預示黃芪甲苷也可能為治療BM神經元感染性損傷的潛在藥物。本研究結果顯示,黃芪甲苷干預療BM大鼠后,大鼠死亡減少,腦脊液中TNF-α、NSE及PCT水平明顯降低,神經元結構損傷及凋亡也顯著緩解,證實了黃芪甲苷對BM大鼠神經元損傷有改善作用,但其改善作用的具體機制還需進一步研究。
RhoA/ROCK2通路在神經元分化及神經系統疾病過程中發揮了重要作用。研究[14-15]發現RhoA及ROCK2是神經元細胞骨架的重要效應分子,其激活可抑制神經軸突生長發育,引起細胞骨架重構及異常收縮,導致神經元損傷、神經軸突生長錐塌陷丟失,而參與神經退行性病變過程;體內外實驗證實RhoA/ROCK2激活可促進神經元細胞凋亡,阻斷RhoA/ROCK2通路激活,抑制神經元凋亡,促進中樞神經系統內源性修復[16-17]。本研究發現BM大鼠RhoA與腦皮質神經元陽性共表達數目增多,且ROCK2在神經元中呈強陽性表達,大鼠神經元凋亡率也顯著降低,提示BM大鼠腦皮質神經元中RhoA/ROCK2通路激活,可能是BM大鼠神經元結構損傷及凋亡的潛在影響因素。
另外,F-actin是細胞骨架重排的重要標志物,也是RhoA/ROCK2通路的下游效應分子。盧葉等[18]發現細菌感染后,TNF-α可激活RhoA/ROCK2通路,刺激F-actin在血管內皮細胞胞漿中聚集,從而促進細胞增粗、排列紊亂,引起細胞骨架重排,導致細胞通透性改變及損傷。本研究也檢測到F-actin在BM大鼠神經元中分布增多,推測細菌感染后,RhoA/ROCK2通路激活,引起下游分子F-actin在神經元中聚集,導致神經元骨架改變、損傷及凋亡。LPA可與神經元內產生的髓鞘抑制性信號效應分子——Nogo-A相互作用,促進RhoA/ROCK2通路激活及細胞骨架重排[19]。本研究于BM大鼠側腦室注射RhoA激動劑后,大鼠腦皮質神經元LPA及Nogo-A蛋白表達,RhoA/ROCK2通路激活,以及細胞F-actin分布進一步增加的同時,大鼠死亡、神經元結構損傷及凋亡也進一步加重,提示激活RhoA/ROCK2通路,可加劇BM大鼠神經元結構損傷和凋亡。XIE S H等[20]發現黃芪甲苷可通過抑制RhoA基因表達來改善腸屏障損傷,預示黃芪甲苷可能對RhoA相關通路表達有干預作用。本研究顯示黃芪甲苷改善BM大鼠神經元結構損傷及凋亡的同時,大鼠腦皮質神經元LPA及Nogo-A蛋白表達,RhoA/ROCK2通路激活,以及細胞F-actin分布均受到抑制,而RhoA激動劑LPA可逆轉黃芪甲苷的上述作用。
綜上所述,黃芪甲苷可抑制BM大鼠腦皮質神經元中RhoA/ROCK2通路激活,抑制神經元骨架重構,緩解神經元結構損傷及凋亡。這可能為黃芪甲苷治療BM的機制提供一定參考。但BM細菌遷移與神經元結構損傷的網絡機制較為復雜,黃芪甲苷改善BM神經系統損傷的其他機制,還有待后續深入研究。

